脑卒中后抑郁症临床探讨
查德喜
安徽铜陵市有色职工总医院神经内科 铜陵 244000
脑卒中后抑郁(PSD)是脑血管病常见并发症之一,其核心症状为情绪低落、兴趣缺乏、乐趣丧失[1],并有焦虑、自责、妄想、自杀观念等心理症状或出现躯体症状,如睡眠紊乱、食欲紊乱、精力丧失、晨轻夜重、性功能障碍等。它延长康复时间,加重认知功能损害,严重影响脑卒中患者的生活质量,增加脑血管疾病的致残率和病死率,给患者家人和社会带来沉重负担。为探讨脑卒中后抑郁症的发生率及相关因素,笔者对2006-03~2010-03我院收治的脑卒中患者181例进行了临床研究,现分析报道如下。
1 资料与方法
1.1 一般资料 入选患者为2006-03~2010-03我院收治的脑卒中患者181例,男100例,女81例;年龄54~76岁,平均(61.83±12.36)岁。其中脑梗死 110例,脑出血 71例。入选标准:①脑卒中的诊断:本组病人均参照全国第四届脑血管病学术会议制定的脑血管疾病诊断标准,并均经头颅CT、MRI证实;②抑郁症的诊断标准:所有抑郁症患者均符合中国精神疾病分类方案与诊断标准第3版修订本(CCMD-3-R)及国际疾病分类第10版(ICD-10)和美国精神障碍诊断手册第4版(DSM-W)的抑郁诊断标准。排除标准:脑卒中后病情严重或伴有意识障碍不能配合检查者;伴明显失语、失用不能配合检查者;有严重认知功能障碍不能配合检查者;有精神障碍者;合并严重心、肺功能衰竭或其他严重躯体疾病不能配合检查者。
1.2 方法 采用抑郁自评量表(SDS)进行评定分组,SDS总分<30分为非抑郁组,≥30分为抑郁组。抑郁组应用汉密尔顿抑郁量表(HAMD)进行抑郁程度评定,总分<8分为正常,8~20分为可能抑郁,>20~28分为轻度抑郁,29~34分为中度抑郁,≥35分为重度抑郁。采用改良的爱丁堡斯堪的那维亚卒中量表(MESSS)进行神经功能缺损评定,0~15分为轻度,16~30分为中度,31~45分为重度[2]。
1.3 统计学处理 应用SPSS 12.0软件进行单因素方差分析、F检验、χ2检验。脑卒中抑郁程度与神经功能缺损程度的关系做双向有序资料Kendall等级相关检验。
2 结果
2.1 PSD的发生率 181例患者合并PSD 83例,发生率45.9%,其中轻度抑郁20例(11.05%),中度抑郁 28例(15.47%),重度抑郁 35例(19.34%)。
2.2 PSD的发生率与患者临床资料关系比较 见表1。

表1 患者临床资料与PSD的关系
2.3 PSD的发生率与卒中情况比较 见表2。

表2 病变情况与PSD的关系
2.4 脑卒中抑郁与神经功能缺损程度的关系 见表3。由表3可见神经功能缺损程度与卒中后抑郁程度有明显相关性(χ2=4.531,P<0.01)。
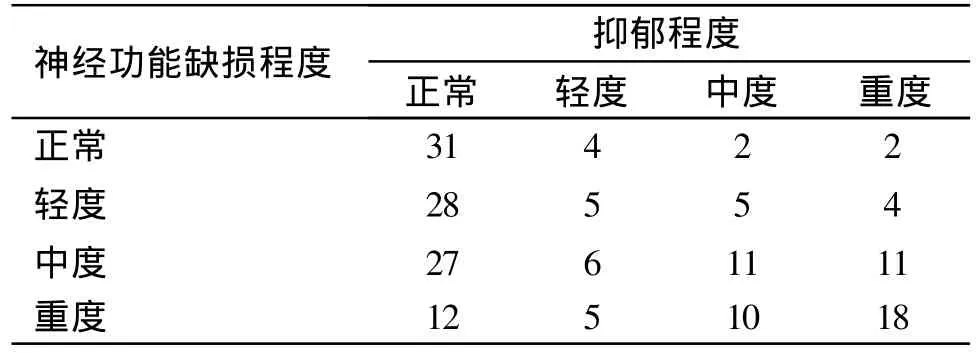
表3 脑卒中抑郁与神经功能缺损程度的关系
3 讨论
脑卒中后抑郁(post-stroke depression,PSD)是脑卒中急性期后常见的并发症,是脑卒中患者常见的心理障碍,在影响患者生活质量的同时,也在一定程度上延缓神经功能缺损的恢复,延缓日常生活活动能力和认知功能的恢复,延长患者住院时间,增加住院费用,且增加了卒中患者的病死率,此外还是病情加重或复发的独立危险因素[3]。一直受到国内外学者的广泛关注。
有关PSD的发病率,各研究差异很大,美国为20%~79%,但多数研究为30%~50%[4]。文献报道PSD发生率有所差异,可能与病例选择、病程、诊断标准不同有关。本研究发现脑卒中急性期PSD的发生率45.9%,与国内报道基本一致[5]。
脑卒中后抑郁的发病机制目前尚不清楚,多数研究认为与社会因素、神经生物学因素及神经内分泌因素有关[6]。以下两种观点受到多数学者认可:(1)源性学说认为,神经结构的各种功能活动主要是通过神经递质实现的,脑卒中时,脑血流异常变化,神经细胞缺血缺氧,脑组织水肿软化坏死,如引起边缘系统、下丘脑及额极等控制自主神经系统和复杂情绪、认知功能、睡眠、觉醒的部位受损,并出现神经内分泌改变,特别是5-羟色胺(5-HT)类神经递质、去甲肾上腺素递质系统的失调,导致脑卒中后出现睡眠障碍、焦虑、抑郁等临床表现。(2)反应性机制学说认为,卒中后家庭、社会、生理等因素综合作用,导致生理和心理平衡失调,从而产生反应性抑郁。且脑卒中后遗留有不同程度的躯体功能障碍,带来工作及生活能力的丧失,对PSD的发生起催化剂作用。两种学说分别从神经生物学及心理学角度阐述了PSD的发病机制,但两者并不冲突,在PSD的不同阶段,两者可同时存在,并相互影响,应予以综合考虑。
PSD与脑卒中部位的关系一直充满着争议[7]。普遍认为与左半球,特别是额部的病变关系更为密切[8-9]。有研究提出左侧半球前部损伤较其他部位损伤更易引发PSD,且抑郁程度更重,认为是损害了调节情绪的额叶-纹状体-苍白球-丘脑-皮质环路所致[10]。Starkstein等[11]认为 5-羟色胺(5-HT)和去甲肾上腺素(NE)能神经元位于脑干,其轴突向上辐射经过下丘脑、基底节和放射冠最终到达皮质时,纤维由前向后排列,故脑卒中时,病灶位于大脑半球前部,较后部更易损伤这些神经元而发生抑郁。Starkstein等[12]据此还推测,左侧额叶和基底节脑卒中引起的5-HT能和NE能神经元破坏较右半球脑卒中轻,其相对较少的5-HT和NE水平的下降不足,以引起代偿性的5-HT受体水平上调,故左侧脑卒中较右侧更易发生抑郁。Brody等[13]在利用PET对合并局部脑功能障碍的抑郁患者进行临床试验后发现,与边缘系统相关的结构,尤其是左侧额叶和左侧基底节的代谢活动和血流明显减慢。Kimura等[14]应用功能影像学(如SPECT、PET)对PSD患者进行研究发现,无论在抑郁发作期还是缓解期,PSD患者的局部脑血流均较非PSD患者减少,尤其在左前额区;PSD患者抑郁缓解期脑血流均较发作期增加,尤其在左前颞区。表明左额区持续低灌注可能导致抑郁发作期延长或复发率增加,左颞区活动也许是与抑郁发作有关的标志之一。本研究发现,大脑皮质额叶及皮质下基底节、丘脑的病灶更易出现抑郁,而左侧病灶并更易发生PSD。据报道,重度抑郁与左侧额叶和基底核的病变有关,轻度抑郁与枕叶和顶叶的病变有关,异常的兴奋与右额叶病变有关。抑郁是一种情感障碍,大脑边缘系统是情感活动的解剖生理学基础,纹状体-苍白球-丘脑-皮质回路的功能障碍可能导致了抑郁症。这条通路损害引起抑郁症的机制是[15]:(1)直接损害额叶、背外侧额叶和前扣带回通路;(2)损伤了脑干上行到纹状体-苍白球-丘脑-皮质回路的单胺类神经递质纤维;(3)基底神经节的损害导致眶额通路和前额叶的5-羟色胺功能紊乱。
神经功能缺损程度与抑郁的发生有明确的相关性,PSD是中、重度神经功能缺损的反映[16],脑卒中患者神经功能障碍程度越高越易发生抑郁。本研究结果显示,神经功能缺损越重,日常生活自理能力越差,抑郁程度也越重,同时病情越重,对患者的刺激也越大,如果患者的心理应激能力差,则更易加重或诱发抑郁。与Anderson等[17]的报道与此相一致,这可能是由于躯体功能丧失,直接影响了大脑皮质对下丘脑内分泌系统的调节,造成递质代谢紊乱而致病,这种患病后患者生理、心理平衡的失调被认为是PSD发生的“反应性机制”。
影响PSD的相关因素很多,本研究表明脑卒中危险因素中,高血压、糖尿病、大动脉粥样硬化对认知和情感活动的影响较大。伴该类危险因素的卒中患者PSD发病率明显高于无危险因素患者(P<0.05)。性别差异与抑郁相关,女性更易抑郁,可能与女性心理负担过重、生理因素及社会活动功能丧失或降低有关。宋文娟等报道<50岁患者的PSD发生率比50~65岁的卒中患者发生率高,与患病后丧失了原有的地位、职业、经济来源,心理负担增加有关。吸烟与PSD的发生关系不大(P>0.05)。PSD的发生严重影响了患者生活,给患者家庭社会带来了严重后果,尽早认识PSD及其相关致病因素,并及早进行干预,可减少抑郁的发生和减轻抑郁的症状,以利患者神经缺损功能的康复,改善预后。
[1]吴江,贾建平,崔丽英.神经病学[M].北京:人民卫生出版社,2005:375-376.
[2]周颖,李宗友,陆景红.中青年脑卒中后抑郁相关因素分析[J].蚌埠医学院学报,2007,32(5):126.
[3]Tharwani HM,Yerramsetty P,M annelli P,et al.Recent advances in post-stroke depression[J]. Curr Psychiatry Rep,2007,9(3):225-231.
[4]吴宇浩,王少石.卒中后抑郁[J].国外医学脑血管病分册,2005,13(9):699-702.
[5]李志彬.老年期脑卒中后抑郁与病灶关系[J].临床精神医学杂志,2004,14(1):23.
[6]Gao Z,Lin QG,Jiang C. Study on the relative factions of poststroke depression in stroke acute phase[J].zhongguo linchuang kangfu(Clin JClin Rehabil),2002,6(13):1 890-1 893.
[7]Dafer RM,Rao M,Shareef A,et al.Poststroke depression[J].Top Stroke Rehabil,2008,15:13-21.
[8]Vataja R,Leppavuori A,Pohjasvaara T,et al.Post-stroke depression and lesion location revisited[J].J Neuropsychiatry Clin Neurosci,2004,16:156-162.
[9]Narushima K,Kosier JT,Robinson RG.A reapp raisal of post stroke depression,intra-and inter-hemispheric lesion location using meta-analysis[J]. J Neuropsychiatry Clin Neurosci,2003,15:422-430.
[10]Ny s GM,van Zandvoort MJ,van der Worp HB,et al.Early depresssive symp toms after stroke:neuropsy chological correlates and lesion characteristics[J].J Neurol Sci,2005,228:27-33.
[11]Starkstein SE,Mizrahi R,Power BD.Antidepressant therapy in p ost-stroke depression[J]. Expert Opin Pharmacother,2008,9:1 291-1 298.
[12]Stark stein SE,Manes F.Apathy and depression following stroke[J].CNSSpectr,2000,5:43-50.
[13]Brody AL,Saxena S,Mandelkem MA,et al.Brain metabolic changes associated with symptom factor imp rovement in major depressive disorder[J]. Biol Psychiatry,2001,50:171-178.
[14]Kimura MShimoda K,Mizumura S,et al.Regional cerebral blood flow in vascular depression assessed by 123I-IMP SPECT[J].J Nippon Med Sch,2003,70:321-326.
[15]王立伟,赵庆莲.血管性抑郁症临床特征的比较研究[J].中国神经精神疾病杂志,2000,26(3):176-178.
[16]Pohjavaara T,Leppavuori A,Siifa I,et al. Frequency and clinical determinants of poststroke depression[J].Stroke,1998,29:2 311.
[17]Anderson G,Vestergaard K,Ingeman-Nielson MW,et al.Risk factors for dep ression after apoplexy[J].Ugeskr Laeger,1996,158(43):6 107-6 110.

