接种与调酸发酵对白菜中亚硝酸盐含量的影响
刘丛丛,纪凤娣,李 博,*
(1.中国农业大学食品科学与营养工程学院,北京10083;2.北京一轻研究院,北京100083)
我国发酵蔬菜历史悠久,其起源最早可追溯到距今3100多年前的周朝,《周礼·天官》记载:“大羹不致五味,鉶羹加盐菜矣”。四川的榨菜、泡菜,浙江的萝卜干、腌雪里蕻,扬州酱菜、玫瑰大头菜和东北的酸菜等都别具风味,深受广大群众的喜爱,不但畅销于国内,而且还远销数十个国家和地区。但是目前我国蔬菜发酵领域存在的高盐、微生物超标及亚硝酸盐安全性等问题[1-2],使人们对其消费产生顾虑,并直接影响其出口。1943年Wilson指出蔬菜中的硝酸盐可被还原为亚硝酸盐。亚硝酸盐可与机体内的胺类物质在一定条件下合成N-亚硝基化合物,简称亚硝胺。自1956年亚硝胺被证明是强致癌物以来,食品中亚硝酸盐和亚硝胺的含量及其致癌性就引起了众多食品工艺学家和营养卫生学家的关注[3-5]。近年来,国内对酱腌菜腌制过程中亚硝酸盐产生的原因,含量及消除措施等方面做了一些研究。蔬菜自然发酵过程中会形成亚硝峰[6-8],并且微生物硝酸盐还原酶对亚硝峰的形成起决定作用[9-10],而亚硝酸盐的降解则是多方面作用的结果,微生物的亚硝酸盐还原酶在亚硝峰形成前期起主要作用,有机酸则在发酵后期对亚硝酸盐的降解起主要作用[11]。这些研究对通过改进发酵工艺从而实现对亚硝酸盐的控制有积极的指导作用。本文拟通过接种乳酸菌发酵和调酸发酵工艺来解决发酵白菜中亚硝酸盐的食品安全问题,以期更好地适应中国发酵蔬菜“天然化、疗效化、低盐化以及多样化、方便化”的时代发展要求。
1 材料与方法
1.1 材料与仪器
白菜 购自中国农业大学菜市场,新鲜未经储藏;精制食用盐 北京市盐业公司;植物乳杆菌(Lactobacillus plantarum Jlab) 本实验室在白菜发酵过程中分离所得;硝酸钠、亚硝酸钠、十六烷基三甲基溴化铵 均购自Sigma(USA);MRS、结晶紫中性红胆盐琼脂、营养琼脂 皆为生化试剂,分别购自Sigma(USA)、Flucka(USA)和北京奥博星;其他所用试剂 均为分析纯。
MLS-3020全自动杀菌釜、MCO-20AIC二氧化碳培养箱 日本三洋电器有限公司;FLC-3超净工作台 哈尔滨市东联电子技术开发有限公司;LRH-250生化培养箱 上海一恒科技有限公司;pHS-25酸度计 上海雷磁;SHIMADZU LC-10A高效液相色谱 日本岛津;Cintra6GBC紫外可见分光光度计 澳大利亚;HZS-H冷冻离心机 哈尔滨市东联电子技术开发有限公司。
1.2 实验方法
1.2.1 发酵白菜的制作 自然发酵白菜的制作:将新鲜购得的白菜去掉外层菜帮和根等不可食用的部分,并弃去有病虫害的叶子,去掉菜心,洗净,切成约2cm×3cm的大小一致的小块。处理后的白菜与8%(w/v)的盐水按照质量体积比为1∶1的比例混匀后,盐渍8h,将菜取出,沥干水分。在800mL的玻璃瓶中(玻璃瓶洗净用铝箔密封后,在121℃,15min高压灭菌,烘干,共12瓶)加入蔬菜200g,然后加入6%(w/v)的盐水400mL,混匀,用铝箔将玻璃瓶密封,置于18℃恒温下发酵7d。每天取发酵白菜样品和发酵液,每次取3个平行样。
接种发酵白菜的制作:与自然发酵相同,称取预腌8h、沥干的白菜200g置于玻璃瓶中。30℃活化18~20h后的植物乳杆菌经4℃10000g 5min离心得菌体,接入400mL 6%(w/v)的盐水中,使其初始浓度为2×106CFU/mL。将含菌盐水倒入玻璃瓶中,与白菜块混匀,其他发酵条件与自然发酵相同。
调酸发酵白菜的制作:与自然发酵相同,用0.2mol/L乳酸-乳酸钠缓冲液调节盐水,使其pH分别为5.0、4.5、4.0、3.5,其他发酵条件与自然发酵相同,发酵时间为5d。
1.2.2 样品制备 发酵后的白菜取样量为100g,发酵液样品无菌操作取样40mL,按照国标GB/T 5009.33-2010的方法进行预处理。
1.2.3 pH的测定 无菌取40mL发酵液,用pH计测定其pH。
1.2.4 微生物检测 微生物检测采用平板计数法。无菌取样200g进行无菌均质(12000r/min)2min,过滤,用无菌生理盐水(0.85%,w/v)进行梯度稀释,取两个合适的稀释度,倾注平板,计数。总好氧菌(TMAB)的检测在营养琼脂培养基上,37℃下恒温培养24~28h后进行计数。乳酸菌(LAB)的检测在添加了0.2%的那他霉素(Delft,the Netherlands)的MRS培养基上,30℃下恒温培养48~72h后进行计数。肠道菌群(Enterobacteria)的检测在结晶紫中性红胆盐琼脂培养基上,30℃下恒温培养24~36h后进行计数。
1.2.5 硝酸盐的测定 发酵白菜和发酵液中硝酸盐含量的测定采用基于Ito等[12]的高效液相色谱法。进样前,样品先用0.22μm的微孔滤膜过滤。所用涂敷溶液为:含1mmol/L溴化十六烷基三甲铵(CTAB)体积比为20:80的甲醇-水溶液。流动相:pH6.2的磷酸胺(5mmol/L)-NaCl(0.1mol/L)缓冲液,流速1mL/min,进样10μL,检测波长210nm。涂敷柱温与分析样品时的柱温均设定为25℃。
1.2.6 亚硝酸盐的测定 发酵白菜和发酵液中亚硝酸盐含量的测定按照GB/T 5009.33-2010中的方法进行。其中,亚硝酸盐的标准曲线按照下述过程测定。准确称取0.1000g经硅胶干燥器干燥24h的亚硝酸钠,加去离子水溶解,移入500mL容量瓶中,加水稀释至刻度,混匀。吸取该溶液5.00mL,置于200mL容量瓶中,加水稀释至刻度,此溶液即为亚硝酸钠标准使用液。吸取0.00、2.00、3.00、4.00、5.00、6.00、7.00、8.00mL亚硝酸钠标准使用液,分别置于50mL具塞比色管中,加入2mL对氨基苯磺酸溶液(4g/L),混匀,静置3min后各加入1mL盐酸萘乙二胺溶液(2g/L),加水至刻度,混匀,静置15min,用2cm比色杯,以添加量为零的比色管调节零点,测定其在538nm处的吸光值,并绘制标准曲线。
1.2.7 统计分析 以上实验均重复三次,每次3个平行,所用数据皆为平均值。采用SPSS(SPSS 11.0)统计软件对数据进行分析,并进行单因素方差分析(ANOVA)与多重比较分析(Multiple Comparisons),显著性水平为p<0.05。
2 结果与分析
2.1 接种发酵工艺对发酵白菜的影响
2.1.1 接种发酵对发酵液pH及微生物的影响 由表1可知,经自然发酵与接种发酵处理的白菜发酵液其pH一直呈现下降的趋势,自然发酵处理5d后发酵液的pH降至4.0以下,而接种发酵处理3d后发酵液的pH就已降至4.0以下,pH下降的速度显著高于前者。赵大云等[13-14]采用接种Bacillus coagulans低盐腌渍雪里蕻时,腌菜的产酸速度也明显加快。这表明,在达到相同酸度时,采用接种发酵可以减少发酵时间,从而更适合快速即食式的产品生产。

表1 发酵过程中pH的变化Table 1 Changes of pH during the fermentation
在自然发酵与接种发酵过程中,白菜中微生物的变化见图1~图3。在接种发酵过程中,当发酵1d时,发酵液中乳酸菌的数量就达到了107CFU/mL(见图1)。在第2~4d时,基本保持在108CFU/mL。而在自然发酵过程中,发酵3d后发酵液中的乳酸菌的数量才达到107CFU/mL。总好氧菌与肠道菌群在自然发酵第2、3d后,一直保持在较高数量级上,达到108CFU/mL(见图2和图3)。而在接种发酵的处理下,总好氧菌与肠道菌群在发酵过程中的数量一直保持在较低的水平,其最高值约为106CFU/mL,显著低于自然发酵过程中的含量(p<0.05)。结合发酵液pH的变化可知,接种发酵时,白菜中的乳酸菌含量迅速增加,同时发酵液的pH快速下降,从而使总好氧菌(TMAB)和肠道菌群的生长受到抑制,使产品更安全。
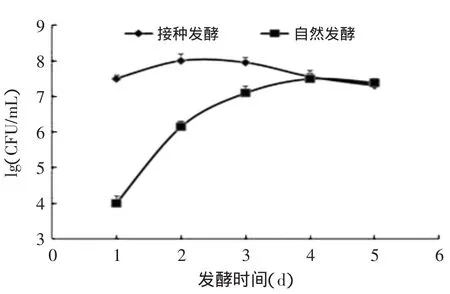
图1 发酵过程中乳酸菌的变化图Fig.1 LAB changes during the fermentation
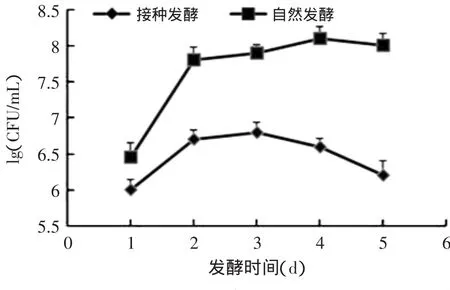
图2 发酵过程中TMAB的变化Fig.2 TMAB changes during the fermentation
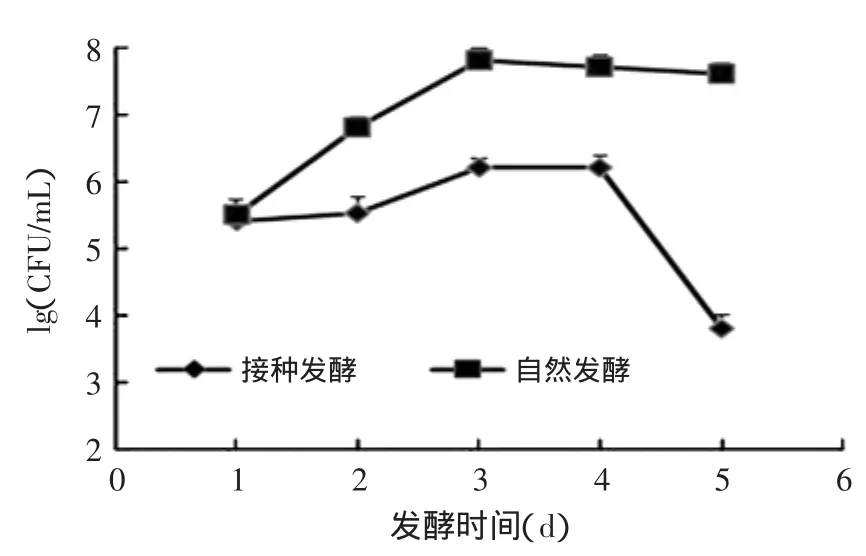
图3 发酵过程中肠道菌的变化Fig.3 Enterobacteria changes during the fermentation
2.1.2 接种发酵对白菜中硝酸盐含量的影响 由表2可知,未发酵的白菜中硝酸盐的含量很高,而发酵初始时发酵液中几乎没有硝酸盐。不管是在自然发酵还是接种发酵过程中,白菜组织中硝酸盐的含量都呈现下降的趋势,而发酵液中的硝酸盐含量都呈现上升趋势。这个结果与国内大多数人的结果相似[15-16]。这说明,白菜组织中的硝酸盐随着发酵的进行,有一部分进入了发酵液中,发酵可以降低白菜组织中的硝酸盐含量。虽然,自然发酵与接种发酵过程中,最初的硝酸盐总体含量不同,并且有显著差异(p<0.05),但发酵至第7d时,自然发酵液中硝酸盐的含量上升了8倍左右,而采用接种发酵的处理方式时,其含量上升了约12.8倍,显著高于自然发酵液中硝酸盐的含量(p<0.05),这表明,接种发酵更有利于白菜组织中的硝酸盐转移至发酵液中。
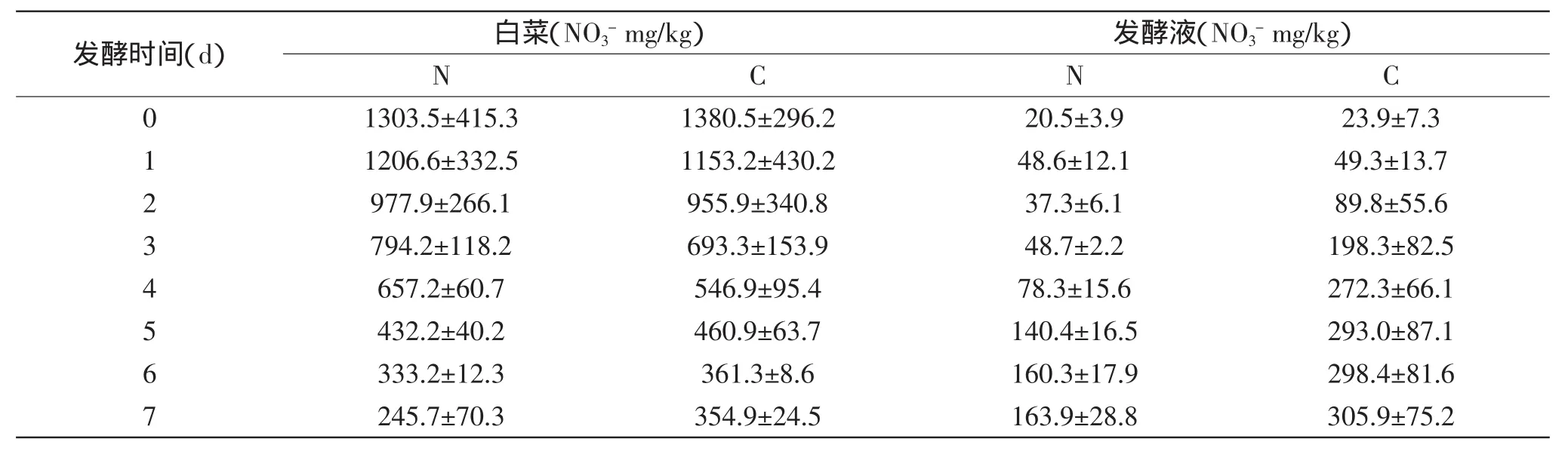
表2 接种发酵对白菜和发酵液中硝酸盐含量的影响Table 2 Effect of inoculating fermentation on nitrate content in cabbages and brine
2.1.3 接种发酵对白菜中亚硝酸盐含量的影响 由表3可知,不管是发酵液还是白菜中,样品中的亚硝酸盐含量都是先逐渐升高再降低,在第3d时亚硝酸盐含量达到最高值,到第7d时亚硝酸盐的含量降至很低的水平。而纪淑娟等[17]人的研究结果显示,室温20℃条件下,大白菜在自然发酵过程中亚硝酸盐峰值出现在第6d。蒲朝文等[15]的研究则表明,当盐浓度为6%时,腌制7d的酱腌菜中亚硝酸盐含量最高。这些结果的差异可能与发酵条件有关,吴正奇等[18]指出,亚硝酸盐峰值出现时间会受到温度、盐浓度、酸度、有害微生物的污染及含糖量的影响。自然发酵时,白菜组的亚硝酸盐含量最高可达32.6mg/kg,发酵液中亚硝酸盐含量最高为28.9mg/kg,皆高于国家安全标准(20mg/kg)。但是,采用接种发酵的处理,则在整个发酵过程中,白菜和发酵液的亚硝酸盐含量一直处于较低的水平,其平均值都不超过1mg/kg。这可能是由于发酵初期存在较多的乳酸菌,一方面使得亚硝酸盐大量的被酶降解掉,另一方面,抑制了能够使硝酸盐还原的细菌如大肠杆菌等的生长,从而使亚硝酸盐含量降低。因此,采用接种发酵工艺可以有效的减少发酵白菜中的亚硝酸盐。
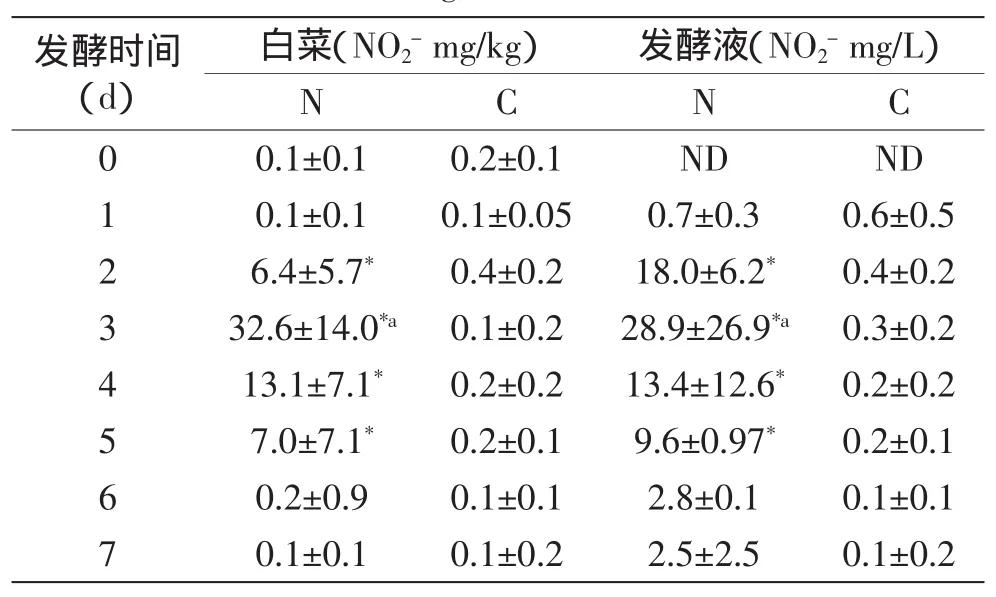
表3 接种发酵对白菜和发酵液中亚硝酸盐含量的影响Table 3 Effect of inoculating fermentation on nitrite content in cabbages and brine
2.2 调酸发酵工艺对发酵白菜的影响
2.2.1 调酸发酵对白菜中硝酸盐含量的影响 调酸发酵过程中发酵液和白菜组织中硝酸盐含量的变化见图4和图5。由图4~图5可知,发酵液的起始pH与白菜中硝酸盐的降低有直接的影响,起始pH越低,白菜中硝酸盐的降低速度越快,而发酵液中硝酸盐的含量增加的也越快。发酵结束后,发酵白菜中硝酸盐的浓度与发酵液中硝酸盐的浓度趋于一致,约为360mg/kg,显著低于白菜样品的初始硝酸盐含量。因而,控制初始发酵液的pH能够调控样品中硝酸盐向发酵液中的渗透,pH越小,渗透速度越快。
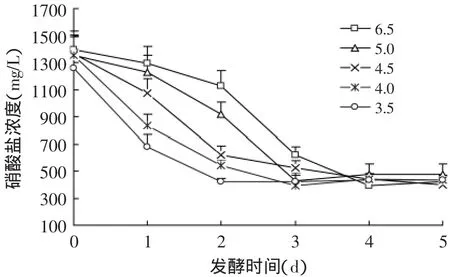
图4 调酸发酵过程中白菜中硝酸盐的变化Fig.4 Changes of nitrate in cabbages during the adjusting acid fermentation
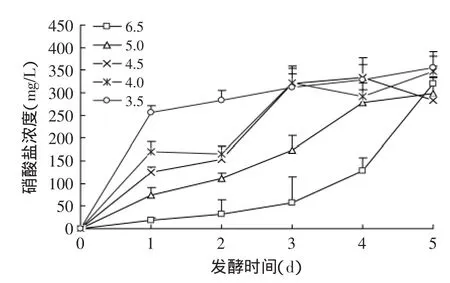
图5 调酸发酵过程中发酵液硝酸盐的变化Fig.5 Changes of nitrate in brine during the adjusting acid fermentation
2.2.2 调酸发酵对白菜中亚硝酸盐含量的影响 调酸发酵过程中发酵液pH的变化见图6。在自然处理(pH为6.5)与酸调初始pH为5.0、4.5的处理下,发酵液pH随着发酵的进行而逐渐降低。而酸调初始pH为4.0、3.5时,在5d的发酵时间内,发酵液的pH比较稳定,并没有显著变化(p>0.05)。
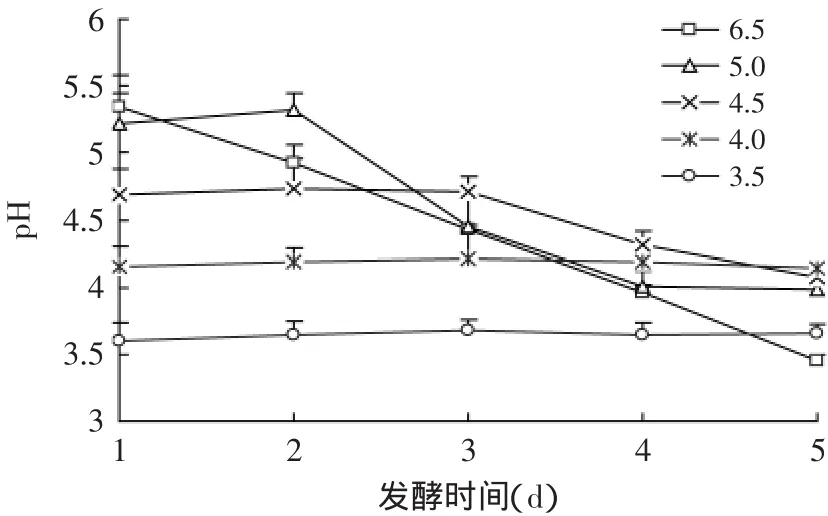
图6 调酸发酵过程中pH的变化Fig.6 Changes of pH during the adjusting acid fermentation
由表4、表5可知,自然发酵中不管是发酵液中还是发酵白菜中亚硝酸盐都会出现一个比较高的峰值,峰值出现时,此时发酵液的pH约为4.5(见图6)。调制初始pH为5.0的处理时,峰值亚硝酸盐的含量显著低于自然发酵未调酸的对照(p<0.05)。而当调制液的初始pH低于4.5时,发酵过程中不会形成亚硝酸盐的峰值,亚硝酸盐的含量<3mg/kg,显著低于自然对照与调制为初始pH为5.0的处理(p<0.05)。这一结果与张少颖的研究相似[4],其研究表明,降低发酵液初始pH可以抑制泡菜发酵过程中的硝酸还原酶活性,从而降低样品中亚硝酸盐的含量。因此,酸调初始发酵液的pH<4.5时,可以减少发酵白菜中的亚硝盐含量,使其符合国家安全标准。
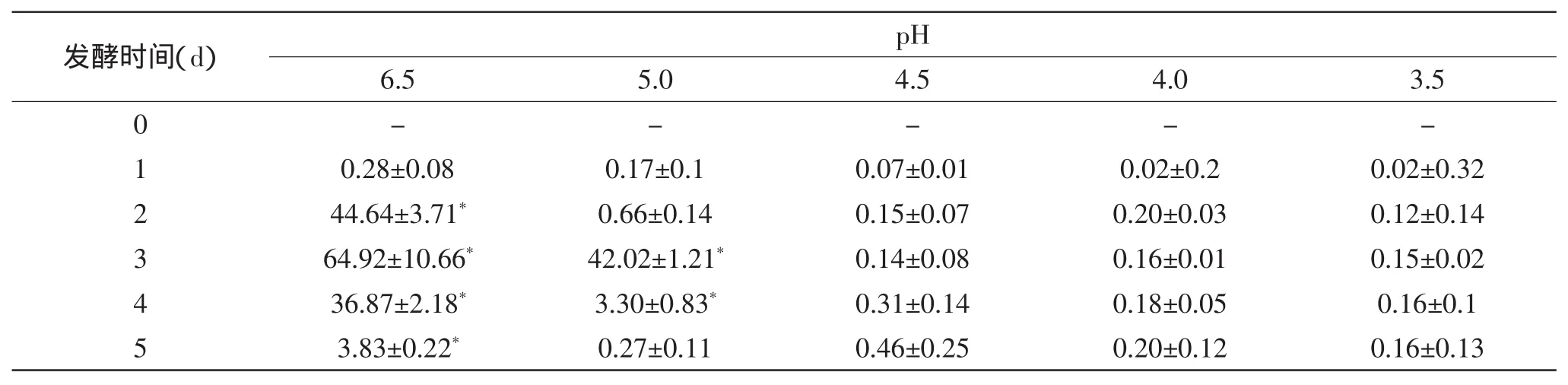
表4 发酵过程中发酵液中亚硝酸盐的变化(mg/L)Table 4 Changes of nitrite in brine during the fermentation(mg/L)
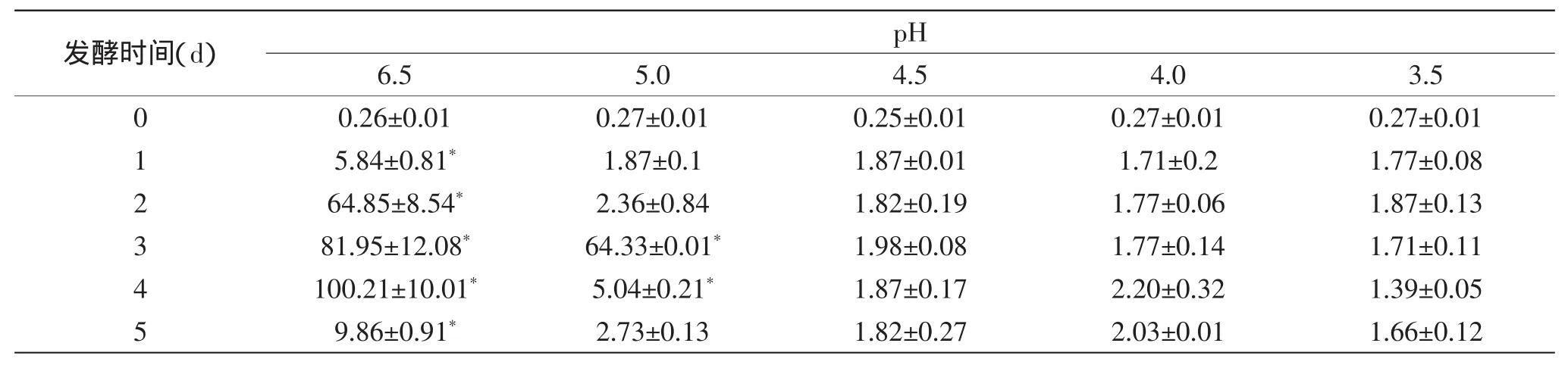
表5 发酵过程中白菜中亚硝酸盐的变化(mg/L)Table 5 Changes of nitrite in Chinese cabbages during the fermentation(mg/L)
3 结论
当接种初始浓度为2×106CFU/mL的乳酸菌进行发酵时,白菜中亚硝酸盐含量平均值不超过1mg/kg,没有明显的峰值形成,并且白菜中硝酸盐的含量也显著低于自然发酵的处理。对初始发酵液进行酸调,能够对发酵过程中亚硝酸盐的形成产生影响,将初始发酵液的pH调至低于4.5时,可以抑制发酵过程中亚硝酸盐的产生,使其低于3mg/kg。从降低亚硝酸盐的角度考虑,接种与调酸发酵工艺都能使发酵白菜中亚硝酸盐含量低于国家安全标准,比自然发酵工艺对人体健康更为有利。
[1]杨惠芬,黄流生,谢斌,等.食品中亚硝酸盐允许限量的研究[J].卫生研究,1995,24(3):176-178.
[2]岳虹.腌制菜亚硝酸盐含量的调查分析[J].太原师范学院学报,2011,10(3):140-143.
[3]马俪珍,南庆贤,方长法.N-亚硝胺类化合物与食品安全性[J].农产品加工·学刊,2005(12):8-14.
[4]张少颖.不同处理方法对泡菜发酵过程中亚硝酸盐含量的影响[J].中国食品学报,2011,11(1):133-138.
[5]石振兴,胡永金,朱仁俊.腌制蔬菜的品质及亚硝酸盐问题研究进展[J].中国调味品,2009,34(5):25-28.
[6]刘玉龙.大白菜腌制过程中亚硝酸盐形成规律的研究[D].沈阳:沈阳农业大学,1985.
[7]李基银.腌菜质量与卫生[M].北京:轻工业出版社,1998,16-18.
[8]潘枫.北方酸菜中亚硝酸盐生成规律的研究[J].中国酿造,1988,(6):28-31.
[9]燕平梅,薛文通,张慧,等.不同贮藏蔬菜中亚硝酸盐变化的研究[J].食品科学,2006,27(6):242-246.
[10]纪淑娟,孟宪军.大白菜发酵过程中亚硝酸盐消长规律的研究[J].食品与发酵工业,2001,27(2):42-46.
[11]张庆芳.蔬菜腌渍发酵亚硝酸盐降解机理和提高白菜品质方法的研究[D].沈阳:沈阳农业大学,2001.
[12]Ito K,Ariyoshi Y,Tanabiki F,et al.Anion chromatography using octadecylsilane reversed-phase columns coated with cetyltrimethylammonium and its application to nitrite and nitrate in seawater[J].Analytical Chemistry,1991,6(3):273-276.
[13]赵大云,丁霄霖.接种Bacillus coagulans低盐腌渍雪里蕻的探讨(Ⅰ)[J].中国酿造,2000(6):9-12.
[14]赵大云,丁霄霖.接种Bacillus coagulans低盐腌渍雪里蕻的探讨(II)[J].中国酿造,2001(1):16-20.
[15]郭晓红,杨洁彬,张建军.甘兰乳酸发酵过程中亚硝峰消长机制及抑制途径的研究[J].食品与发酵工业,1989(2):26-34.
[16]何淑玲,李博,籍保平.泡菜发酵过程中硝酸盐还原酶活性的研究[J].食品科技,2005(1):94-97.
[17]蒲朝文,夏传福,谢朝怀,等.酱腌菜腌制过程中亚硝酸盐含量动态变化及消除措施的研究 [J].卫生研究,2001,30(6):352-354.
[18]吴正奇,凌秀菊.酱腌菜生产过程中亚硝酸盐和亚硝胺的产生与预防[J].中国调味品,1996(8):8-12.

