PPAR-α激动剂对PAN诱导肾小球足细胞损伤的保护作用
许俊铭,潘方瑜,刘 源,岳晓阳,邹 军
(1.厦门大学基础医学系,福建 厦门 361102;2.重庆医科大学附属第一医院,重庆 404100)
局灶性肾小球硬化(FSGS)是多种肾脏疾病发展的最终结局,同时也是肾单位退行性病变的必经之路。足细胞是一种高度分化的细胞,足细胞分裂增殖能力有限,一旦损伤丢失就很难再生,其病变所致的足细胞肥大、足突融合、肾小球基膜(GBM)裸露等一系列变化将最终导致肾小球硬化的发生[1]。
PPAR-α是一种核受体转录因子,高表达于脂肪酸代谢旺盛的组织中,如脂肪组织、肝脏、心脏以及肾脏皮质,PPAR-α在机体内作用广泛,除调节脂代谢外,还具有抗炎、抗纤维化作用。研究表明[1],PPAR-α在代谢紊乱综合征的病理过程及其相关肾脏并发症中具有关键作用。PPAR-α激动剂能够明显改善2型糖尿病小鼠尿蛋白水平和肾小球纤维化程度[1-3]。另外一些研究表明[1,4],PPAR-α缺失的小鼠经DOX处理后出现更严重的尿蛋白以及肾小球足细胞缺失。尽管在许多肾脏疾病中,PPAR-α都表现出保护作用,但是其在氨基核苷嘌呤霉素(PAN)诱导的大鼠肾小球足细胞损伤中的作用报道较少。因此,我们拟通过建立PAN大鼠肾小球足细胞损伤模型,以尿蛋白水平的上升和足细胞损伤标志物desmin的表达上调作为成模型标准,通过PPAR-α特异性激动剂非诺贝特予以治疗,探索PPAR-α激动剂非诺贝特对足细胞损伤的作用及其机制。
1 材料与方法
1.1 实验动物 ♀ SPF级8周龄Sprague-Dawley(SD)大鼠18只,体质量190~210 g(购自上海斯莱克实验动物有限责任公司)。
1.2 试剂与仪器 PAN(ENZO Life Science corporation,USA);非诺贝特(Sigma,USA);Bradford蛋白浓度测定试剂盒(BIO-RAD,USA);ECL(Millipore,USA);TRIzol(Invitrogen corporation,USA);逆转录试剂盒(Thermo Fisher,USA);SYBR实时荧光定量PCR试剂盒(TaKaRa,Japan);Desmin rabbit antibody(Dako Cytomation,USA);GAPDH rabbitantibody(Abcam,USA);HRP标记羊抗兔二抗(北京联科生物公司,北京);冷冻离心机(Eppendorf,USA);PCR仪(Thermo Fisher,USA);实时荧光定量 PCR仪(ABI,USA);酶标仪(Molecular Device,USA)。
1.3 实验方法
1.3.1 动物模型制备及分组 SD大鼠18只,随机分为3组:空白对照组(CON组)、PAN模型组(PAN组)、非诺贝特治疗组(FEN组)。PAN组和FEN组以65 mg·kg-1体重一次尾静脉注射PAN(溶解于生理盐水),CON组一次尾静脉注射等体积生理盐水。尾静脉注射PAN制作模型1 d后,FEN组每日每只以40 mg·kg-1体重非诺贝特灌胃,CON组和PAN每日给予等量的饮用水。分别于造模前1 d(d 0),造模后 d 6(d 6),造模后 d 10(d 10),收集 24 h尿样测定尿蛋白浓度,计算24 h尿蛋白量。d 10对大鼠进行安乐死,取出肾脏,收集肾皮质并剪成小块,置于60目灭菌筛网上进行研磨,同时以PBS进行冲洗,富含肾小球的部分将掉落于下层的100目筛网上,再以PBS进行冲洗,置于最底层的160目筛网将收集最终的肾小球样本。
1.3.2 Western blot 加入适量裂解液(8 mol·L-1urea,1 mmol·L-1DTT,1 mmol·L-1EDTA,50 mmol·L-1Tris-HCL,pH=8.0)于肾小球样本内,提取总蛋白,利用Bradford法测定蛋白浓度。取20 μg蛋白样本进行SDS-PAGE凝胶电泳,电泳结束后,将蛋白转印到PVDF膜上,5%封闭液室温封闭1 h,一抗孵育4℃过夜,二抗室温孵育40 min,孵育ECL,显影曝光。
1.3.3 mRNA检测 利用TRIzol试剂盒提取肾小球总RNA(按说明书操作)。取RNA 2μg,加primer-oligo(dT)181μl,补加 DEPC处理水至 12μl,65℃预变性5min。取出后促冷,分别加入5×Reaction buffer 4μl;Ribo lock 1μl;10 mmol·L-1dNTP 2μl;Revert Aid 1μl,按如下条件进行逆转录反应:42.0℃ 60 min;70.0℃ 5 min;95.0℃ 5 min;4.0℃保存。
取逆转录产物cDNA进行Real Time PCR,反应体系:cDNA 1μl;SYBR Taq酶混合物10μl;ROX 0.4μl;Primer F 0.5μl;Primer R 0.5μl,灭菌水补足至20μl。按如下反应体系进行Real Time PCR,循环数为 40,95.0℃ 1 min(预变性阶段);95.0℃15 s(变性阶段);60.0℃ 31 s(退火阶段)。收集结果,双ΔCt法分析结果。相关引物序列:bax F:5′-AGACACCTGAGCTGACCTTGGA-3′;bax R:5′-TTGAAGTTGCCATCAGCAAACA-3′;Caspase-3 F:5′-GAGACAGACAGTGGAACTGACGATG-3′; caspase-3 R:5′-GGCGCAAAGTGACTGGATGA-3′;p38F:5′-CCGAG CGATACCAGAAC-3′;p38 R:5′-CACATC CAACAGACCAATC-3′;GAPDH F:5′-ACCACAGTC CATGCCATCAC-3′;GAPDH R:5′-TCCACCACCCT GTTGCTGTA-3′;desmin F:5′-TCTTTATTGTTTCT GTCCAGGG-3′;desmin R:5′-GCTGTAAGAGAGAA CTGGAAGG-3′;Vimentin F:5′-CGTTTCCAAGCCT GACCTCACG-3′;Vimentin F:5′-GCCATCTTTACAT TGAGCAGGT-3′;TGF-βF:5′-CATTGCTGTCCCGT GCAGA-3′;TGF-βR:5′-AGGTAACGCCAGGAATT GTTGCTA-3′;Smad-7 F:5′-TGCTGTGCAAAGTGTT CAGGTG-3′; Smad-7 R:5′-CCATCGGGTATCTGG AGTAAGGA-3′;ZO-1 F:5′-GCACTGCAACGCTGCC TTTA-3′;ZO-1 R;5′-TTCTCGTGTCTCTGGAGCAG GTA-3′;α-actinin F:5′-GCGAGTGCACAAGATCTC CAAC-3′;α-actinin R:5′-CATGCCCAGGGTCATCTT CA-3′;podocin F:5′-AATTCCTTGTGCAAACCACT ATGA-3′;podocin R:5′-CCAAGGCAACCTTTGCA TCT-3′。
1.4 数据统计分析 采用SPSS 11.0软件进行统计学分析。计量资料采用s表示,计数资料采用百分比表示,计量资料之间差距,采用方差分析进行比较,计数资料间的差距采用卡方检验进行比较。
2 结果
2.1 非诺贝特降低PAN诱导的大鼠24 h尿蛋白水平 注射PAN造模后,PAN组24 h尿蛋白水平在d10明显上升,FEN组给予非诺贝特治疗之后24 h尿蛋白水平较PAN组下降了45%(Fig 1,P<0.01)。
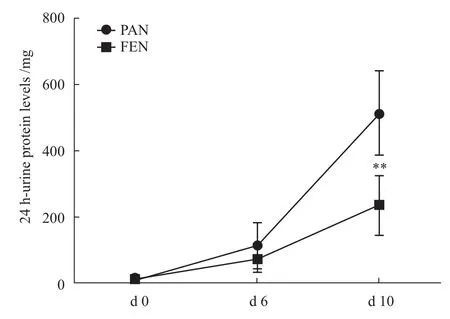
Fig 1 24 h-urine protein levels between PAN model group and fenofibrate treated group**P<0.01 vs PAN
2.2 非诺贝特降低足细胞损伤标记物的转录和表达水平 在PAN诱导足细胞损伤后,足细胞损伤标志物Desmin较空白对照组转录和表达水平明显增加;给予非诺贝特治疗后,Desmin转录和表达蛋白水平均较 PAN组下降(Fig 2,A、B,P<0.01)。免疫荧光结果进一步证实这一变化(Fig 2,C)。

Fig 2 Effect of fenofibrate on podocyte injury markerA:Effectof fenofibrate on expression of desmin;B:Effectof fenofibrate on transcription activity of desmin;C:Immunofluorescence photomicrographs of desmin.**P<0.01 vs PAN;##P<0.01 vs CON
2.3 非诺贝特改善足细胞骨架相关蛋白的蛋白表达及转录活性 足细胞遭受损伤后往往会产生一些代偿性变化如肥大,以维持正常的功能。我们为了探索PPAR-α的激活对这一变化的影响,所以检测了与细胞肥大相关的细胞骨架基因的转录水平。Real-Time PCR结果显示,足细胞骨架蛋白vimentin的蛋白表达和转录活性在PAN诱导足细胞损伤后均明显增加,其中转录水平达到空白对照组的两倍左右,而在非诺贝特处理后,基因转录活性和蛋白表达明显下降(Fig 3,A)。此外,足细胞其他骨架蛋白nestin和 α-actinin的转录水平和 vimentin相一致(Fig 3,B、C)。足突相互连接形成的裂孔隔膜是肾小球滤过屏障选择性滤过的主要决定因素之一[5],也是肾小球滤过机械屏障的关键。本研究中,我们检测足突裂孔隔膜相关蛋白的转录活性,发现模型组中,podocin、ZO-1的转录水平增加,其中podocin的转录活性达到空白对照组的2.5倍。在非诺贝特组,podocin、ZO-1恢复到空白对照水平。但裂孔隔膜蛋白nephrin的转录水平并没有明显变化(结果未显示)(Fig 3,D、E)。
2.4 非诺贝特抑制凋亡相关基因的表达和转录活性 足细胞凋亡是足细胞损伤重要的病理特征,因此,我们检测了凋亡通路中的关键因子的转录水平,探索非诺贝特对于足细胞凋亡的影响。结果显示,PAN造模后,凋亡因子caspase-3的蛋白表达及其活性片段含量明显增加,给予非诺贝特处理后caspase-3蛋白表达及其活性片段含量明显减少,基本恢复到空白对照组水平,其基因转录水平和蛋白表达趋势统一(Fig 4A,P<0.01)。bax基因转录活性变化与caspase-3相一致,在非诺贝特处理后明显下调(Fig 4B,P<0.01)。而凋亡保护性因子bcl-2的转录水平并没有明显变化(结果未显示)。另外,有研究显示,TGF-β/Smad信号通路激活和 p38通路的激活都会足细胞产生凋亡,因此,在本研究中我们同时检测了TGF-β/Smad-7和p38通路的活性。PAN诱导足细胞损伤后,TGF-β/Smad-7通路转录活性达到空白对照组的两倍以上(Fig 4C、D,P<0.01);经过非诺贝特治疗后,TGF-β和Smad-7的转录水平较PAN模型组下降31%和37%。(Fig 4,C、D,P<0.01)。p38的结果和 TGF-β/Smad-7基因结果一致(Fig 4,E)。

Fig 3 Effect of fenofibrate on podocyte cytoskeletal and junction proteinA:Expression and transcription activity of vimentin;B,C:Transcription activity of nestin and ZO-1;D,E:Transcription activity of podocin andαactinin.##P<0.01 vs CON;**P<0.01 vs PAN

Fig 4 Effect of fenofibrate on podocyte apoptosisA:Expression and transcription activity of caspase-3;B:Transcription activity of Bax;C,D:Transcription activity of TGF-β/Smad-7;E:Transcription activity of p38.##P<0.01 vs CON;**P<0.01 vs PAN
3 讨论
本研究通过PAN建立大鼠肾小球足细胞损伤模型,探索非诺贝特在PAN诱导的肾小球足细胞损伤中的作用。结果显示PAN诱导足细胞损伤后,尿蛋白水平明显增加,足细胞损伤标志物Desmin表达和转录明显上调,表明足细胞损伤模型成功建立,而给予非诺贝特进行治疗可以明显减少尿蛋白的排泄,下调desmin转录和表达活性,恢复足细胞骨架蛋白和裂隙膜蛋白的蛋白表达和转录水平,明显抑制细胞线粒体凋亡通路和TGF-β/Smd-7通路和p38信号通路的转录和转录活性,改善足细胞损伤。因此,我们的研究表明非诺贝特对PAN引起的大鼠足细胞损伤具有保护作用,能够改善蛋白尿水平,其机制与抑制足细胞凋亡通路有关。
嘌呤霉素常常被用来构建肾病大鼠模型,该模型是研究微小病变型肾(MCNS)和局灶节段性肾小球硬化的理想动物模型,其最主要的临床特征为大量蛋白尿[6],足细胞损伤和凋亡是PAN大鼠模型另一个重要的病理表现。越来越多的研究表明PPAR-α具有肾脏保护作用[7],在小鼠中PPAR-α的激活可以改善DOX导致足细胞损伤。另外,其他研究表明贝特类药物能够通过激活PPAR-α,减少顺铂和阿霉素引起的肾小管损伤。在动物实验中,PPAR-α缺失导致对肾小球肾炎的敏感性增加[7]。我们的研究显示,通过静脉注射PAN诱导大鼠足细胞损伤,引起大鼠尿蛋白水平的明显增加,而在给予非诺贝特进行治疗后,尿蛋白水平减轻。Desmin蛋白是一种细胞骨架丝蛋白,其可作为足细胞损伤的标志性蛋白[8],正常情况下Desmin蛋白在肾小球足细胞无明显表达,当足细胞因各种原因发生损伤时可大量表达,其可能原因是足细胞骨架重新排列。我们的研究中,PAN处理后,Desmin的转录和表达均明显上升,而在非诺贝特治疗后则明显下降,与尿蛋白的变化趋势一致。
此外,我们还检测了足细胞骨架蛋白和裂隙膜蛋白在PAN处理后的变化。结果显示,PAN处理后足细胞骨架蛋白vimentin的转录和表达水平明显上调,其他骨架蛋白nestin、α-actinin的变化与其一致,这可能是因为PAN诱导足细胞损伤后,一些足细胞发生凋亡,剩余的足细胞为了覆盖裸露的基底膜(GBM)而产生代偿性肥大,以阻止蛋白从裂孔中漏出[9];非诺贝特治疗后,足细胞的损伤和凋亡程度减轻,足细胞代偿性肥大减少,骨架蛋白的的转录活性下降。此外,裂孔隔膜是肾小球滤过屏障选择性滤过的主要决定因素之一,因此我们探索了非诺贝特治疗PAN足细胞损伤过程中对裂隙膜蛋白的影响,Real-time PCR结果显示,在PAN处理后podocin、α-actinin的转录水平明显增加,在非诺贝特处理后其转录活性下降,可能的机制是PAN诱导足细胞损伤和凋亡后,裂孔隔膜遭到破坏,导致相关蛋白代偿性转录增加,非诺贝特治疗后损伤减轻,因此裂孔隔膜相关蛋白转录下降。但是nephrin的转录活性在PAN处理后未产生明显变化,推测裂孔隔膜中nephrin并非PAN的损伤靶点。
在PAN大鼠足细胞损伤模型中,足细胞凋亡是其常见的重要病理特征[7]。在体外实验中,PAN仍可以诱导体外小鼠足细胞凋亡。因此,本研究中我们检测了非诺贝特对凋亡通路表达和转录活性的影响。结果表明,线粒体凋亡通路中caspase-3在PAN处理后表达和转录活性明显增加,非诺贝特处理后的蛋白表达和转录活性受到明显抑制,而bax的结果则进一步显示了非诺贝特在线粒体凋亡通路中的作用,因此推测非诺贝特可能通过下调线粒体凋亡通路,减少足细胞的损伤和凋亡进而产生保护作用。此外,许多研究表明TGF-β在肾小球疾病中具有重要作用,TGF-β对肾小球细胞的增生、肥大、凋亡以及局部和全身免疫反应具有重要作用,而且TGF-β是肾小球硬化 (FSGS)的重要介质[7,10],TGF-β/Smad信号通路激活是足细胞凋亡重要的启动因素[7,11]。本研究的结果和以前研究一致,PAN诱导足细胞损伤后,TGF-β和Smad-7的转录水平明显增加,达到空白对照组的两倍以上,而非诺贝特的治疗则明显降低了TGF-β和Smad-7的转录水平,这提示TGF-β/Smad信号通路可能也是非诺贝特发挥足细胞保护作用的作用靶点。最后,以前的研究显示p38的激活可以在体外诱导大鼠足细胞的凋亡[12],因此本研究也初步探索了非诺贝特对于p38的影响,发现p38转录活性在PAN诱导足细胞损伤后明显上调,经非诺贝特处理后则受到抑制,这表明非诺贝特可能也通过p38信号通路产生保护作用。
综上所述,PPAR-α激动剂非诺贝特对足细胞损伤具有重要的保护作用,其机制可能是通过抑制凋亡通路的活性而产生。本研究为非诺贝特在临床的新用途提供了有力的实验支持。然而,非诺贝特抑制足细胞损伤引起的肾小球疾病的具体作用机制仍需进一步深入研究。
参考文献:
[1] Mundel P,KrizW.Structure and function of podocytes:An update[J].Anat Embryol,1995,192(5):385-97.
[2] Park CW,Kim H W,Ko S H,et al.Accelerated diabetic nephropathy inmice lacking the peroxisome proliferator-activated receptor alpha[J].Diabetes,2006;55:885-93.
[3] Park CW,Zhang Y,Zhang X,etal.PPAR-alpha agonist fenofibrate improves diabetic nephropathy in db/db mice[J].Kidney Int,2006,69:1511-7.
[4] Zhou Y,Kong X,Zhao P,et al.Peroxisome proliferator-activated receptor-αis renoprotective in doxorubicin-induced glomerular injury[J].Kidney Int,2011,79(12):1302-11.
[5] Arif E,Rathore Y S,Kumari B,et al.Slit diaphragm protein Neph1 and its signaling:a novel therapeutic target for protection of podocytes against glomerular injury[J].JBiol Chem,2014,289(14):9502-18.
[6] Seckin I,Uzunalan M,Kokturk S,et al.Experimentally induced puromycine aminonucleoside nephrosis(PAN)in rats:evaluation of angiogenic protein platelet-derived endothelial cell growth factor(PD-ECGF)expression in glomeruli[J].J Biomed Sci,2012,19(1):24.
[7] Wen D,Li Y,Zhang Q,et al.Upregulation of nestin protects podocytes from apoptosis inducedby puromycin aminonucleoside[J].Am JNephrol,2011,34:423-34.
[8] Floege J,Alpers C E,Sage E H,et al.Markers of complementdependent and complement-independent glo-merular visceral epithelial cell injury in vivo[J].Expression of antiadhesive proteins and cytoskeletal changes J.Lab Invest,1992,67(4):486-97.
[9] 李卫国.足细胞对损伤的反应[J].临床儿科杂志,2012,30(4):1091-4.
[9] LiW G.Podocyte response to injury[J].J Clin Pediatr,2012,30(4):1091-4.
[10]刘国元.TGF-B1与肾小球硬化关系的研究[J].国外医学·泌尿系统分册,2002,22(6):361-4.
[10]Li Y G.Relationsbetween TGF-β1 and glomerulosclerosis[J].Foreign Med Sci(Urol Nephrol Foreign Med Sci),2002,22(6):361-4.
[11]Lee H S,Song C Y.Effects of TGF-beta on podocyte growth and disease progression in proliferative podocytopathies[J].Kidney Blood Press Res,2010,33(1):24-9.
[12]Chen C,LiangW,Jia J,et al.Aldosterone induces apoptosis in rat podocytes:Role of PI3-K/Akt and p38MAPK signaling pathways[J].Nephron Exp Nephrol,2009,113(1):e26-34.

