类风湿关节炎患者治疗前后血清分泌型磷脂酶A2变化
张 永,陶金辉,李向培,方 璇,厉小梅,汪国生,钱 龙
(安徽医科大学附属省立医院风湿免疫科,合肥 230001)
类风湿关节炎(rheumatoid arthritis,RA)是以对称性多关节炎为主要临床表现的异质性、系统性、自身免疫性疾病。主要临床表现为小关节滑膜炎所致的关节肿痛,最终可致残。文献报道,RA患者发生动脉粥样硬化的比例远高于正常人,且RA治疗后其发生动脉粥样硬化的比例也增高[1-3]。有研究报道,血清分泌型磷脂酶A2(secreted phospholipase A2,sPLA2)可能参与了动脉粥样硬化的发生,是冠状动脉疾病和心血管疾病的独立风险预测因子[4]。本研究通过检测RA患者血清sPLA2-ⅡA在治疗前后的变化,并分析其与其他炎性指标的关系,探讨sPLA2在RA发病及并发动脉粥样硬化中的作用。
对象与方法
对象
选择安徽省立医院风湿免疫科门诊及住院RA患者,诊断均符合美国风湿病协会1987年RA分类诊断标准[5]。正常对照者为本院健康体检者。
方法
(1)收集RA患者临床资料,包括一般情况、临床表现及治疗情况。(2)常规检测血常规、红细胞沉降率(erythrocyte sedimentation rate,ESR)(魏氏法)、C反应蛋白(C-reactin protein,CRP)(免疫比浊法),计算疾病活动性评分(disease activity score,DAS28)、血清sPLA2治疗前后差值(治疗前水平-治疗后水平)和变化率(治疗前后差值/治疗前水平)。(3)采集RA患者与正常对照者静脉血5 ml于普通试管中,离心后血清-20℃保存待测。采用酶联免疫吸附法检测RA及正常对照组血清sPLA2,具体操作按说明书进行。主要操作步骤:将待测血清以1∶20稀释;取稀释后血清、标准品加到反应小孔,每孔加100 μl,加Fab sPLA2抗体100 μl;将标准板放在4℃冰箱里孵育过夜,使其充分反应。次日将标准板置于洗板机上充分洗脱后加200 μl显色液,放在摇床上使其充分反应;将标准板放在酶标仪上(405nm波长),测其光密度(optical density,OD)值(吸光度)。
统计学处理
定量资料不符合正态分布时采用非参数检验,符合正态分布时采用t检验;相关性分析采用Spearman相关分析。所有统计分析采用SPASS17.0软件进行,P<0.05为差异有统计学意义。
结 果
一般资料
治疗前RA患者91例,女82例,男9例,平均年龄(43.62±11.89)岁;其中收集了54例患者治疗3个月前后的资料,女50例,男4例,平均年龄(41.09±12.04)岁。正常对照组14例,女12例,男2例,平均年龄(45.9±11.3)岁。
所有RA患者均常规使用改善病情抗风湿药,其中14例合并使用小剂量糖皮质激素(泼尼松10 mg/d)。
治疗前后血清sPLA2变化
RA患者治疗前血清sPLA2浓度为(224.10±30.17) pg/ml,治疗后(192.19±41.14) pg/ml,正常对照者为(110.05±24.02) pg/ml。RA患者治疗前与治疗后血清sPLA2浓度比较差异无统计学意义(P>0.05);RA患者治疗前血清sPLA2浓度较正常对照者高,差异有统计学意义(P<0.05);治疗后和正常对照者比较差异无统计学意义(P>0.05)(图1)。
相关性分析
Spearman相关分析显示,RA患者治疗前血清sPLA2升高,且与DAS28、ESR、CRP、血小板呈正相关,与年龄无关;治疗后血清sPLA2减低,与DAS28、ESR、CRP、血小板、年龄均无相关性(表1,图2、3)。
小剂量糖皮质激素治疗前后血清sPLA2变化
54例有治疗3个月前后资料的RA患者中,使用小剂量糖皮质激素者14例,纳入使用激素组;未使用者40例,剔除其中使用甲氨蝶呤、来氟米特以外的其他免疫抑制剂及中药病例20例,剩余20例纳入未使用激素组。2组应用慢作用药、非甾体抗炎药相同。比较使用激素组和未使用激素组血清sPLA2治疗前后差值和变化率,使用激素组治疗后血清sPLA2明显降低,变化率较未使用激素组明显增高,差异有统计学意义(P<0.05)(表2)。

图1类风湿关节炎患者治疗前后血清分泌型磷脂酶A2变化
Fig1Changes of serum secreted phospholipase A2 before and after treatments in rheumatoid arthritis patients

表1 类风湿关节炎患者血清分泌型磷脂酶A2相关因素分析
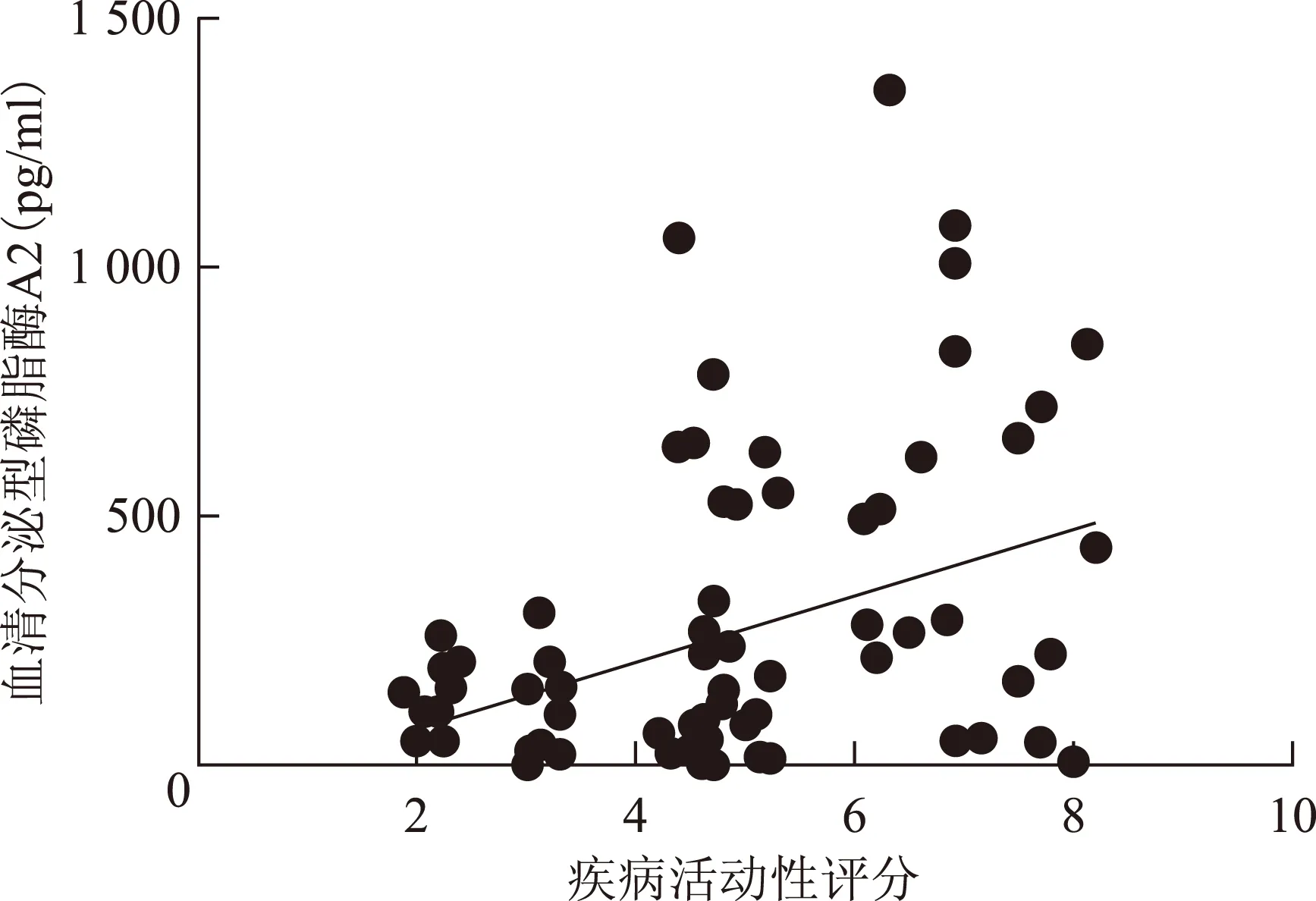
图2类风湿关节炎患者治疗前血清分泌型磷脂酶A2与疾病活动性评分的相关性
Fig2Relationship of serum secreted phospholipase A2 and disease activity score before treatments in rheumatoid arthritis patients

图3类风湿关节炎患者治疗后血清分泌型磷脂酶A2与疾病活动性评分的相关性
Fig3Relationship of serum secreted phospholipase A2 and disease activity score after treatments in rheumatoid arthritis patients

表2 糖皮质激素对血清分泌型磷脂酶A2变化的影响
讨 论
磷脂酶A2(phospholipase A2,PLA2)是一种能催化磷脂甘油分子上二位酰基的水解酶,从而产生游离脂肪酸和溶血卵磷脂,亦是花生四烯酸、前列腺素及血小板活化因子等生物活性物质生成的关键酶,其所产生的脂质介质在炎性反应和组织损伤时膜通道的活化、信息传递、血流动力学及病理生理过程中,以及在调节细胞内外代谢中起关键性作用。依据细胞定位及酶性质,PLA2可分为分泌型(sPLA2)、胞浆型(cPLA2)和非钙离子依赖型(iPLA2)[6-7]。sPLA2是磷脂代谢酶中最大的一个亚家族,具有多种生理功能。目前,在人体中总共发现11种sPLA2亚型,它们具有不同的组织分布、水解活性和底物特异性。由于其水解产物主要为花生四烯酸和溶血磷脂,sPLA2常通过影响这两个通路调节细胞功能、炎性反应、抗菌等。激活的单核细胞、巨噬细胞及中性粒细胞分泌释放大量PLA2,成为体液PLA2的主要来源;sPLA2分泌进入相应部位,导致多种炎性病理损伤。通过PLA2的测定,可作为早期预报病理进程及诊断性指标。相关文献报道,PLA2是在炎性情况下,不同介质生成中的一个关键酶,与RA发病的病理生理有关[8-9]。在特定条件下,PLA2可从细胞膜释放花生四烯酸,诱导前列腺素产生,且与促进白细胞介素-6释放有关[10]。炎性细胞因子和sPLA2可以增强彼此的合成,通过持续放大的级联反应产生大量炎性介质[11],因此sPLA2在RA发病中起到一定作用。
炎性反应是动脉粥样硬化的重要特征,研究提示,sPLA2可影响动脉粥样硬化过程[12];慢性炎性时血清中sPLA2浓度可能升高且促进动脉粥样硬化形成[13]。大量研究表明,在慢性炎性反应如关节炎、脓毒血症、心血管疾病时,sPLA2血清水平升高,且升高程度与疾病严重程度相关。该酶可在动脉壁内将脂蛋白中的磷脂酰胆碱水解为溶解型磷脂酰胆碱和游离脂肪酸,它们可触发一系列的炎性反应进而导致冠心病的发生。有学者认为,sPLA2是心血管疾病的重要炎性介质,是动脉粥样硬化和心肌细胞缺血性损害的介质[14]。以上均说明,sPLA2已经成为致动脉粥样硬化的重要炎性因子,是心血管疾病的危险因子和发生临床冠脉事件的预测因子。
本研究结果提示,治疗前sPLA2显著升高,治疗后无显著降低,可能是因为sPLA2可致动脉粥样硬化[15],提示RA患者即使病情稳定,动脉粥样硬化风险仍较大。且本研究证实,RA患者血清sPLA2与DAS28及ESR、CRP、血小板等炎性指标呈正相关,说明处于疾病活动期时sPLA2升高,预示病情活动时动脉粥样硬化风险增大。
糖皮质激素可引起高血压、糖尿病、高血脂,进而诱发动脉粥样硬化。糖皮质激素被多数学者认为可能是促进动脉粥样硬化的主要因素,一方面其可通过作用于血浆脂蛋白直接引起动脉粥样硬化;另一方面,激素长期应用所致不良反应如高血压、高脂血症和糖尿病亦可加强传统危险因素。有学者研究发现,每增加10 mg/d泼尼松,会使收缩压升高1.1 mm Hg,胆固醇水平升高90 mg/L,体质量增加2.5 kg,而高血压、高胆固醇血症、肥胖均是动脉粥样硬化的高危因素[16]。Doria等[17]研究认为,泼尼松累积剂量是最重要的非传统致动脉粥样硬化因素。
一般认为,由于大剂量糖皮质激素对脂质代谢及其他传统危险因素影响确切,应是并发动脉粥样硬化的主要危险因素之一,而小剂量激素则可能通过抑制炎性反应对血管壁起保护作用。有研究报道,sPLA2在RA及动脉粥样硬化的发病中均起到重要作用[18-19]。本研究证实,使用小剂量糖皮质激素时,血清sPLA2浓度明显降低,提示激素可抑制RA炎性反应、降低动脉粥样硬化风险。因此,使用小剂量激素可使RA患者血清sPLA2浓度明显降低,从而达到治疗疾病本身及预防动脉粥样硬化发生的作用。
综上,sPLA2可能在RA炎性病理过程中起重要作用,而小剂量糖皮质激素具有抑制sPLA2的作用,可能有助于防治RA疾病本身及动脉粥样硬化,为疾病预防和治疗提供了新思路。
[1]郭彩花,李彩兰.类风湿关节炎患者动脉粥样硬化的相关因素分析[J].国际检验医学杂志,2014,35:1205-1207.
[2]刘春丽,蔡辉.类风湿关节炎致动脉粥样硬化的研究进展[J].医学综述,2012,18:104-107.
[3]薛超,胡大一.类风湿关节炎与动脉粥样硬化的关系[J].国际心血管病杂志,2011,38:82-85.
[4]Dutour A,Achard V,Sell H,et al.Secretory type II phospholipase A2 is produced and secreted by epicardial adipose tissue and overexpressed in patients with coronary artery disease[J].J Clin Endocrinol Metab,2010,95:963-967.
[5]Arnett FC,Edworthy SM,Bloch DA,et al.The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis[J].Arthritis Rheum,1988,31:315-324
[6]Kishimoto K,Matsumura K,Kataoka Y,et al.Localization of cytosolic phospholipase A2 messenger RNA mainly in neurons in the rat brain[J].Neuroscience,1999,92:1061-1077.
[7]杨武,郭薇,黄春洪.分泌型磷脂酶A2亚家族:结构与功能[J].中国生物化学与分子生物学报,2013,29:932-940.
[8]Thwin MM,Douni E,Arjunan P,et al.Suppressive effect of secretory phospholipase A2 inhibitory peptide in interleukin-1β-induced matrix metalloproteinase production in rheumatoid synovial fibroblasts,and its antiarthritic activity in hTNFtg mice[J].Arthritis Res Ther,2009,11:R138.
[9]Masuda S,Murakami M,Komiyama K,et al.Various secretory phospholipase A2 enzymes are expressed in rheumatoid arthritis and augment prostaglandin production in cultured synovial cells[J].FEBS J,2005,272:655-672.
[10] Triggiani M,Granata F,Frattini A,et al.Activation of human inflammatory cells by secreted phospholipase A2[J].Biochim Biophys Acta,2006,1761:1289-1300.
[11] Granata F,Balestrieri B,Petraroli A,et al.Secretory phospholipases A2 as multivalent medi-ators of inflammatory and allergic disorders[J].Int Arch Allergy Immunol,2003,131:153-163.
[12] Jan J,Robbert J.Type II secretory phospholipase A2:the emerging role of biochemical markers of plaque inflammation[J].Eur Heart J,2003,24:1804-1806.
[13] Rosenson RS,Hurt Camejo E.Phospholipase A2 enzymes and the risk of atherosclerosis[J].Eur Heart J,2012,33:2899-2909.
[14] Niessen HW,Krijnen PA,Visser CA,et al.Type II secretory phospholipase A2 in cardiovascular disease:a mediator in atherosclerosis and ischemic damage to cardiomyocytes?[J].Cardiovasc Res,2003,60:68-77.
[15] Anuurad E,Ozturk Z,Enkhmaa B,et al.Association of lipoprotein-associated phospholipase A2 with coronary artery disease in African-Americans and Caucasians[J].J Clin Endocrinol Metab,2010,95:2376-2383.
[16] Zonana-Nacach A,Barr SG,Magder LS,et al.Damage in SLE and its association with corticosteroids[J].Arthritis Rheum,2000,43:1801-1808.
[17] Doria A,Shoenfeld Y,Wu R,et al.Risk factors for subclinical atherosclerosis in a prospective cohort of patients with systemic lupus erythematosus[J].Ann Rheum Dis,2003,62:1071-1077.
[18] Maung-Maung T,Eleni D,Pachiappan A,et al.Suppressive effect of secretory phospholipase A2 inhibitory peptide in interleukin-1β-induced matrix metalloproteinase production in rheumatoid synovial fibroblasts,and its antiarthritic activity in hTNFtg mice[J].Arthritis Res Ther,2009,11:138.
[19] Mallat Z,Lambeau G,Tedgui A.Lipoprotein-associated and secreted phospholipases A2 in cardiovascular disease roles as biological effectors and biomarkers[J].Circulation,2010,122:2183-2200.

