抗β2糖蛋白Ⅰ抗体对自身免疫性溶血性贫血临床结局的影响
曾晓虹,薛 原,林珺芳,郑 玲,康日辉
(福建医科大学附属第一医院风湿科,福州 350005)
自身免疫性溶血性贫血(autoimmune hemolytic anemia,AIHA)是一组自身免疫紊乱、产生抗红细胞抗体,使红细胞在肝脾等脏器加速被破坏而造成的贫血,病因可分为原发性和继发性。继发性AIHA常见于自身免疫性疾病,其中系统性红斑狼疮(systemic lupus erythematosus,SLE)并发AIHA并不少见,发生率达7%~15%[1]。众多研究发现,抗磷脂抗体(antiphospholipid antibody,APL)与AIHA有相关性[2-4]。理论上,自身抗体介导红细胞损害的发病机制中,IgG意义更大。研究报道,自身抗体介导红细胞损害受到巨噬细胞细胞膜上Fc受体和补体的调节,即抗体后调节,而巨噬细胞表面表达3种不同的FcγR,其中FcγRI和FcγRⅢ为激活型受体,与AIHA的发病有关;IgG亚类IgG2a与FcγRI和FcγRⅢ的亲和力较强,是AIHA主要致病抗体[5]。另外,笔者前期研究显示,IgG类抗β2糖蛋白I抗体(anti-β2 glycoprotein Ⅰ,aβ2GPI)与SLE并发AIHA有明显相关性,但未发现IgM类抗β2糖蛋白Ⅰ抗体与AIHA的相关性[6]。本研究主要探讨IgG类抗β2GPI与AIHA患者溶血程度及临床结局的关系。
资料与方法
对象和分组
连续收集2008年12月至2013年4月在福建医科大学附属第一医院血液风湿科门诊和病房诊治的AIHA患者,AIHA诊断标准依据《血液病诊断及疗效标准》[7];排除高血压、糖尿病、心脑血管病及抗磷脂抗体综合征(antiphospholipid antibody syndrome,APS)病史的患者。将其中原发性AIHA患者纳入原发性AIHA组,AIHA合并SLE者纳入SLE-AIHA组。SLE诊断均符合1997年美国风湿病协会制定的SLE分类标准[8]4项以上。根据IgG类抗β2GPI(抗β2GPI-IgG)阳性与否,SLE-AIHA组中抗β2GPI阳性者为A1组,抗β2GPI阴性者为B1组;原发性AIHA组中抗β2GPI阳性者为A2组,抗β2GPI阴性者为B2组。
临床资料收集
记录所有病例的基本人口学特征、发病年龄、病程、症状、体征、合并症、实验室检查、治疗方案等临床资料。SLE病情活动度采用SLE疾病活动指数(systemic lupus erythematosus disease activity index,SLEDAI)评估。
标本采集与方法
清晨空腹抽取SLE-AIHA组、原发性AIHA组患者静脉血3~5 ml,室温放置约1 h,普通离心机3 500 r/min离心约10 min,留取血清标本并保存于-80℃冰箱,采用酶联免疫吸附试验测定抗β2GPI-IgG。试剂盒由德国欧蒙医学实验诊断股份公司提供。抗β2GPI-IgG抗体滴度≥20 RU/ml为阳性,抗β2GPI-IgG抗体滴度≥60 RU/ml为高滴度阳性。所有患者治疗期间每隔2或3天抽取静脉血,进行血常规、网织红细胞、血清胆红素、乳酸脱氢酶等指标检测;治疗起效后[达部分缓解(partial remission,PR)]后,每隔5天监测以上指标。
治疗方法
急性期静脉滴注甲泼尼龙1.5 mg·kg-1·d-1,待治疗起效即病情达PR后,激素渐减量,一般5~7 d减原剂量的1/4,减至甲泼尼龙40 mg/d改为等量甲泼尼龙口服给药;当血红蛋白、网织红细胞正常后,激素渐减量至20~24 mg/d维持用药。SLE-AIHA组和原发性AIHA组中,狼疮高度活动或单用激素治疗AIHA疗效欠佳者,加用免疫抑制剂。若患者出现危及生命的贫血,通过严格配血后,输注洗涤红细胞。
疗效判断和观察项目
AIHA缓解的判定标准[7]:(1)完全缓解(complete remission,CR):临床症状消失,Coombs’试验转阴,血红蛋白、网织红细胞计数均正常,血清总胆红素正常;(2)PR:临床症状基本消失;血红蛋白>80 g/L;网织红细胞<5%;Coombs’试验阴性或仍为阳性,但效价较治疗前降低;血清胆红素较前下降。
观察项目:治疗后6周内,观察起效时间(达PR时间)和CR率。
统计学处理
采用SPSS11.5软件分析处理。先行方差齐性和正态性检验,符合正态分布、方差齐的计量资料采用(均数±标准差)表示,比较采用t检验;非正态分布或方差不齐的计量资料采用中位数(M)和四分位数表示,采用Mann-WhitneyU检验。计数资料比较采用χ2检验或Fisher’s确切概率法,以P<0.05为差异有统计学意义。
结 果
基本资料
共纳入AIHA患者42例,SLE-AIHA组22例,原发性AIHA组20例。
SLE-AIHA组:共22例,年龄17~64岁,平均(37±14)岁,男女比例为1:10,中位SLE病程12.50个月,四分位数(QL~QU:0.92~36.25个月),中位溶血病程2.00个月(QL~QU:0.50~3.00个月)。平均SLEDAI(9±3)分。21例患者为初次发生溶血事件,1例患者为第2次发生溶血事件。肾脏受累者12例,肺高压者3例,神经精神狼疮者1例,7例患者未出现脏器损害。抗β2GPI-IgG呈阳性患者10例(A1组):抗β2GPI-IgG平均滴度(86.95±64.70) RU/ml,其中7例患者抗β2GPI-IgG抗体呈高滴度阳性,7例均并有狼疮性肾炎,肺高压2例,神经精神狼疮1例(表1)。3例Coombs’试验呈(IgG+C3)型,7例Coombs’试验呈C3型,A1组抗红细胞类别单纯型/复合型为7∶3。抗β2GPI-IgG呈阴性患者12例(B1组):10例Coombs’试验呈(IgG+C3)型,2例Coombs’试验呈C3型,B1组抗红细胞类别单纯型/复合型为2∶10。A1组与B1组比较,年龄、性别、SLE病程、溶血病程、SLEDAI均无统计学差异(表2)。
原发性AIHA组:共20例,年龄21~59岁,平均(38±15)岁,男女比例1∶6,中位病程2月(QL~QU:0.67~11.5个月)。抗β2GPI-IgG呈阳性患者7例(A2组):平均年龄(43±14)岁,男女比例2∶5,中位溶血病程1个月(QL~QU:0.33~3.00个月),其中4例Coombs’试验呈(IgG+C3)型,3例Coombs’试验呈C3型,A2组抗红细胞类别单纯型/复合型为3∶4;3例出现肾损害。抗β2GPI-IgG呈阴性患者13例(B2组):平均年龄(35±15)岁,男女比例1∶12,中位溶血病程3个月(QL~QU:0.67~14.0个月),10例Coombs’试验呈(IgG+C3)型,3例Coombs’试验呈C3型,B2组抗红细胞类别单纯型/复合型为3∶10;1例并发肾损害。A2组与B2组比较,年龄、性别、溶血病程均无统计学差异。
抗β2GPI-IgG与溶血程度
A1组与B1组比较(表3),A2组与B2组比较(表4),血红蛋白、网织红细胞计数、胆红素、乳酸脱氢酶、红细胞沉降率均无统计学差异(P>0.05)。
抗β2GPI-IgG与溶血预后
SLE-AIHA组:A1组和B1组所有患者均接受甲泼尼龙(1.5 mg·kg-1·d-1)治疗。10例A1组患者中,应用免疫调节剂或免疫抑制剂者7例,使用羟氯喹5例、硫唑嘌呤2例、甲氨蝶呤1例、环磷酰胺2例,其中3例患者采用联合治疗,治疗方案分别为:羟氯喹联合硫唑嘌呤2例,羟氯喹联合环磷酰胺1例;输注洗涤红细胞者3例。12例B1组患者中,应用免疫调节剂或免疫抑制剂治疗患者8例,使用羟氯喹4例、硫唑嘌呤4例、环孢素1例、环磷酰胺1例,2例患者采用羟氯喹联合硫唑嘌呤治疗;输注洗涤红细胞者4例。A1组与B1组激素、免疫调节剂/免疫抑制剂使用和输血治疗差异无统计学意义(P<0.05)。A1组达CR患者6例,达PR患者有4例;B1组达CR患SLE-AIHA:系统性红斑狼疮合并自身免疫性溶血性贫血;A1:IgG类抗β2糖蛋白Ⅰ抗体阳性者;B1:IgG类抗β2糖蛋白I抗体阴性者;HGB:血红蛋白;Ret:网织红细胞计数;IBIL:间接胆红素;LDH:乳酸脱氢酶;ESR:红细胞沉降率;a中位IBIL,QL~QU:18.98~48.33 mmolL;b中位LDH,QL~QU:266~615 μL;c中位IBIL,QL~QU:15.03~49.45 mmolL;d中位LDH,QL~QU:298~441 μL者9例,达PR患者3例,A1组与B1组CR率差异无统计学意义(P<0.05);但2组患者在溶血达PR所需时间上,A1组治疗时间显著长于B1组,差异有统计学意义(P<0.05)(表5)。
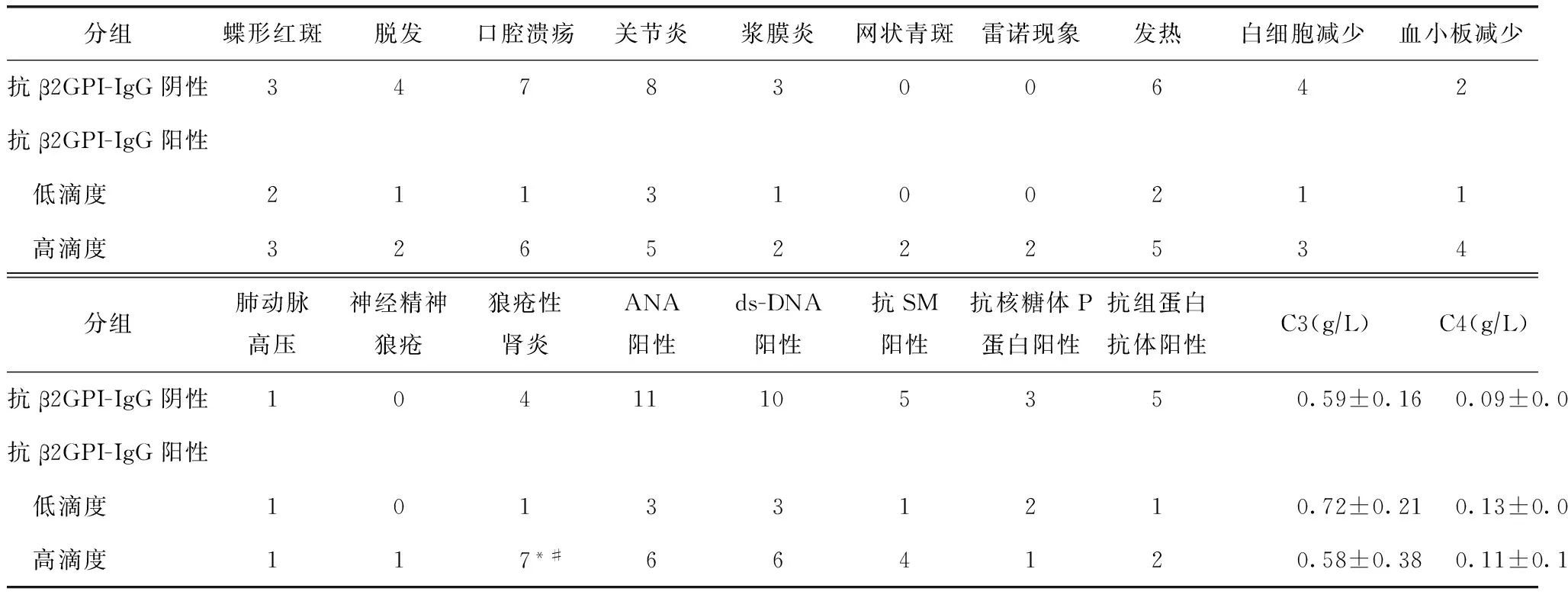
表1 SLE-AIHA组IgG类抗β2GPI高滴度阳性患者临床特征
SLE:系统性红斑狼疮;AIHA:自身免疫性溶血性贫血;抗β2GPI-IgG:IgG类抗β2糖蛋白I抗体;ANA:抗核抗体;ds-DNA:抗双链DNA抗体;SLEDAI:系统性红斑狼疮疾病活动指数;与抗β2GPI-IgG低滴度阳性组比较,*P=0.008;与抗β2GPI-IgG阴性组比较,#P=0.013
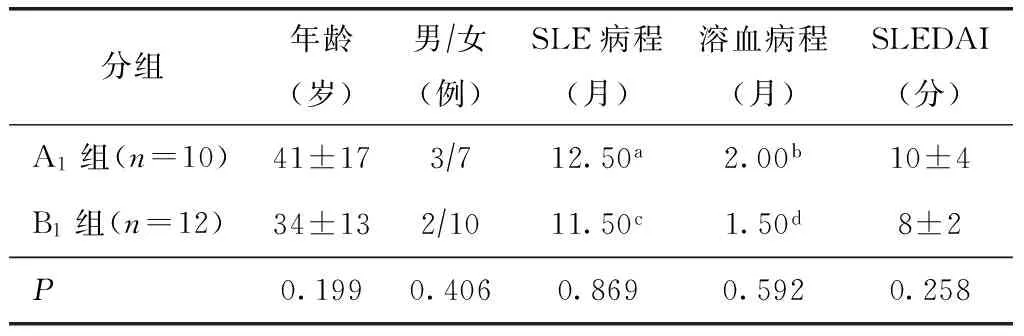
表2 SLE-AIHA组抗β2GPI-IgG阳性者与阴性者基本情况比较
A1:IgG类抗β2糖蛋白I抗体阳性者;B1:IgG类抗β2糖蛋白Ⅰ抗体阴性者;SLE:系统性红斑狼疮;SLEDAI:系统性红斑狼疮疾病活动指数;a中位SLE病程,QL~QU:0.88~66.00月;b中位溶血病程,QL~QU:0.88~3.00月;c中位SLE病程月,QL~QU:1.50~36.75;d中位溶血病程,QL~QU:0.50~2.75月

表3 SLE-AIHA组抗β2GPI-IgG与溶血程度的关系
原发性AIHA组:A2组和B2组所有患者均接受甲泼尼龙(1.5 mg·kg-1·d-1)治疗。A2组(7例)中给予激素联合硫唑嘌呤治疗的患者2例,输注洗涤红细胞3例。B2组(13例)予激素联合免疫抑制剂治疗的患者3例(硫唑嘌呤2例、环磷酰胺1例),输注洗涤红细胞5例。经统计分析,A2组与B2组激素、免疫抑制剂使用、成分输血无统计学差异(P>0.05),A2组达CR患者有4例,达PR患者有3例,B2组达CR患者有8例,达PR患者5例;A2组与B2组CR率无统计学差异(P>0.05)。A2组患者溶血达部分缓解的时间为(15±5) d,B2组患者溶血达部分缓解的时间为(11±3) d,两组溶血达部分缓解时间比较差异无统计学意义(P=0.175)。
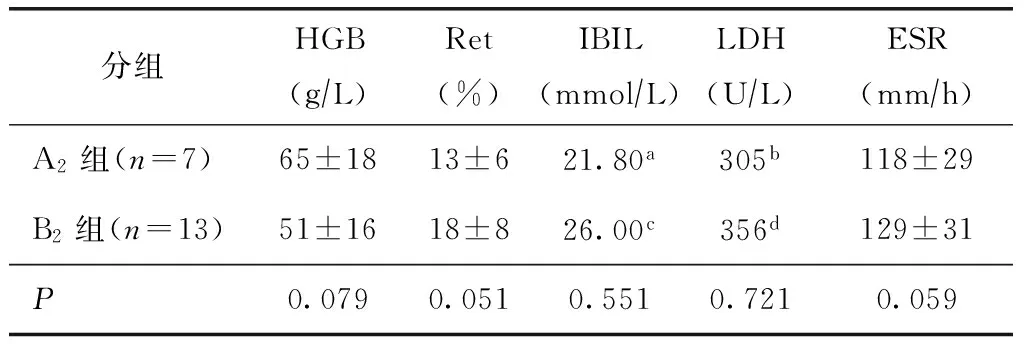
表4 原发性AIHA组中抗β2GPI-IgG与溶血程度关系
AIHA:自身免疫性溶血性贫血;HGB:血红蛋白;Ret:网织红细胞计数;IBIL:间接胆红素;LDH:乳酸脱氢酶;ESR:红细胞沉降率;a中位IBIL,QL~QU:18.30~27.60 mmolL;b中位LDH,QL~QU:288~550 μL;c中位IBIL,QL~QUmmolL:14.90~57.10;d中位LDH,QL~QU:305~518 μL

表5 SLE-AIHA组抗β2GPI-IgG阳性者与阴性者溶血缓解时间比较
SLE-AIHA:系统性红斑狼疮合并自身免疫性溶血性贫血;A1:IgG类抗β2糖蛋白I抗体阳性者;B1:IgG类抗β2糖蛋白Ⅰ抗体阴性者
随访
SLE-AIHA组中抗β2GPI-IgG阳性患者(10例)溶血缓解后复查抗β2GPI-IgG,结果显示所有患者该抗体未转阴,但抗体滴度均有下降。SLE-AIHA组10例患者在溶血缓解后继续服用甲泼尼龙或泼尼龙以及免疫抑制剂治疗。溶血缓解继续治疗1月后随访,10例患者仍维持缓解,其中2例患者由PR转为CR;除2例 PR患者抗β2GPI-IgG滴度无明显降低,其余8例患者抗β2GPI-IgG滴度均较前有所下降,甚至2例患者抗体转阴。
讨 论
SLE是一种累及全身多系统的自身免疫性疾病,血液系统受累发生率可高达73%~90%[1],临床表现以贫血最为常见,其原因可归为免疫性和非免疫性因素,以非免疫性因素多见。SLE患者AIHA发生率达7%~15%[1,9],部分病例以AIHA为首发表现。至今,AIHA发病机制尚不明确,Jones等[10]发现,伴有APL的SLE并发AIHA患者体内补体1型受体(complement receptor1,CR1)和加速衰变因子(decay-accelerating factor,DAF)缺失,而且APL与红细胞膜CR1缺失程度显著相关,CR1和DAF的缺失促进补体活化及C3转化酶和C5转化酶的组装,使红细胞受自身补体的攻击,提示APL可能充当重要抗红细胞抗体参与AIHA发病机制。文献报道,SLE患者抗β2GPI检出率达5%~40%[11],其可介导炎性细胞活化、内皮细胞损害、细胞凋亡、凝血纤溶异常等引发一系列细胞因子释放和细胞内信号传导,发生瀑布式炎性反应和组织损伤,可能与SLE多系统损害相关。因此,抗β2GPI是否影响SLE合并AIHA患者预后值得进一步追踪。
激素是AIHA的主要治疗药物,但该药相关不良反应如高血压、高血糖、水钠潴留等会影响患者接受治疗的依从性,或出现并发症而改变治疗方案,故在本研究设计中尽可能排除干扰治疗方案进行的因素。本研究结果显示,抗β2GPI-IgG并不影响AIHA溶血程度,无论是原发性AIHA还是继发性AIHA。但有研究显示[12-13],抗红细胞抗体类别与AIHA溶血的严重程度相关,复合型如(IgG+C3)型,溶血程度大多重于IgG型、C3型等单纯型。本研究SLE-AIHA组中,抗β2GPI-IgG阳性患者抗红细胞类别以单纯型居多,而抗β2GPI-IgG阴性患者抗红细胞类别以复合型居多;原发性AIHA组抗β2GPI-IgG阴性患者复合型的抗红细胞类别所占比例高于抗β2GPI-IgG阳性患者。因此,可能低估了抗β2GPI-IgG与溶血程度相关性;需增加样本量进一步验证。
溶血事件本身是SLE病情活动的重要依据[14],多数研究认为AIHA也是SLE预后不良的因素;而许多研究发现,抗β2GPI介导免疫反应参与SLE多脏器损害的发病过程,如狼疮性肾炎、动脉粥样硬化、肺动脉高压等[9,15],抗β2GPI可能是继溶血后对SLE病情再次打击,加重SLE顽固的免疫紊乱,影响溶血病情转归。本研究SLE-AIHA组中,高滴度阳性抗β2GPI-IgG患者肾损害发生率显著高于该抗体低滴度阳性和抗体阴性的患者。抗β2GPI-IgG阳性与该抗体阴性2组患者在溶血程度、治疗方案无差别情况下:虽然前者CR率低于后者,但无统计学意义;然而,前者溶血达PR所需时间略长,且随访中发现抗β2GPI持续高滴度升高的患者溶血难以达到CR,提示抗β2GPI可能是SLE合并AIHA患者预后不良因素之一。虽然本研究方法为回顾性,但所有患者确诊后首选激素治疗,在达PR前均使用甲泼尼龙(1.5 mg·kg-1·d-1);疗效欠佳者加用免疫抑制剂,而免疫抑制剂起效时间一般在1~3个月以上,在观察时间点内免疫抑制剂并非起主要治疗作用,对结果影响较小。本研究也发现,SLE-AIHA组中大部分患者是首次发生AIHA,其中7例患者除溶血外(其中2例抗β2GPI-IgG阳性)无其他脏器损害,与文献[16]报道相符。但是临床上,针对此类SLE患者使用免疫抑制剂相对保守,这可能不仅影响溶血病情缓解,也可能影响狼疮远期预后。本研究未能发现抗β2GPI与原发性AIHA预后的相关性,不排除样本量较小的可能。
综上,抗β2GPI-IgG可能参与自身免疫性溶血性贫血发病机制,它可能是SLE并发AIHA患者预后不良因素之一。但是,因本文为回顾性研究,缺乏控制混杂因素能力,研究对象样本量小,研究结果可能存在偏倚;另外,随访时间短,研究结果是否可以指导终身治疗尚不明了,需进一步大样本的前瞻性研究随访以指导临床治疗。
[1]AI Arfaj AS,Khalil N.Clinical and immunological manifestation in 624 SLE patients in Saudi Arabia[J].Lupus,2009,18:456-473.
[2]Mok MY,Chan EY,Fong DY,et al.Antiphospholipid antibody profiles and their clinical associations in Chinese patients with systemic lupus erythematosus[J].J Rheumatol,2005,32:622-628.
[3]Bouma B,de Groot PG,van den Elsen JM,et al.Adhesion mechanism of human beta(2)-glycoprotein I to phospholipidsbased on its crystal structure[J].EMBO J,1999,18:5166-5174.
[4]Shoenfeld Y,Gerli R,Doria A,et al.Accelerated atherosclerosis in autoimmune rheumatic diseases[J].Circulation,2005,112:3337-3347.
[5]Fossati-Jimack L,Ioan-Fassinay A,Reininger L,et al.Markedly different pathogenicity of four immunoglublin G isotype-switch variants of an antierythrocyte autoantibody is based on their capacity to interact in vivo with the low affinity Fcγ receptorⅢ[J].J Exp Med,2000,191:4293-4302.
[6]曾晓虹,薛原.抗β2糖蛋白Ⅰ抗体在系统性红斑狼疮合并自身免疫性溶血性贫血中的临床意义[J].中华临床免疫和变态反应杂志,2014,8:28-34.
[7]张之南,沈悌.血液病诊断及疗效标准[M].北京:科学出版社,2007:68.
[8]Hochberg MC.Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus[J].Arthritis Rheum,1997,40:1725.
[9]Giannouli S,Voulgarelis M,Ziakas PD,et al.Anaemia in systemic lupus erythematosus:form pathophysiology to clinical assessment[J].Ann Rheum Dis,2006,65:144-148.
[10] Jones DR,Scarsbrook AF,Imrie H,et al.Do plasma anti phospholipid antibodies in patients with autoimmune haemolytic anaemia correlate with reduced levels of erythrocyte complement receptor 1?[J].Autoimmunity,1996,23:45-51.
[11] Sahin M,Duzgun N,Tunc SE,et al.Antibodies to beta2-glycoprotein-I:relation of anticardiolipin antibodies with clinical and laboratory parameters in patients with systemic lupus erythematosus[J].Clin Biochem,2007,40:526-530.
[12] 杨国元,王昌富,张万胜,等.温抗体型自身免疫性溶血性贫血抗体分型及临床意义[J].中华血液学杂志,1998,19:542-554.
[13] Garratty G,Arndt P,Domen R,et al.Severe autoimmune hemolytic anemia associated with IgM autoantibodies directed against determinants on or associated with glycophorin A[J].Vox Sang,1997,72:124-130.
[14] Kasitanon N,Magder LS,Petri M.Predictors of survival in systeminc lupus erythematosus[J].Medicine (Baltimore),2006,85:147-156.
[15] Plazak W,Gryga K,Milewski M,et al.Association of heart structure and function abnormalities with laboratory findings in patients with SLE[J].Lupus,2011,20:936-944.
[16] Duran S,Apte M,Alarcon GS,et al.Features associated with,and the impact of hemolytic anemia in patients with systemic lupus erythematosus LX,results form a multiethnic cohort[J].Arthritis Rheum,2008,59:1332-1340.

