显微镜下多血管炎和肉芽肿性多血管炎死因及临床特点
黄火高,黄新翔,郑文洁,张 烜,田新平,赵 岩,曾小峰,张奉春
(中国医学科学院 北京协和医学院 北京协和医院风湿免疫科,风湿免疫病学教育部重点实验室,北京 100730)
肉芽肿性多血管炎(granulomatosis with polyangiitis,GPA)(既往称韦格纳肉芽肿)和显微镜下多血管炎(microscopic polyangiitis,MPA)是原因未明的系统性坏死性小血管炎,多数患者血清中可检测到抗中性粒细胞胞浆抗体(antineutrophil cytoplasmic antibody,ANCA),因此又被称为ANCA相关性小血管炎[1-3]。GPA和MPA患者临床特点和组织学特征具有相似性,但又各具特点。MPA的病理特征为小血管节段性纤维素样坏死,无肉芽肿形成,无或仅有少量免疫复合物沉积;而GPA则为坏死性肉芽肿性血管炎。GPA和MPA患者往往表现为起病急、进展快,常侵犯肺和肾脏等重要脏器,总体预后较差,病死率高[4-5]。然而,GAP和MAP发病率均较低,尚缺乏大样本的病例死因分析,本文对北京协和医院诊断的MPA或GPA死亡病例进行分析,报告如下。
资料和方法
研究对象
收集1990年9月至2013年9月北京协和医院所有诊断为MPA及GPA住院患者中的死亡病例。GPA诊断标准需同时符合1990年美国风湿病协会(American College Of Rheumatology,ACR)韦格纳肉芽肿分类标准[6]和2012年Chapel Hill会议制定的血管炎新分类命名[1]。MPA诊断参考2012年Chapel Hill会议的定义和中华医学会风湿病学分会的指南性意见[1-2]。肺泡出血(alveolar hemorrhage,AH)依据咯血、呼吸困难、血红蛋白水平下降等临床表现,以及影像学新发浸润影和/或纤维支气管镜检查肺泡灌洗液为血性或见含铁血黄素巨噬细胞等诊断,同时除外支气管扩张、肺部感染、心力衰竭等原因。肾脏受累定义为活动性尿沉渣和/或24 h尿蛋白定量>0.5 g和/或血肌酐水平升高。消化系统受累定义为无法用其他原因解释的消化道出血和肠梗阻等表现。
资料收集
收集纳入患者的一般情况、临床表现、实验室检查、脏器受累情况。
主要死因判断标准
主要死因包括疾病活动和感染。若由于血管炎原发病进展,引起1个或多个脏器衰竭导致患者死亡,即使伴随感染,依然判定为疾病活动导致的死亡。若疾病未引起严重器官损害,主要由感染引起脏器衰竭致患者死亡,则判定为感染导致的死亡。
五因子评分(Five Factor Score,FFS)系统
按2009年修订的评分方法[7],每符合以下1条则累计1分:(1)血肌酐≥150 μmol/L;(2)严重胃肠道血管炎;(3)心肌血管炎导致的心力衰竭;(4)年龄>65岁;(5)无耳鼻喉累及。计分时除外非疾病活动导致的表现。
统计学方法
采用SPSS19.0进行统计分析。计量资料采用独立样本t检验;计数资料采用非参检验;率的比较采用卡方检验,当理论频数低于5时,采用Fisher精确检验。P<0.05为差异有统计学意义。
结 果
一般情况
1990年9月至2013年9月北京协和医院共收治MPA和GPA患者455例,其中MPA 233例,GPA 222例。死亡患者49例,其中MPA死亡34例,占同期MPA住院患者的14.6%;GPA死亡15例,占同期GPA住院患者的6.8%;MPA病死率明显高于GPA,差异有统计学意义(P=0.007)。
34例MPA死亡病例中,男17例,女17例,年龄43~84岁,平均(69.4±9.3)岁,发病至死亡病程中位数为3.85(0.23~37.00)个月。15例GPA死亡病例中,男7例,女8例,年龄10~69岁,平均(47.2±17.7)岁,发病至死亡病程中位数为10.00(1.50~254.00)个月。两组患者性别差异无统计学意义(P=0.831);GPA组患者死亡年龄明显低于MPA组,差异有统计学意义(P<0.001);而生存时间高于MPA组,差异有统计学意义(P=0.011)。MPA组年龄>65岁者(25例,73.5%)明显多于GPA组(2例,13.3%),差异有统计学意义(P<0.001)。
主要死因构成
15例GPA死亡患者首要死因是疾病导致出血(8/15,53.4%),其次是并发肺部感染(6/15,40.0%),另1例死于尿毒症脑病。34例MPA死亡患者首要死因为并发肺部感染(19/34,55.9%),其次是出血(12/34,35.3%),另1例颅内血管炎导致脑疝,2例死于急进性肾小球肾炎(rapidly progressive glomerulonephritis,RPGN)(表1)。MPA死亡病例FFS明显高于GPA,差异有统计学意义[(3.2±1.0)vs.(1.5±0.5),P<0.001]。
死亡患者重要系统累及情况
导致MPA和GPA患者死亡的受累系统第一位均为呼吸系统,其中MPA占82.4%,GPA占66.7%,随后依次为消化系统(26.7%vs. 5.9%)、中枢神经系统(6.7%vs.5.9%)和肾脏(0vs. 5.9%),两组比较差异均无统计学意义(均P>0.05)。
不同生存时间死因构成
MPA与GPA组比较,生存时间分布差异有统计学意义(P=0.020)。MPA组和GPA组1年内死亡者分别占82.4%(28例)和60.0%(9例);3个月内死亡者分别占44.1%和6.7%,差异有统计学意义(P=0.018)。
疾病活动导致死亡因素中,GPA(9例,60.0%)与MPA(15例,44.1%)在生存时间分布上无差别。而非疾病原因致死的主要因素是肺部感染,两组按生存时间分布存在差别(P=0.042),MPA组多分布于3~6个月。其中,在生存时间<3个月者中,肺部感染致MPA死亡8例,无GPA患者,但两者率的比较差异无统计学意义(P=0.087)。6个月内死亡患者中,MPA组因肺部感染死亡(14/34,41.2%)比例高于GPA组(2/15,13.3%),但差异无统计学差异(P=0.097)(表2)。
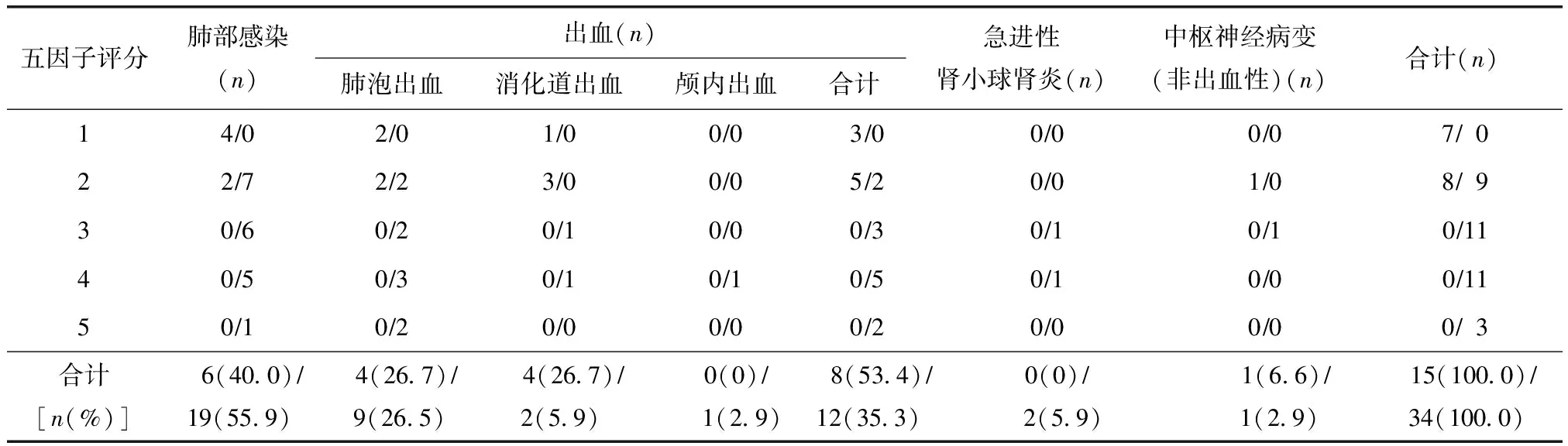
表1 肉芽肿性多血管炎和显微镜下多血管炎患者不同病情活动度下主要死因分布
数据以“肉芽肿性多血管炎死亡病例数/显微镜下多血管炎死亡病例数”表示
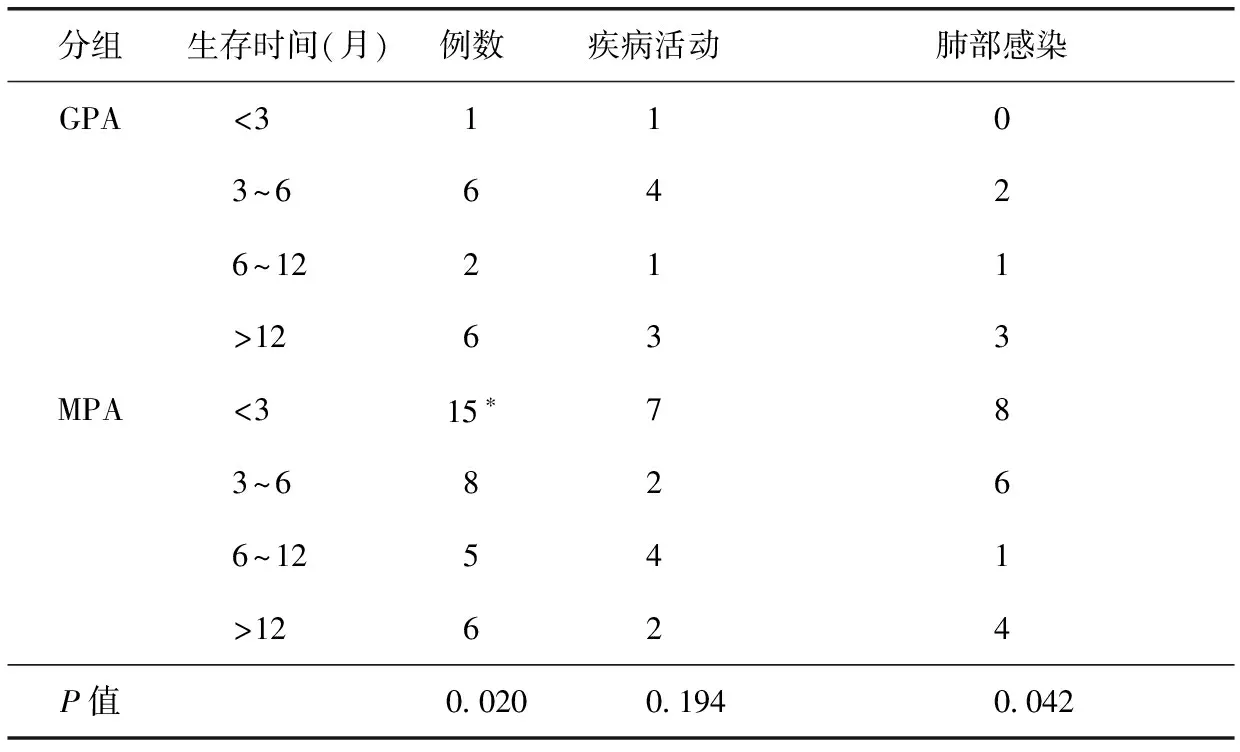
表2 肉芽肿性多血管炎和显微镜下多血管炎患者不同生存时间主要死因构成
GPA:肉芽肿性多血管炎;MPA:显微镜下多血管炎;与GPA组生存时间<3个月患者例数比较,*P<0.05
重要临床表现及脏器受累情况
两组患者多为多器官受累,MPA与GPA组肾功能不全者合计约占全部死亡患者的77.6%(38/49),其中RPGN占38.8%(19/49);合并心功能不全者为34.7%(17/49),合并肺泡出血者为38.8%(19/49),间质性肺病者为34.7%(17/49),出现呼吸衰竭者为32.7%(16/49),消化道出血者为30.6%(15/49)(表3)。
伴随耳鼻喉表现者共11例,其中GPA组(10/15,66.7%)明显高于MPA组(1/34,2.9%),差异有统计学意义(P<0.001)。MPA组合并间质性肺病者明显高于GPA组,差异有统计学意义(44.1%vs. 13.3%,P=0.037)(表3)。
死亡患者肺部感染病原分析
MPA组和GPA组合并肺部感染比例分别为85.3%(29/34)和73.3%(11/15),总计约占81.6%(40/49)。最常见原因为细菌感染,MPA组和GPA组分别为67.6%和66.7%;其次是真菌感染,MPA组和GPA组曲霉菌感染分别为20.0%和14.7%,17.6%的MPA患者发生卡氏肺孢子虫感染,GPA组患者未发生卡氏肺孢子虫感染,但差异无统计学意义(P=0.159)。MPA组患者合并真菌感染(58.8%vs. 26.7%,P=0.038)和混合感染(44.1%vs. 13.3%,P=0.037)比例均高于GPA组,差异有统计学意义。
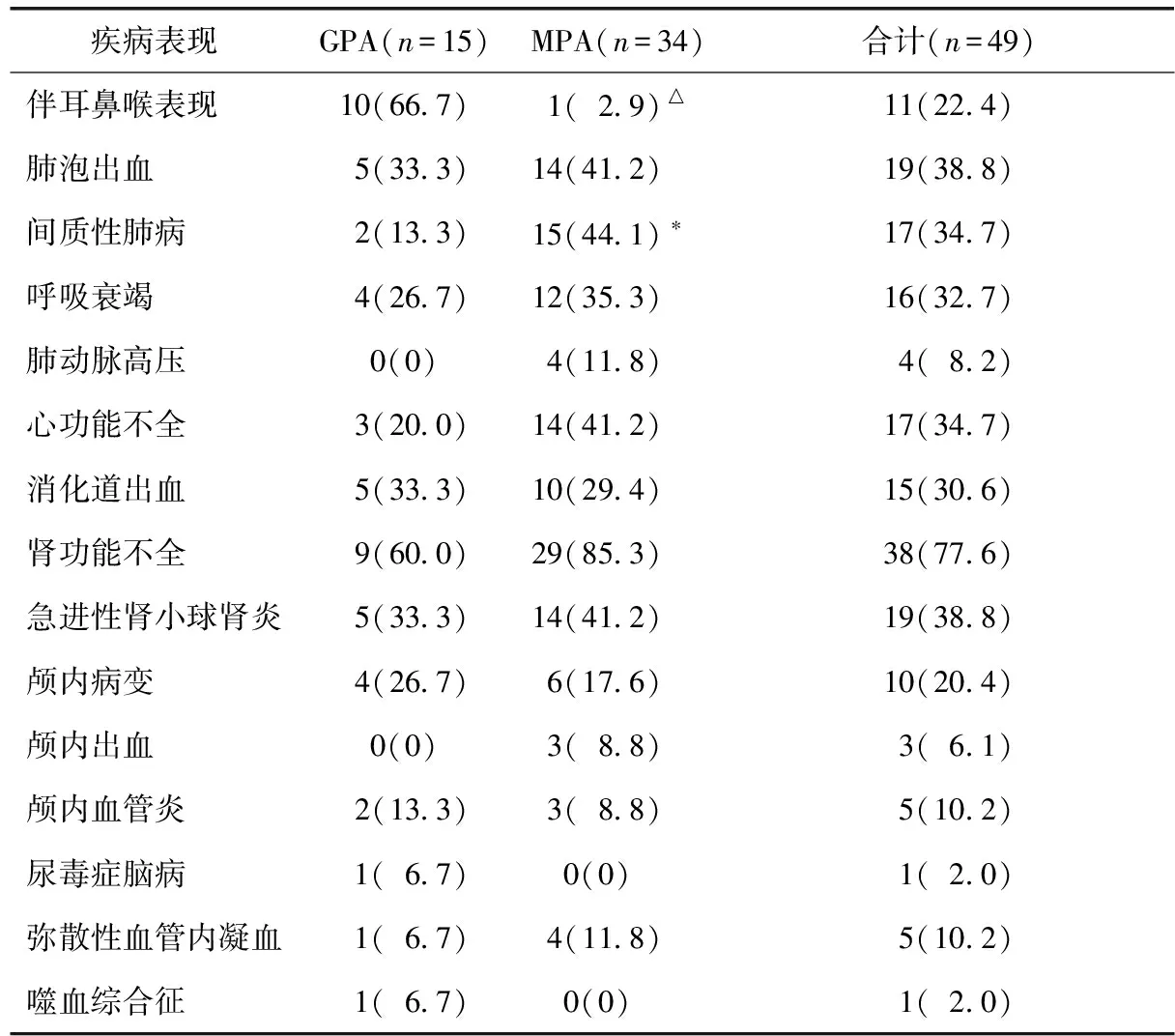
表3 肉芽肿性多血管炎和显微镜下多血管炎患者重要临床表现及脏器受累情况
GPA:肉芽肿性多血管炎;MPA:显微镜下多血管炎;两组比较,*P<0.05,△P<0.001
讨 论
ANCA相关性小血管炎患者全身多器官受累较为常见,常见累及脏器和系统包括皮肤(Skin)、肾脏(Kidney)、肺(Lung)、耳鼻喉(ENT)和神经系统(Nerve)等,有学者将其总结为“SKLEN”。符合3项即应考虑系统性血管炎可能;结合ANCA阳性可进行临床初步诊断,但确诊需病理支持。其中,肺和肾脏病变常较突出,其典型肾脏病理表现为寡或无免疫沉积型局灶节段坏死性肾小球肾炎或新月体性肾炎[2],肺部以坏死性血管炎和出血为特征性病理改变[8]。于峰等[4]研究发现,全部ANCA相关性小血管炎患者均合并肾脏病变,其中53.3%(8/15)发病即需肾脏替代治疗,肺部(13/15)和消化系统(10/15)病变也多见;该研究显示,93.3%(14/15)的患者死亡与感染相关,而肺部感染占73.3%(11/15)。本研究发现,死亡患者均存在肾脏病变,诊治过程出现RGPN者19例(38.8%),合并肾功能不全者占77.6%(38/49)。本研究对两组患者临床特点进行分析,结果示MPA患者年龄较大,肺部、肾脏、消化系统病变突出,常见表现依次为肺部感染、肾功能不全、肺间质病变、肺泡出血、心功能不全、RPGN、呼吸衰竭和消化道出血;GPA患者年龄相对较小,常见临床表现依次为肺部感染、耳鼻喉症状、肾衰竭、RPGN、消化道出血、肺泡出血、呼吸衰竭和颅内病变。
FFS适用于AAV的预后判断,研究发现,评分为0、1和≥2分时,其5年病死率分别为9%、21%和40%[8]。本研究结果显示,MPA患者较少伴耳鼻喉表现,且年龄较大,因此其FFS明显高于GPA。瑞典1项关于血管炎生存分析的研究显示,合并耳鼻喉表现者死亡风险明显降低,GPA和MPA自诊断至死亡时间中位数分别是20.5个月和16个月,MPA患者肾脏累及多见,生存率明显低于GPA患者;多因素分析显示,影响生存率最大危险因素是增龄,其次是肾功能不全程度[9]。本研究结果显示,MPA(3.85个月)和GPA(10.00个月)生存时间更短,且MPA明显低于GPA,说明MPA进展更快且病情更重。然而,GPA组FFS低于MPA组,部分患者死于突然大出血导致的失血性休克或窒息,表明GPA出血并非在FFS较高时出现,平时即应注意预防,其出血危险因素有待进一步评估,以掌握病情,及时控制危险因素。
死亡患者肺部病变表现突出,进展快,病情重。本研究显示,MPA和GPA组合计第一位死因累及系统均为呼吸系统,共占77.6%,而MPA更为突出,占82.4%。有研究发现,MPA合并肺间质病变多见,且在诊断MPA前多年即可发生,研究者认为亚临床肺微小出血反复发生可能导致肺间质病变,这种情况提示预后不良[8,10]。本研究发现,MPA死亡病例中,明确的肺间质病变占44.1%(15/34),明显高于GPA组(13.3%,2/15)。由于部分患者以感染为突出表现,可能掩盖了肺间质病变表现。如果之前或有机会控制感染后进行胸部高分辨率CT检查,肺间质病变的检出率可能更高。该结果一方面提示了肺间质改变导致感染和出血对MPA的预后起决定性作用,另一方面也加深了研究者对MPA肺部病变重要性的认识。靳建军等[11]统计北京协和医院MPA肺部病变发现,其中1/3以肺部病变为首发症状,且肺部感染是MPA的主要死因。因此,重视MPA肺间质病变和早期控制肺部感染可能是改善MPA预后的关键环节。
总之,MPA和GPA均为多器官受累,呼吸系统受累者病死率高。GPA首要死因是疾病本身导致出血,而MPA首要死因是感染。与GPA相比,MPA患者往往高龄、生存时间短、病死率高,易表现为病情重、进展快,且易发生严重感染。了解两种疾病的临床特征和主要死因,可针对不同患者制定出不同强度且个体化的治疗方案,以改善预后、降低死亡率。
[1]Jennette JC, Falk RJ, Bacon PA, et al. 2012 revised international chapel hill consensus conference nomenclature of vasculitides[J].Arthritis Rheum, 2013, 65:1-11.
[2]中华医学会风湿病学分会. 显微镜下多血管炎诊断及治疗指南[J].中华风湿病学杂志,2011, 15:259-261.
[3]吴小川, 李芳. 抗中性粒细胞胞浆抗体相关性血管炎的诊断与治疗[J].中国小儿急救医学, 2013, 20:231-235.
[4]于峰, 陈旻, 赵明辉, 等. 原发性ANCA相关小血管炎患者死因分析[J].北京医学, 2007, 29:196-199.
[5]崔思玲,夏红强,冷晓梅,等. 53例显微镜下多血管炎临床特点及预后[J].中华临床免疫和变态反应杂志, 2014,8:300-305.
[6]Leavitt RY,Fauci AS,Bloch DA,et al.The American college of Rheumatology 1990 criteria for the classification of Wegener’S Granulomatosis[J].Arthritis Rheum,1990,33:1101-1107.
[7]Guillevin L, Pagnoux C, Seror R, et al. The Five-Factor Score revisited: assessment of prognoses of systemic necrotizing vasculitides based on the French Vasculitis Study Group (FVSG) cohort[J].Medicine (Baltimore), 2011, 90:19-27.
[8]Birnbaum J, Danoff S, Askin FB, et al. Microscopic polyangiitis presenting as a “pulmonary-muscle” syndrome: is subclinical alveolar hemorrhage the mechanism of pulmonary fibrosis?[J].Arthritis Rheum, 2007, 56:2065-2071.
[9]Mohammad AJ, Jacobsson LT, Westman KW, et al. Incidence and survival rates in Wegener’s granulomatosis, microscopic polyangiitis, Churg-Strauss syndrome and polyarteritis nodosa[J].Rheumatology (Oxford), 2009, 48:1560-1565.
[10] Eschun GM, Mink SN, Sharma S. Pulmonary interstitial fibrosis as a presenting manifestation in perinuclear antineutrophilic cytoplasmic antibody microscopic polyangiitis[J].Chest, 2003, 123:297-301.
[11] 靳建军,施举红,陆慰萱,等. 显微镜下多血管炎肺部病变的临床特点[J].中华结核和呼吸杂志, 2011, 34:339-343.

