系统性红斑狼疮患者外周血单个核细胞微小RNA-206表达水平
徐庆雷,朱宝林,马小波,张 巍,刘玲玲,王胜军
(沭阳县人民医院检验科,江苏沭阳 223600)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种可累及多器官、多系统的慢性自身免疫性疾病,受累人群常为青年女性,其免疫学特征为患者血清中出现多种自身抗体和自身反应性CD4+T细胞数量增高[1]。辅助T(helper T,Th)细胞17(Th17细胞)是近年来新命名的一类辅助性CD4+T细胞亚群,其具有独特的分化途径和转录因子——孤儿核受体γt(orphan nuclear receptor γt,RORγt),且以分泌白细胞介素(interleukin,IL)17为特征[2]。研究表明,Th17细胞在SLE的发生发展中起重要作用[3- 4]。锌指样转录因子4(Kruppel-like transcription factor 4,KLF4)是Th17细胞分化的正调节因子[5]。微小RNA(microRNA,miRNA)(约20~22个核苷酸)为非编码RNA,可介导RNA干扰和在翻译水平抑制蛋白表达,人类KLF4是miRNA-206的靶分子之一[6]。
本研究采用实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)检测SLE患者外周血单个核细胞(peripheral blood mononuclear cell,PBMC)miRNA-206和KLF4 及RORγt mRNA表达水平,并分析其与KLF4、RORγt mRNA表达的相关性,探讨miRNA-206在SLE发病中的作用机制。
资料和方法
研究对象和分组
选择2012年12月至2013年11月在沭阳县人民医院确诊的SLE患者,入选病例均符合美国风湿病协会(American College of Rheumatology,ACR)1997年修订的SLE分类诊断标准[7]。排除伴有心力衰竭、呼吸衰竭、严重肝肾功能损害、严重感染、肿瘤及其他自身免疫病等情况。病情活动性评估采用SLE病情活动评分(systemic lupus erythematosus disease activity index,SLEDAI),即2000评分法[8]。 SLEDAI≤9分纳入SLE非活动组,SLEDAI>9分纳入SLE活动组。健康对照组选择沭阳县人民医院体检中心健康体检志愿者,且均无近期感染或自身免疫病史。
仪器与试剂
实时荧光PCR仪为CFX 96型,Ficoll-Hypaque人淋巴细胞分离液购自天津灏阳生物制品有限公司,淋巴细胞刺激剂佛波酯(PMA)、离子霉素购自Sigma公司,PCR引物由上海生工合成,Trizaol和SYBR Green购自Invitrogen公司。
方法
标本采集和处理:抽取清晨空腹肘静脉血3~5 ml,肝素钠抗凝,随后用Ficoll-Hypaque人淋巴细胞分离液梯度离心得到PBMC,PBS液洗2次,调整细胞数为1×106/ml,加入24孔细胞培养板,于含有淋巴细胞刺激剂佛波酯(50 ng/ml)和离子霉素(1.0 μg/ml)RPMI 1640完全培养基中37℃、5%CO2饱和湿度条件下温育5 h后收集细胞。
KLF4和RORγt mRNA及miRNA-206相对表达量检测:采用上述方法将PBMC刺激5 h后收集细胞提取总mRNA。按照试剂盒说明书逆转录DNA,合成的cDNA存于-20℃冰箱备用。所用引物序列依次为KLF4上游引物5’-CAA GTC CCG CCGCTC CAT TAC CAA-3’,下游引物5’-CCA CAG CCG TCCCAG TCA CAG TGG-3’;RORγt上游引物5’-CCTGGGCTCCTCG CCTGACC-3’,下游引物5’-TCTCTCTGCCCTCAGCCT TGCC-3’;β-actin上游引物5’-CACGA AACTACCTT CAACTCC-3’,下游引物为5’-CATACTCCTGCT TGCTGATC-3’。以β-actin为参照校准。miRNA-206上游引物为5’-GAGTGCTGGAATGTAAGGAAG-3’,下游引物为5’-GCAGGGTCCGAGGTATTC-3’,以U6小核RNA(small nuclear-RNA,snRNA)为内参照。每份样本采用相同反应体系及条件同时进行PCR扩增3次。
统计学分析
结 果
一般资料
共纳入SLE患者27例,其中男5例,女22例,平均年龄为(38±11)岁。SLE非活动组12例,SLE活动组15例。健康对照组20例,其中男4例,女16例,平均年龄为(35±8)岁。各组性别、年龄差异无统计学意义。
KLF4和RORγtmRNA及miRNA-206表达水平比较
SLE患者PBMC中KLF4和RORγt mRNA相对表达量显著高于健康对照组,差异均有统计学意义(均P<0.01),而miRNA-206相对表达量显著低于健康对照组,差异有统计学意义(P<0.01)(表1)。
SLE活动组PBMC中KLF4和RORγt mRNA表达水平显著高于SLE非活动组,差异均有统计学意义(均P<0.01),而miRNA-206相对表达量显著低于非活动组,差异有统计学意义(P<0.01)(表2)。
表1两组外周血单个核细胞中锌指样转录因子4和孤儿核受体γt mRNA及微小RNA-206表达水平比较

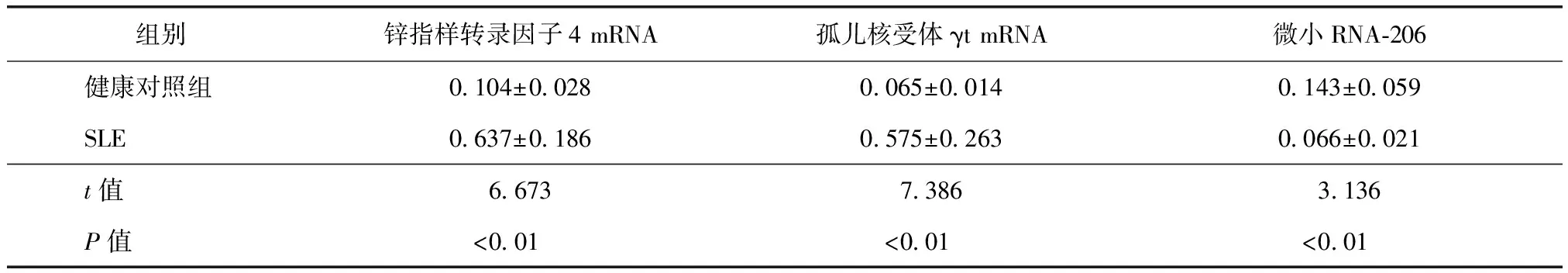
组别锌指样转录因子4mRNA孤儿核受体γtmRNA微小RNA⁃206健康对照组0 104±0 0280 065±0 0140 143±0 059SLE0 637±0 1860 575±0 2630 066±0 021t值6 6737 3863 136P值<0 01<0 01<0 01
SLE:系统性红斑狼疮
表2两组系统性红斑狼疮患者外周血单个核细胞中锌指样转录因子4和孤儿核受体γt mRNA及微小RNA-206表达水平比较


组别锌指样转录因子4mRNA孤儿核受体γtmRNA微小RNA⁃206非活动SLE组0 131±0 0560 094±0 0190 125±0 038活动SLE组0 973±0 2310 968±0 3160 034±0 015t值8 5039 1863 896P值<0 01<0 01<0 01
SLE:系统性红斑狼疮
相关性分析
SLE患者PBMC中KLF4和RORγt mRNA与SLEDAI呈正相关(P<0.01),而miR-206与SLEDAI评分呈负相关(P<0.01)(表3)。
直线相关分析显示,KLF4和RORγt mRNA相对表达量呈正相关(r=0.684,P<0.01)(图1)。
直线相关分析显示,miRNA-206与KLF4和RORγt mRNA表达水平均呈负相关(r=-0.627,P<0.01;r=-0.853,P<0.01)(图2、3)。
讨 论
SLE发病的确切机制尚不明了,研究证实T细胞免疫异常起着非常重要的作用,且与疾病发生发展和预后有很大关系。Th17细胞是一类不同于Th1和Th2的CD4+T细胞新亚群,此类细胞以主要分泌IL-17得名。RORγt是Th17细胞特异性转录因子,可调控IL-17的分泌[2]。研究表明,Th17细胞及其相关细胞因子在SLE的发病过程中发挥了重要作用[3- 4]。Wong等[9]报道,SLE患者外周血Th17细胞显著升高,且与疾病活动度呈正相关。本研究发现,SLE患者外周血Th17细胞的特异性转录因子RORγt mRNA的表达显著增高,与SLEDAI呈显著正相关(r=0.719,P<0.01),说明RORγt mRNA升高与SLE的发生及活动性密切相关。另外,本研究将SLE患者按疾病活动度分为活动组与非活动组后比较发现,SLE活动组RORγt mRNA显著高于SLE非活动组和健康对照组,而SLE非活动组与健康对照组之间差异无统计学意义,提示RORγt mRNA水平高低可反映SLE疾病的活动性。
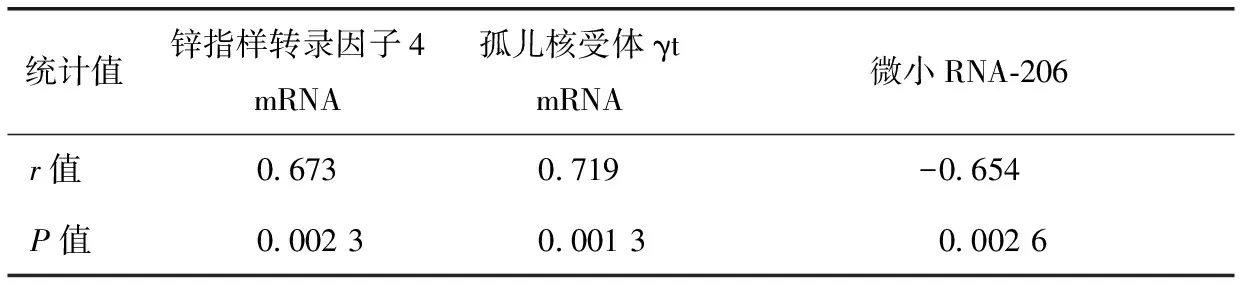
表3 系统性红斑狼疮患者外周血单个核细胞中锌指样转录因子4和孤儿核受体γt mRNA及微小RNA-206表达水平与病情活动评分相关性分析
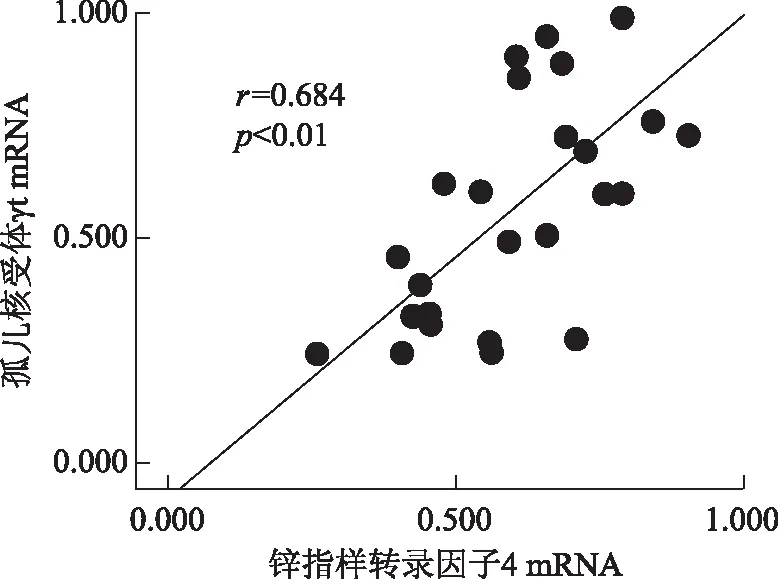
图1系统性红斑狼疮患者外周血单个核细胞中锌指样转录因子4和孤儿核受体γt mRNA表达相关性分析
Fig1Correlation analysis between the expression levels of Kruppel-like factor 4 and orphan nuclear receptor γt in peripheral blood mononuclear cells in patients with systemic lupus erythematosus

图2系统性红斑狼疮患者外周血单个核细胞中微小RNA-206与锌指样转录因子4 mRNA相关性分析
Fig2Correlation analysis between the expression levels of Kruppel-like factor 4 and microRNA-206 in peripheral blood mononuclear cells in patients with systemic lupus erythematosus
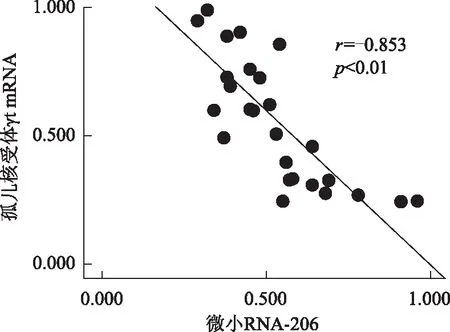
图3系统性红斑狼疮患者外周血单个核细胞中微小RNA-206与孤儿核受体γt mRNA相关性分析
Fig3Correlation analysis between orphan nuclear receptor γt and microRNA-206 in peripheral blood mononuclear cells in patients with systemic lupus erythematosus
KLF家族是真核生物中一大类基础转录因子(basic transcription element-binding protein,BTEB)[10],KLF4则为其家族中的一员。KLF4包含3个结构域,即高度保守的C-端DNA结合结构域,高度可变的N-端转录调节结构域和核定位序列[11]。KLF4能结合靶基因富含Gc的启动子序列,促进或抑制靶基因的表达;且对Th17细胞分化具有正调节作用[5]。本研究结果示,SLE患者PBMC中KLF4 mRNA表达显著增高,且与RORγt mRNA表达呈正相关(r=0.684,P<0.01);提示SLE患者PBMC中KLF4 mRNA可以上调RORγt mRNA表达,促进Th17细胞分化。此外,本研究将SLE患者按疾病活动进一步分组发现,SLE活动组KLF4 mRNA显著高于SLE非活动组与健康对照组,与上述SLE活动组RORγt mRNA显著高于SLE非活动组与健康对照组结果一致,验证了KLF4 mRNA是调控Th17细胞重要因子的结论。
miRNA是一类内源性小分子RNA,其常规作用方式是通过与靶基因的3’UTR结合抑制靶基因的表达[12]。人类KLF4是miRNA-206的靶分子之一,miRNA-206对KLF4的表达具有抑制作用[6]。本研究发现,SLE患者PBMC中miRNA-206表达下降而KLF4 mRNA表达水平升高,两者呈负相关(r=-0.627,P<0.01),与其结果相符;SLE活动组miRNA-206显著低于SLE非活动组与健康对照组,miRNA-206与SLEDMI呈显著负相关(r=-0.654,P<0.01),证实了活动期SLE患者体内miRNA-206减少。同时,本研究还发现,SLE患者PBMC中miRNA-206与RORγt mRNA表达也呈显著负相关(r=-0.853,P<0.01),提示miRNA-206可能通过调节KLF4 mRNA的表达,参与调控Th17细胞。
SLE是一种异质性疾病,其发病机制复杂。本研究发现,SLE患者PBMC中miRNA-206、KLF4和RORγt mRNA表达存在显著异常,并与疾病活动性密切相关,提示这三者共同变化可能在SLE的发生发展中起重要作用,由此为SLE发病机制和治疗学的研究提供新思路。然而,其相关分子机制尚待进一步研究。
[1]Wong CK, Lit LC, Tam IS, et al. Aberrant production of soluble eostimulatory molecules CTLA- 4, CD28, CD80 and CD86 in patients with systemic lupus erythematosus[J].Rheumatology (Oxford), 2005, 44:989-994.
[2]Weaver CT, Hatton RD, Mangan PR, et al. IL-17 family cytokines and the expanding diversity of effectorT cell lineages[J].Ann Rev Immunol, 2007, 25:821-852.
[3]张少然, 张艳华, 茹晋丽, 等. Th17细胞和调节性T细胞在系统性红斑狼疮患者中的研究[J].中华风湿病学杂志, 2011, 15:381-384.
[4]Yang J, Chu YW, Yang X, et al. Th17 and natural Treg cell population dynamics in systemic lupus erythematosus[J].Arthritis Rheum, 2009, 60:1472-1483.
[5]An J, Golech S, Klaewsongkram J, et al. Kruppel-like factor 4 (KLF4)directly regulates proliferation in thymocyte development and IL-17 expression during Th17 differentiation[J].FASEB J, 2011, 25:3634-3645.
[6]Parasramka MA, Dashwood WM, Wang R, et al. A role for low-abundance miRNAs in colon cancer: the miR-206/Kruppel-like factor 4 (KLF4) axis[J].Clin Epigenetics, 2012, 4:16-26.
[7]Smith EL, Shmerling RH. The American College of Rheumatology criteria for the classification of systemic lupus erythematosus:strengths,weaknesses,and opportunities for improvement[J].Lupus, 1999, 8:586-595.
[8]Uribe AG, Vilá LM, McGwin G Jr, et al. The Systemic Lupus Activity Measure-revised, the Mexican Systemic Lupus Erythematosus Disease Activity Index(SLEDAI), and a modified SLEDAI-2K are adequate instruments to measure disease activity in systemic lupus erythematosus[J].J Rheumatol, 2004, 31:1934-1940.
[9]Wong CK, Lit LC, am LS, et al. Hyperproduetion of IL-23 and IL-17 in patients with systemic lupus erythematosus:implications for Th 17-mediated inflammation in autoimmunity[J].Clin Immunol, 2008, 127:385-393.
[10] Yang HW, Xia T, Chen ZL, et al. Cloning, chromosomallocalization and expression patterns of porcine Krüppel-like factors 4, -5, -7 and the early growth response factor 2[J].Biotechnol Lett, 2007, 29:157-163.
[11] Pearson R, Fleetwood J, Eaton S, et al. Kruppel-like transcription factors: a functional family[J].Int J Biochem Cell Biol, 2008, 40:1996-2001.
[12] Stefani G, Slack FJ. Small non-coding RNAs in animal development[J].Nat Rev Mol Cell Biol, 2008, 9:219-230.

