SD大鼠食物过敏动物模型建立及其消化系统超微结构变化
闫秀梅,闫景彬,黄爱芬,黄开宇
(温州医科大学附属育英儿童医院消化内科,温州 325000)
食物过敏在全球的发病率逐年上升,严重影响儿童生活质量[1]。研究表明,儿童食物过敏发病率为4%~6%。流行病学资料显示,从2003到2013年18岁以下儿童食物过敏发生率增加了18%[2]。然而,目前尚无食物过敏的特效疗法。由于伦理学限制和严重过敏反应,使人类食物过敏的研究受到限制。所以,利用食物过敏原建立动物食物过敏模型寻求新的预防和治疗措施是最为常用的研究方法。目前,国际上尚无统一的食物过敏动物模型建立方法,本研究探讨SD大鼠食物过敏动物模型的适宜条件及该模型消化系统超微结构的改变,探索理想的动物模型,以期为食物过敏的防治提供理论依据。
材料和方法
实验动物
清洁级4周龄断乳SD幼鼠30只,雌雄各半,购自上海斯莱克实验动物有限责任公司。实验动物在温州医科大学实验动物中心以不含卵清蛋白(ovalbumin,OVA)的标准饲料及灭菌双蒸水适应性喂养1周,饲养温度23℃±3℃,湿度50%~70%,体质量60~80 g。鼠笼每周清洗消毒2次,采用12 h:12 h自动昼夜循环。
分组及模型建立
将30只实验动物称量并记录各自体重,随机编取30个数字,取其中20只为食物过敏组,10只为对照组。食物过敏组:第1天以含OVA 40 μg和氢氧化铝31 mg的无菌生理盐水0.5 ml溶液腹腔注射进行基础致敏;第15天腹腔注射含OVA 40 μg的无菌生理盐水0.5 ml进行强化致敏;第20天起以OVA生理盐水溶液0.5 ml(OVA含量为30 mg)行隔日灌胃激发直至第49天。对照组:等量生理盐水进行腹腔注射及灌胃。以腹泻为造模成功标志。
血清OVA-IgE检测
腹腔注射第1天记为第0天,分别于1、2、3、4、5、6、7周从大鼠尾静脉取血1次,每次约0.5 ml,将其室温静置30 min后离心,获得血清。酶联免疫吸附试验检测血清OVA-IgE抗体水平。具体步骤参照说明书。
肠组织病理学检测及超微结构观察
实验第49天麻醉大鼠,取其十二指肠Treitz韧带以下5 cm小肠标本,一段放于中性甲醛固定液中并以石蜡包埋和切片,一块(1 mm×1 mm×1 mm)放于电镜液中(温州医科大学电镜室提供)以进行光镜与电镜标本组织形态学观察。随机连续计数每个肠组织玻片高倍视野内肠黏膜嗜酸粒细胞(eosinophils,EOS)数目,累计10个高倍视野内EOS总数,取平均值作为EOS密度。甲苯胺蓝特殊染色后进行肥大细胞计数,随机连续计数每个肠组织玻片10个高倍视野内MC数,取平均值代表其密度(个/HPF);累计10个高倍视野内MC总数及脱颗粒MC数,计算MC完整性百分率,公式为MC完整性百分率=[(肥大细胞总数-脱颗粒肥大细胞数)/肥大细胞总数]×100%。电镜下观察小肠黏膜层绒毛、线粒体、内质网及紧密连接改变。
统计学分析
运用统计软件SPSS17.0进行数据分析,采用重复测量资料的方差分析方法分析抗体含量组间差别、时间变化趋势及组别和时间的交互作用。采用多元方差分析方法分析不同时间点组间差异。计量资料用均数±标准差表示。所有统计检验均采用双侧检验,以P<0.05为差异有统计学意义。
结 果
一般情况
食物过敏组表现为狂躁不安、易激惹。灌胃30 min后观察大鼠腹泻情况,20%食物过敏组动物在灌胃激发后3次出现腹泻,40%在第4次出现腹泻,>90%在第7次发生腹泻,第10次所有大鼠均出现腹泻。
血清OVA-sIgE检测结果
食物过敏组OVA-IgE水平在第4~6逐渐升高,与对照组比较差异有统计学意义(P<0.01)。食物过敏组OVA-IgE水平在第7周下降,与对照组比较差异仍有统计学意义(P<0.01)(表1)。
肠黏膜EOS密度比较和组织形态学改变
与对照组(n=5)相比,食物过敏组(n=10)肠黏膜EOS密度明显升高,差异有统计学意义[(1.70±0.42)个/HPFvs. (16.48±2.32)个/HPF,P=0.001]。光镜下可见食物过敏组动物肠黏膜明显损伤,小肠绒毛破坏、肿胀、脱落且明显减少。对照组肠黏膜形态完整,肠绒毛排列整齐,组织结构清晰完整(图1)。
肠黏膜组织肥大细胞密度和完整性百分率
对照组肠黏膜固有层仅能看到极少量肥大细胞,结构完整,轮廓清晰,无聚集、脱颗粒现象;食物过敏组肠黏膜固有层可见较多肥大细胞聚集,伴胞膜破裂,轮廓不清,并向外排出紫红色颗粒(图2)。
食物过敏组(n=10)和对照组(n=5)肠黏膜肥大细胞总数分别为(9.02±1.55)个/HPF和(1.84±0.87)个/HPF,完整性百分率分别为(36.50%±12.54%)和(92.20%±6.87%),两组比较差异有统计学意义(均P<0.01)。
肠黏膜层电镜超微结构改变
与对照组相比,食物过敏组电镜下肠黏膜层小肠绒毛排列紊乱,甚至脱落,线粒体、内质网肿胀,细胞连接增宽(图2)。
讨 论
目前,国内外已发表较多关于OVA致食物过敏动物模型的报道,但建模所选取的动物种类不一,建模方式也各有不同,建模标准尚未统一。模型较多采用小鼠致敏模型[3- 4],包括C3H/HeJ、BALB/c、C57/BL6和DBA/2小鼠等,主要是因为体积小,繁殖周期短,容易处理,通常不受遗传基因影响;且易产生高IgE和高IgG可用作研究食物过敏;然而,连续间断性收集血液标本则较难达到。也有学者采用BN大鼠建立食物过敏动物模型[5],BN大鼠食物过敏模型的优点是动物大小适中,易连续采血观察血清特异性IgE和IgG。de Jonge等[6]分别给不同品系鼠口服鸡OVA6周,结果只有BN鼠能产生高水平的OVA特异性IgE抗体。但也有研究表明,BN鼠在新生期经口腔给予OVA,断乳后再灌胃或腹腔注射OVA均不能诱导过敏反应[7]。所以,为增加BN鼠口服致敏的敏感性和避免交叉反应,需要至少连续两代用不含所研究蛋白或同种其他蛋白的特制饲料喂养。本研究选择实验动物为SD大鼠,SD大鼠属于远交系封闭群,生长快,繁殖周期短,抗病力强,容易饲养,价格较BN鼠便宜。与BALB/c小鼠相比,SD大鼠可间断收集血液标本,是我国比较常用的实验动物之一。本研究结果显示,应用SD大鼠建立食物过敏动物模型,其所有大鼠均发生腹泻,IgE明显升高,小肠超微结构发生改变,表明可应用SD大鼠建立食物过敏模型。
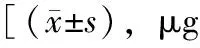
表1 两组SD大鼠不同实验时间血清卵清蛋白-IgE含量变化
与对照组比较,*P<0.01
诱导食物过敏有多种途径,包括口服给药、腹腔注射、灌胃给药和皮下注射等。不同鼠类种系致敏途径不同。有研究应用BALB/c小鼠研究不同给药途径致敏情况,5周龄雄性BALB/c小鼠第1天腹腔注射OVA(50 μg),2周后再次腹腔注射OVA(50 μg),同时应用氢氧化铝为佐剂,2周后每隔1 d灌胃口服OVA(50 mg),小鼠腹泻持续1 h,连续6个月,而为进行腹腔注射的小鼠未发生腹泻;该研究者认为,可能与未经过腹腔注射致敏小鼠容易发生口服耐受有关[8]。也有研究表明,佐剂如氢氧化铝等预处理可预防口服耐受。Golias等[9]研究了2个月龄雌性BALB/c小鼠,分别于第1和14天腹腔注射OVA 60 μg和1 mg氢氧化铝,2周后每2~3 d灌胃1次15 mg OVA,共10次,灌胃30 min后观察腹泻情况;第5次灌胃后70%小鼠发生腹泻,第7次超过90%小鼠发生腹泻,第10次100%发生腹泻,本研究结果与之相似。本研究为造模成功,同样使用氢氧化铝佐剂与腹腔注射基础致敏,结果示所有大鼠均出现腹泻,提示低剂量基础致敏(加佐剂)与高剂量灌胃激发可成功造模。
Chen等[10]研究了剂量、致敏时间与IgE的相关性,分别给予6~8周龄BALB/c小鼠腹腔注射5、0.05、0.5 mg OVA,致敏次数分别为2次(第0和3天)和5次(第0、3、6、9和12天),并检测IgE水平;结果发现,腹腔注射0.05 mg OVA,激发5次会产生较高水平IgE且更易致敏,第28天IgE水平较高。Atkinson和Miller[11]给予BN大鼠口服OVA 0.5~6.25 mg/100 g,2次/周,持续6周;第21天给予OVA 2.5 mg/100 g后BN大鼠均出现IgG升高,且该水平在第28天达到高峰;高剂量组(5 mg/100 g~6.25 mg/100 g)IgE水平在第14天即可测出,而低剂量组在第28天才可测出。Kostadinova等[12]通过BN大鼠研究了食物过敏模型,该研究规定了OVA剂量(0.002~20 mg/ml)、激发途径(口服或灌胃)和激发次数(每天,2次/周,1次/周,每2周1次)等3个主要条件,持续6周;结果发现,每天灌胃1 mg OVA,在第28和42天可检测特异性IgE,口服0.002、0.02和0.2 mg OVA均未产生特异性抗体;口服2 mg和20 mg OVA可产生IgG抗体,但未产生IgE抗体;该实验表明,给药途径和剂量均可影响免疫反应。本实验参照国外文献[8],致敏时间至49 d,首先腹腔注射基础致敏及强化致敏,同时应用佐剂,然后大剂量隔日灌胃激发;结果发现,所有大鼠均出现腹泻,且EOS和肥大细胞计数均明显升高,小肠超微结构发生明显改变。
食物过敏模型的研究已取得了很大进展,但是国际上仍未有统一标准模型。本研究采用致敏原OVA与免疫佐剂氢氧化铝,通过低剂量OVA腹腔注射致敏联合高剂量OVA灌胃激发成功建立了SD大鼠食物过敏模型。
(本文图1、2见封三)
[1]Leonard SA,Martos G,Wang W,et al. Oral immunotherapy induces Local protective mechaisms in the gastrointestinal mucosa[J].Allergy Clin Immunol,2012,129:1579-1587.
[2]Cavkaytar O,Akdis CA,Akdis M. Modulation of immune responses by immunotherapy in allergic diseases[J].Curr Opin Pharmacol,2014,22:30-37.
[3]Kim JY,Choi YO,Ji GE. Effect of oral probiotics (Bifidobacterium lactis AD 011 and Lactobacillus acidophilus AD031) administration onovalbumin-induced food allergy mouse model[J].Microbiol Biotechnol,2008,18:1393-1400.
[4]Smarr CB,Hsu CL,Byrne AJ,et al Antigen-fixed leukocytes tolerize Th2 responses in mouse models of allergy[J].Immunol,2011,187:5090-5098.
[5]Yang B,Yang C,Wang P,et al. Food allergen—induced mast cell degranulation is dependent on PI3K-mediated reactive oxygen species production and upregulation of store-operated calcium channel subunits[J].Scand J Immunol,2013,78:35- 43.
[6]de Jonge JD,Ezendam J,Knippels LM,et al. Bis(tributyltin)oxide (TBTO) decreases the food allergic response against peanut and ovalbumin in Brown Norway rats[J].Toxicology,2007,239:68-76.
[7]Sun N,Zhou C,Pu Q,et al.Allergic reactions compared between BN and Wistar rats after oral exposure to ovalbumin[J].Immunotoxicol,2013,10:67-74.
[8]Yamamoto T,Kodama T, Lee J,et al. Anti-allergic role of cholinergic neuronal pathway via α7 nicotinic ACh receptors on mucosal mast cells in a murine food allergy model[J].PLoS One, 2014,9:858-864.
[9]Golias J,Schwarzer M,Wallner MP,et al. Heat-induced structural changes affect OVA-antigen processing and reduce allergic response in mouse model offood allergy[J].PLoS One,2012,7:156-159.
[10] Chen C, Sun N,Li Y,et al. A BALBc mouse model for assessing the potential allergenicity of proteins: comparison of allergen dose,sensitization frequency, timepoint and ex[J].Food Chem Toxicol,2013, 12:41- 47.
[11] Atkinson HA,Miller K. Assessment[correction of Asessment] of the brown Norway rat as a suitable model for the investigation of food allergy[J].Toxicology,1994, 91:281-288.
[12] Kostadinova AI,Willemsen LE,Knippels LM,et al.Immunotherapy-riskbenefit in food allergy[J].Pediatr Allergy Immunol,2013,24:633- 644.

