自噬在肝再生中的作用
王棋文,常翠芳,谷宁宁,潘翠云,徐存拴
1. 河南师范大学,生命科学学院,省部共建细胞分化调控国家重点实验室培育基地,新乡453007;
2. 河南师范大学,河南省生物工程重点实验室,新乡453007;
3. 河南师范大学,生物工程药物河南省工程实验室, 新乡453007
自噬在肝再生中的作用
王棋文1,2,3,常翠芳1,2,3,谷宁宁1,2,3,潘翠云1,2,3,徐存拴1,2,3
1. 河南师范大学,生命科学学院,省部共建细胞分化调控国家重点实验室培育基地,新乡453007;
2. 河南师范大学,河南省生物工程重点实验室,新乡453007;
3. 河南师范大学,生物工程药物河南省工程实验室, 新乡453007
自噬是存在于真核细胞内的一种溶酶体依赖性的降解途径,在肝脏生理和病理过程中发挥着重要作用。肝脏具有强大的再生能力,在受到急、慢性损伤时,残肝细胞将会被激活进入细胞周期进行细胞增殖,以补偿丢失的肝组织和恢复肝功能。文章阐述了各种类型损伤之后的肝再生与自噬的关系。在物理性、酒精、食源性等因素引起的肝损伤中,肝脏通过启动自噬来促进肝再生;在化学性损伤的肝再生模型中,自噬在其中的作用仍然有争议;在病毒感染之后的肝再生中,一些嗜肝病毒(如丙肝病毒和乙肝病毒等)反而利用自噬来促进病毒颗粒复制,抑制肝再生。对自噬和肝再生机制的研究,将有助于进一步阐明再生过程,为治疗肝脏疾病提供新方法。
肝再生;自噬;肝脏功能;肝损伤
肝再生是指正常肝脏出现急、慢性损伤时,肝组织重新被修复和替换的过程。大多数成年组织器官,损伤后往往通过疤痕组织,而不是再生来修复,因此往往会导致功能障碍。与此相比,肝脏具有惊人的修复能力。在受到损伤时,残余的或未受到损害的肝细胞可以通过DNA 合成和有丝分裂增殖,以补偿丢失、损伤的肝组织并恢复肝脏的生理功能。目前,主要有两种生理方式的肝再生:一是在大多数情况下,由于药物、毒物、肝切除手术或急性病毒感染引起的肝脏损伤时,处于静止状态的正常肝细胞作为主要细胞类型进行增殖和实现再生;二是当肝脏受到严重损伤时,肝细胞增殖不能满足肝再生需要,此时处于静止状态的储备祖细胞被激活,增殖分化为肝脏细胞,以满足再生需要[1]。研究表明,肝再生过程中超过95%的成熟肝细胞同步从G0期进入细胞生长周期。其中肝细胞在肝脏中数量最多,占肝脏细胞总数的65% 和总肝重的70%~80%,是肝再生中首先进行复制的细胞,然后依次为胆管上皮细胞、枯否细胞、星状细胞和肝窦内皮细胞。与肝细胞增殖相关的细胞因子在其中发挥着重要作用[2,3]。在肝再生过程中,当肝细胞分裂进行重要核酸和蛋白质合成时,肝脏必须维持能量平衡来满足再生需要。小鼠部分肝切除后,磷酸肌醇依赖性蛋白激酶1(Pdk1)介导的细胞增殖反应在再生过程发挥着重要作用[4]:这条通路的下游分子包括Akt和p70S6,其中Akt激活mTOR后可特异性地影响再生细胞大小;p70S6调控40S核糖体蛋白S6来调节蛋白合成和细胞增殖[1]。研究证实,mTOR是自噬启动阶段关键调节因子,在营养状况、生长条件等改变时,特殊残基发生磷酸化,通过影响自噬相关基因Atg1和Atg13的表达来调节自噬水平[5]。这说明自噬可能在部分肝切除后的恢复过程中发挥重要作用。在缺血再灌注[6]、脂肪肝[7]、化学性[8]和病毒性损伤[9]诱导的肝再生模型中也发现了自噬相关蛋白的异常表达。随着近几年对肝再生研究的逐步深入,自噬在肝再生中的作用受到越来越多的重视。
1 自噬和肝脏功能
自噬,即“细胞的自我消化”,是将细胞成分如长寿命蛋白质、细胞器、脂滴、细胞内病原体等通过溶酶体途径降解的过程[10]。根据细胞物质运到溶酶体内的途径不同,自噬分为3类:巨自噬、微自噬和降解胞质中含有KFERQ五肽序列蛋白质的伴侣介导的自噬。在真核生物细胞中,巨自噬(以下简称为自噬)是研究的较为清楚的一种降解机制。内质网(ER)上富含磷脂酰肌醇-3-磷酸(PI3P)的欧米茄体(Omegasome)参与形成自噬前体(Phagophore),自噬前体延伸形成双层膜或多层膜结构的自噬体(Autophagosome),然后通过细胞骨架系统与溶酶体(Lysosome)融合形成自噬溶酶体(Autolysosome)来降解细胞内的成分(图1)[11]。这些过程都受到一组在生理上和进化上高度保守的自噬相关基因(Atg)的调控。
研究表明,自噬在肝脏生理和病理过程中发挥着重要作用。肝脏的许多功能也多依赖于肝脏细胞的自噬反应。首先,肝脏具有独特的再生能力,肝再生中肝脏细胞通过自噬来清除无法更新的细胞或细胞代谢产物,当受损的细胞器、氧化产物和集聚的蛋白质不能及时通过自噬降解,就会导致各种肝脏疾病;其次,自噬具有调节肝脏代谢和肝脏细胞增殖的功能,自噬降解的产物如氨基酸、脂肪酸等,不仅能维持肝脏自身能力需求,而且能合成葡萄糖和储存脂肪为全身提供能量;再次,肝脏具有独特的解剖结构,门静脉直接接受从肠道运输而来的血液。肝脏通过自噬作用来抵御外来抗原、肠道细菌的代谢产物如脂多糖、病毒侵袭等,因此自噬在肝脏免疫调控中发挥着重要作用[12,13]。研究指出,抑制自噬水平会造成肝肿大,随后是炎症、肝炎和肿瘤发生[11]。自噬水平的降低会导致SQSTM1(p62)的积聚。p62作为一种信号枢纽激活NF-κB传导途径,通过Nrf2的转录因子活化编码抗氧化蛋白和解毒酶的基因转录[14]。肝脏缺血再灌注模型已经指出,基础水平的自噬每小时降解1.5%全肝蛋白;在饥饿的条件下,增加到4.5%;啮齿类动物饥饿达到48 h,可以达到40%[12]。小鼠正常肝脏中的自噬相关基因Atg7敲除90 d后,肝脏重量增加了将近4倍,组织学研究表明此时肝小叶结构消失,肝细胞肿胀,里面充满了含有线粒体和脂滴的液泡结构,肝细胞中异常过氧化物酶体、线粒体和膜结构数量增加,最终引起肝细胞死亡[15]。与其他细胞相比,肝细胞生存周期长,但增殖率低,加上含有丰富的溶酶体和溶酶体酶使其具有更高的自噬水平。以上研究表明,肝脏自噬功能的变化将对肝脏生理学功能产生巨大影响。
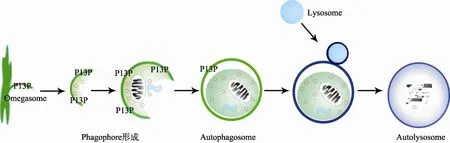
图1 自噬的发生过程
2 物理性损伤后的肝再生与自噬
2.1部分肝切除与自噬
研究表明,70%肝切除,啮齿类和鱼类在几天就可以完成再生过程,人类在数周后肝脏的结构和功能恢复至正常水平[2]。建立小鼠或大鼠2/3肝切除模型是研究肝再生过程最常用的一种方法。首先因为肝脏的多叶结构,这种部分肝切除后没有广泛的坏死和炎性反应。其次,肝切除所用的时间较短,可以对再生进行精确的定位[16]。
肝切除后早期应激信号的发生可能是增加每单位肝脏质量对能量需求的结果。剩余的肝组织继续保留了肝脏特异性的功能,如糖异生、尿素合成和蛋白质、核酸以及其他细胞成分合成所必须的ATP[17,18]。肝切除后6 h内ATP的含量明显减少,这个趋势一直贯穿于肝细胞DNA复制前期。而且从静止期到有丝分裂期肝细胞的变化伴随着细胞内蛋白和细胞器的重组[19],这一过程就涉及自噬的调控作用。C57BL/6小鼠肝脏70%切除后,自噬水平的降低一直贯穿于再生早期。而自噬的诱导剂卡马西平却能促进肝再生,同时降低肝损伤[20]。王棋文等[21]利用生物信息学分析了大鼠2/3肝切除后树突状细胞中的自噬活动,发现其在再生早期和晚期阶段增强,增殖期减弱。在肝再生早期主要是腺苷酸活化蛋白激酶(AMPK) 信号,在肝再生末期p53 和AMPK 信号共同参与自噬的调节,说明自噬参与了肝再生免疫反应。肝细胞老化也是其应激条件下的一种适应机制,其特征包括肥大、不可逆的生长停滞、衰老相关β-半乳糖苷酶以及衰老相关的分泌型蛋白如IL-6、IL-8和基质金属蛋白酶等表达上调[22]。衰老相关的分泌型蛋白通过抑制急性炎性反应和募集免疫细胞清除老化细胞的方式来促进组织的修复。在再生过程中,老化的组织和细胞逐渐被新生的同种细胞代替,以维持组织结构和功能的完整与稳定[23,24]。在Atg5敲除的小鼠模型中,70%肝切除后肝再生过程受到严重影响,有丝分裂减少,同时代偿性的肝肥大和老化肝细胞增多[25]。以上研究结果说明自噬在机体肝再生中维持机体能量的动态平衡中发挥着积极作用。但另一方面,C57BL/6小鼠腹腔注射雷帕霉素增强自噬,却会抑制肝再生,肝脏损伤加剧,外源性的皮下注射IL-6和HGF可以部分恢复由雷帕霉素造成的肝损伤[26]。这可能是由于自噬的增强抑制了mTORC1的表达,间接地破坏了肝细胞能量传感系统[27]。对于部分肝切除后自噬在肝再生中的作用以及相关调控机制仍未阐明,其中动物模型以及刺激因子的种类和作用的时间可能是其中重要的因素。
2.2缺血再灌注与自噬
缺血再灌注损伤是指遭受一定时间缺血的组织细胞恢复血流(再灌注)后,组织损伤程度迅速增剧的情况,包括活性氧(ROS)和活性氮(RNS)的大量生成、Ca2+紊乱、细胞抗氧化物质丢失、线粒体失活等。研究表明,肝组织缺血和肝细胞营养缺乏都能激活自噬,抑制自噬后会造成ROS的大量生成,肝细胞以坏死为主,加入NAC后损伤减轻损伤加剧[28]。成年小鼠中自噬相关蛋白Atg4B缺失,对缺血再灌注损伤的敏感性增加,增强自噬的活性可以明显改善在灌注后引起的肝脏损伤并恢复线粒体功能[29]。临床上也通过预先缺血处理的方法可来降低化疗引起的肝损害[30]。但是持续的缺血会降低自噬相关蛋白的表达,尤其是ATG7和 BECN1,进一步使自噬的保护功能减弱。药理学研究指出,肝缺血中ATG7和 BECN1水平降低主要是内质网Ca2+超载激活钙蛋白酶引起的一系列级联反应[31]。在灌注的起始阶段,线粒体去极化,产生ATP,激活自噬。同时缺血的肝细胞中产生的大量Ca2+和ROS也能激活自噬。当自噬的清除能力高于灌注引起的线粒体损伤时,细胞能量平衡得到维持。反之,就会引起线粒体通透性的改变,使氧化磷酸化的偶联作用遭到破坏,最终导致肝细胞死亡[29]。
3 酒精损伤后的肝再生与自噬
研究表明每天饮酒50~60 g就有可能引起酒精性肝病的发生,最终可能导致肝炎、肝硬化和肝癌[32]。在细胞水平上,酒精可以改变肝细胞对肿瘤坏死因子(TNF)的反应性,减少胰岛素底物受体磷酸化,损害HGF受体的自身磷酸化等[33]。Wu等[34]研究表明,酒精代谢产物ROS会诱导细胞色素P450 2E1表达上调,促使肝脏发生自噬,通过选择性的清除脂滴和受损伤的线粒体来抵御酒精损害。而长期酒精暴露会导致肝细胞中长寿命蛋白代谢变慢,自噬小体数量减少。一个典型的特征是出现玻璃样变的Mallory小体,这种胞浆包涵体富含角蛋白8、角蛋白18、泛素和SQSTM1等,雷帕霉素处理可以明显减少Mallory小体的数量[35]。推测原因可能是AMPK活性降低和自噬小体形成之后囊泡运输障碍引起的[36]。“细胞能量调节器”AMPK活性降低,一方面会关闭分解代谢途径,同时开放合成代谢,增加ATP的消耗;另一方面会通过激活mTORC1的生物功能[37]和抑制BECN1:Vps34复合物I中的BECN1的磷酸化[38]等途径来抑制自噬的发生,进一步破坏细胞能量平衡;而囊泡运输障碍会影响自噬溶酶体的形成,造成脂滴和受损线粒体的大量堆积,进一步使肝脏损伤加剧。
4 食源性肝脏损伤后的肝再生与自噬
食源性肝损伤主要指除酒精以外由其他因素引起的肝脏器质性和功能性损害,是代谢性肝病的重要组成成分,通常伴随着肥胖和糖尿病,主要特征是引起脂肪变性和胰岛素抵抗。研究表明,轻度的脂肪变性不但对部分肝切除后肝细胞的凋亡没有影响,而且还通过HGF、瘦素和ERK途径促进肝细胞的增殖[39]。但是在术后再生晚期时,中重度脂肪肝的再生指数明显降低,说明肝脂肪变性会影响肝脏的再生[40]。线粒体氧化来源于脂滴和肝细胞中的游离脂肪酸,是为肝细胞增殖提供能量的一种快速而高效的方式,游离脂肪酸同时还为脂质合成和细胞增殖提供底物,而自噬是通过溶酶体途径为细胞提供能量的一种方式,说明自噬、脂肪变性和肝再生这三者之间具有内在联系。研究表明,自噬有利于糖原异生、脂肪酸ß-氧化和酮体的形成,可能通过噬脂作用分解甘油释放脂肪酸和降解载脂蛋白B来调控极低密度脂蛋白的水平[11]。Atg7基因敲除的小鼠饲喂高脂肪的食物,甘油三酯和胆固醇的含量明显升高,表明自噬功能失调可以促进肝脏脂肪变性[41]。同时肝细胞老化也是自噬水平降低原因之一,有研究指出,老化虽然不能加剧脂肪变性,但是却能使肝细胞损伤增加[42]。相反,肥胖小鼠肝脏中ATG7的过表达可以降低ER应激,提高对葡萄糖耐受性和胰岛素敏感性[7]。可以看出,自噬在调节肝脏脂肪代谢中发挥着重要作用,自噬紊乱会引起肝细胞脂肪变性,进而影响肝再生,最终导致肥胖症和糖尿病等疾病的发生[12]。但是自噬在肥胖和胰岛素抵抗等方面的机制非常复杂,最近Kim等[43]却发现,饮食诱导的小鼠肥胖模型中,自噬缺陷引起的线粒体功能障碍,会促进成纤维细胞生长因子-21(Fgf21)表达增加,造成小鼠脂肪总量减少,脂肪酸ß-氧化和白色脂肪组织的褐变增加,使其对胰岛素的抵抗性下降,体重和脂肪含量减少。可能的原因是肝星状细胞(HSC)在活化过程中通过噬脂作用使脂滴减少,而HSC 的活化被认为是肝纤维化形成的关键环节[44]。
5 化学品/药物损伤之后的肝再生与自噬
大多数的化学品/药物都在肝脏中代谢,因此肝脏成为其损伤的主要靶器官。目前对其损伤之后的肝再生与自噬的研究还处于初级阶段。体外和体内实验已经证实,在四氯化碳(CCl4)和硫代乙酰胺(TTA)肝损伤过程中,肝脏中发生明显的自噬:LC3-II增加,p62减少,自噬流形成以及大量自噬小体出现,同时伴随着HSC激活,通过3-甲基腺嘌呤(3-MA)处理或干扰Atg5 或Atg7抑制自噬可以有效地减少HSC的活化和肝纤维化的形成[45]。He等[46]也发现经羟氯喹(CQ)处理后,自噬受到抑制的同时,促纤维化因子α-平滑肌肌动蛋白(α-SMA)和 转化生长因子(TGF-β1)的基因表达发生下调。这些都说明自噬参与了HSC活化,促进了肝脏纤维化的形成。但却有研究指出,卡马西平激活的自噬,可以减少纤维蛋白原存储疾病中的肝脏损伤[47]。Jung等[48]进一步研究发现,在CC14损伤的肝脏注射绒毛膜来源的间充质细胞(CP-MSCs)后,坏死和凋亡减少,CP-MSCs通过增强自噬上调缺氧诱导因子1α(HIF-1α)的表达,促进肝再生。在伴刀豆球蛋白A(Con-A)和脂多糖/D-半乳糖胺引起的急性肝损伤中同样发现自噬具有双重作用。两种物质都能引起小鼠肝脏自噬上调。Con-A诱导的肝炎主要有两种方式:T细胞依赖性和T细胞非依赖性。前者引起肝细胞凋亡,后者导致肝细胞自噬性死亡[49]。除了肝细胞,Con-A也能引起小鼠肝脏内皮细胞自噬性死亡[50]。但脂多糖/ D-半乳糖胺诱导的肝脏自噬主要起保护肝脏作用。研究表明,野生型和孕烷X受体敲除小鼠在注射脂多糖/ D-半乳糖胺后自噬迅速上调。但是这种自噬的上调在后者只是瞬时的,随后迅速下降。肝脏损伤表现为丙氨酸转氨酶、肝细胞凋亡坏死和出血性肝损伤增加[51]。因此对于自噬在化学性肝损伤之后再生中的作用目前还有争议,需要进一步研究。
对药物引起肝损伤与自噬的关系研究主要集中于乙酰氨基酚(APAP)和依法韦仑(Efavirenz)。APAP是一种临床上常用的解热镇痛药,过量使用会消耗肝中大量的GSH,同时产物N-乙酰对苯醌亚胺与肝细胞的线粒体和蛋白质结合,导致线粒体损伤和肝细胞坏死。研究发现,APAP引起的自噬可以清除受损的线粒体,用3-MA或氯喹抑制自噬会加速APAP引起的坏死,自噬诱导剂雷帕霉素却能减轻肝损伤[52]。Igusa等[53]也指出,诱导型Atg7缺陷的小鼠对APAP的敏感性增强,服用APAP后,ROS增加,线粒体损伤加剧。这进一步表明自噬在APAP引起的肝损伤中起保护作用。但有研究却指出,Atg5缺陷小鼠对过量APAP耐受性增强[54],原因可能是持续的自噬丢失造成p62增加,Nrf2激活,负反馈作用使抗氧化蛋白和解毒酶活化(NQO1、GCLC和GCLM等),提高了肝脏的抵抗力[55]。依法韦仑作为非核苷逆转录酶抑制物,是一种抵抗艾滋病毒的特效药物,也具有肝毒性。临床使用时能引起干扰肝脏中正常的线粒体功能,此时肝脏中的自噬增强发挥保护作用。研究表明,抑制自噬能增强依法韦仑引起的细胞死亡。在更高剂量时依法韦仑却抑制自噬流的形成,最终引起肝细胞死亡[56]。
6 病毒感染后的肝再生与自噬
除了降解细胞内受损的细胞器和集聚的蛋白质,自噬还通过异体自噬(Xenophagy)等方式参与清除细胞内的病毒、细菌和寄生虫等,激活机体免疫反应[57]。但另一方面,一些嗜肝病毒如乙肝病毒(HBV)和丙肝病毒(HCV)也能通过自噬促进病毒的复制和逃避免疫应答反应。研究表明,病毒蛋白HBx通过增强BECN1:Vps34复合物的活性来促进自噬体的形成[36]。携带HBV的转基因小鼠在自然感染的条件下自噬增强,编码HBV多功能蛋白X基因(HBx)通过激活BECN1[58]和PtdIns3K[59]来增加自噬小体的数量。通过3-MA或siRNA抑制自噬,会导致HBV DNA复制减少,说明自噬增强有利用HBV存活[60]。最近有研究表明HBV感染可促进肝再生早期IL-6的大量分泌,同时STAT3磷酸化、SOCS3转录产物聚集、细胞外信号调节激酶(ERK1/2)磷酸化减少,抑制肝再生[61]。但自噬是否通过上述途径来影响肝再生过程还有待于深入研究。
HCV也能通过诱导自噬体形成来促进病毒复制,但同时会阻碍自噬晚期蛋白的降解和自噬流的形成。HCV这种复杂的调控机制目前仍未阐明,但可以明确的是,通过抑制BECN1、Atg4B、Atg5和Atg12等形成自噬体的关键基因的表达会明显减少HCV mRNA的复制和转录[60]。研究表明, HCV感染的细胞通过药理学方法抑制自噬会增强干扰素α的抗病毒效应[62]。Chandra等[63]进一步指出,HCV复制过程中诱导的自噬反应会抑制IFN-α受体1的功能,破坏STAT 磷酸化和核转位,沉默ATG7或应用羟氯喹会增强IFN-α和利巴韦林的抗病毒效应。以上研究表明,降低感染细胞的自噬水平有可能作为一种新策略来治疗丙型肝炎。
7 结语与展望
肝脏是重要的代谢和解毒器官,在维持机体动态平衡等方面发挥着重要作用。肝再生是一个极其复杂的过程,受到一系列复杂而精密的调控。综上所述,在物理性、酒精、食源性等因素损伤后引起的肝再生中,肝脏通过启动自噬来提供再生必需的ATP,清除受损的细胞器,集聚的蛋白质,抗感染免疫等。诱导自噬作为一种有效的促进肝再生的方式来促进肝脏结构和生理机能的尽快恢复。但需要注意的是,在研究中要考虑机体丧失自噬时的补偿效应[64],因为自噬本身就是存在于机体的一种正常反应,在生理上和进化上具有高度的保守性;在化学性/药物损伤的肝再生模型中,自噬在肝再生中的作用仍然有争议。可能的原因是:一方面这种肝再生模型存在难于将实验进行标准化,而且重现性不好的缺点[65];另一方面,自噬的作用具有双重性。研究表明,当保护性的自噬反应超出细胞阈值时,过度的自噬反而会破坏细胞结构和功能的完整性,造成自噬性死亡[66]。因此在分析化学品/药物损伤的肝再生与自噬的关系时,动物种类、肝脏对各种化学品/药物的耐受性、肝脏补偿机制可能是造成自噬在其中的功能差异的重要因素。在病毒感染之后的肝再生中,一些嗜肝病毒等反而利用自噬来促进病毒颗粒复制,抑制肝再生。适当降低肝脏自噬水平有可能作为治疗病毒性肝炎的一种新的方法。对自噬和肝再生机制的研究,将有助于进一步理解再生过程,为治疗肝脏疾病提供新方法。
[1] Riehle KJ, Dan YY, Campbell JS, Fausto N. New concepts in liver regeneration. J Gastroenterol Hepatol, 2011,26(Suppl. 1): 203-212.
[2] Diehl AM, Chute J. Underlying potential: cellular and molecular determinants of adult liver repair. J Clin Invest,2013, 123(5): 1858-1860.
[3] Lin T, Ibrahim W, Peng CY, Finegold MJ, Tsai RYL. A novel role of nucleostemin in maintaining the genome integrity of dividing hepatocytes during mouse liver development and regeneration. Hepatology, 2013, 58(6):2176-2187.
[4] Haga S, Ozaki M, Inoue H, Okamoto Y, Ogawa W, Takeda K,Akira S, Todo S. The survival pathways phosphatidylinositol-3 kinase(PI3-K)/phosphoinositide -dependent protein kinase 1(PDK1)/Akt modulate liver regeneration through hepatocyte size rather than proliferation. Hepatology, 2009, 49(1):204-214.
[5] 杨永华, 包勇, 姜小筱. 自噬与肿瘤防治新策略. 中国药理学与毒理学杂志, 2015, 29(2): 179-190.
[6] Zhu JJ, Lu TF, Yue S, Shen XD, Gao F, Busuttil RW,Kupiec-Weglinski JW, Xia Q, Zhai Y. Rapamycin protection of livers from ischemia and reperfusion injury is dependent on both autophagy induction and mammalian target of rapamycin complex 2-Akt activation. Transplantation, 2015, 99(1): 48-55.
[7] Xie F, Jia L, Lin MH, Shi Y, Yin JM, Liu Y, Chen DX,Meng QH. ASPP2 attenuates triglycerides to protect against hepatocyte injury by reducing autophagy in a cell and mouse model of non-alcoholic fatty liver disease. J Cell Mol Med, 2015, 19(1): 155-164.
[8] Williams JA, Ni HM, Haynes A, Manley S, Li Y, Jaeschke H,Ding WX. Chronic deletion and acute knockdown of parkin have differential responses to acetaminophen-induced mitophagy and liver injury in mice. J Biol Chem, 2015,290(17): 10934-10946.
[9] Lan SH, Wu SY, Zuchini R, Lin XZ, Su IJ, Tsai TF, Lin YJ, Wu CT, Liu HS. Autophagy suppresses tumorigenesis of hepatitis B virus-associated hepatocellular carcinoma through degradation of microRNA-224. Hepatology,2014, 59(2): 505-517.
[10] Hamasaki M, Furuta N, Matsuda A, Nezu A, Yamamoto A,Fujita N, Oomori H, Noda T, Haraguchi T, Hiraoka Y,Amano A, Yoshimori T. Autophagosomes form at ER-mitochondria contact sites. Nature, 2013, 495(7441):389-393.
[11] Codogno P, Meijer AJ. Autophagy in the liver. J Hepatol,2013, 59(2): 389-391.
[12] Czaja MJ, Ding WX, Donohue TM, Friedman SL, Kim JS,Komatsu M, Lemasters JJ, Lemoine A, Lin JD, Ou JJ,Perlmutter DH, Randall G, Ray RB, Tsung A, Yin XM. Functions of autophagy in normal and diseased liver. Autophagy, 2013, 9(8): 1131-1158.
[13] Levine B, Mizushima N, Virgin HW. Autophagy in immunity and inflammation. Nature, 2011, 469(7330):323-335.
[14] Komatsu M. Liver autophagy: physiology and pathology. J Biochem, 2012, 152(1): 5-15.
[15] Czaja MJ. Functions of autophagy in hepatic and pancreatic physiology and disease. Gastroenterology,2011, 140(7): 1895-1908.
[16] Michalopoulos GK. Liver regeneration after partial hepatectomy: critical analysis of mechanistic dilemmas. Am J Pathol, 2010, 176(1): 2-13.
[17] Merlen G, Gentric G, Celton-Morizur S, Foretz M,Guidotti JE, Fauveau V, Leclerc J, Viollet B, Desdouets C. AMPKα1 controls hepatocyte proliferation independently of energy balance by regulating Cyclin A2 expression. J Hepatol, 2014, 60(1): 152-159.
[18] Lehmann K, Tschuor C, Rickenbacher A, Jang JH,Oberkofler CE, Tschopp O, Schultze SM, Raptis DA,Weber A, Graf R, Humar B, Clavien PA. Liver failure after extended hepatectomy in mice is mediated by a p21-dependent barrier to liver regeneration. Gastroenterology, 2012, 143(6): 1609-1619.
[19] Hu W, Nevzorova YA, Haas U, Moro N, Sicinski P, Geng Y, Barbacid M, Trautwein C, Liedtke C. Concurrent Deletion of cyclin E1 and cyclin-dependent kinase 2 in hepatocytes inhibits DNA replication and liver regeneration in mice. Hepatology, 2014, 59(2): 651-660.
[20] Lin CW, Mo LR, Chen YS, Chen YJ, Kuo PL, Yu ML. Enhanced autophagy promotes liver regeneration and hepatocyte proliferation after partial hepatectomy in mouse liver. Hepatology, 2013, 58: 469A-470A.
[21] 王棋文, 靳伟, 常翠芳, 徐存拴. 基于IPA分析自噬对大鼠肝再生中树突状细胞的调节作用. 遗传, 2015,37(3): 276-282.
[22] Yoshimoto S, Loo TM, Atarashi K, Kanda H, Sato S,Oyadomari S, Iwakura Y, Oshima K, Morita H, Hattori M,Honda K, Ishikawa Y, Hara E, Ohtani N. Obesity-induced gut microbial metabolite promotes liver cancer through senescence secretome. Nature, 2013, 499(7456): 97-101.
[23] Wood MJ, Gadd VL, Powell LW, Ramm GA, Clouston AD. Ductular reaction in hereditary hemochromatosis: the link between hepatocyte senescence and fibrosis progression. Hepatology, 2014, 59(3): 848-857.
[24] Baker DJ, Sedivy JM. Probing the depths of cellular senescence. J Cell Biol, 2013, 202(1): 11-13.
[25] Toshima T, Shirabe K, Fukuhara T, Ikegami T, Yoshizumi T, Soejima Y, Ikeda T, Okano S, Maehara Y. Suppression of autophagy during liver regeneration impairs energy charge and hepatocyte senescence in mice. Hepatology, 2014, 60(1): 290-300.
[26] Fouraschen SMG, de Ruiter PE, Kwekkeboom J, de Bruin RWF, Kazemier G, Metselaar HJ, Tilanus HW, van der Laan LJW, de Jonge J. mTOR signaling in liver regeneration: Rapamycin combined with growth factor treatment. World J Transplant, 2013, 3(3): 36-47.
[27] Alers S, Löffler AS, Wesselborg S, Stork B. Role of AMPK-mTOR-Ulk1/2 in the regulation of autophagy: cross talk, shortcuts, and feedbacks. Mol Cell Biol, 2012, 32(1):2-11.
[28] Sun K, Xie XQ, Liu Y, Han ZP, Zhao X, Cai N, Zhang SS,Song JR, Wei LX. Autophagy lessens ischemic liver injury by reducing oxidative damage. Cell Biosci, 2013,3(1): 26.
[29] Wang JH, Ahn IS, Fischer TD, Byeon JI, Dunn WA Jr,Behrns KE, Leeuwenburgh C, Kim JS. Autophagy suppresses age-dependent ischemia and reperfusion injury in livers of mice. Gastroenterology, 2011, 141(6):2188-2199.
[30] Domart MC, Esposti DD, Sebagh M, Olaya N, Harper F,Pierron G, Franc B, Tanabe KK, Debuire B, Azoulay D,Brenner C, Lemoine A. Concurrent induction of necrosis,apoptosis, and autophagy in ischemic preconditioned human livers formerly treated by chemotherapy. J Hepatol,2009, 51(5): 881-889.
[31] Kim JS, Wang JH, Lemasters JJ. Mitochondrial permeability transition in rat hepatocytes after anoxia/ reoxygenation: role of Ca2+-dependent mitochondrial formation of reactive oxygen species. Am J Physiol-Gastrointest Liver Physiol, 2012, 302(7): G723-G731.
[32] Zakhari S, Li TK. Determinants of alcohol use and abuse:impact of quantity and frequency patterns on liver disease. Hepatology, 2007, 46(6): 2032-2039.
[33] 赵晓彪, 明玉玲, 陈平. 肝切除术后肝脏再生的研究进展. 解放军医学杂志, 2014, 39(1): 70-74.
[34] Wu DF, Wang XD, Zhou R, Yang LL, Cederbaum AI. Alcohol steatosis and cytotoxicity: the role of cytochrome P4502E1 and autophagy. Free Radical Biol Med,2012, 53(6): 1346-1357.
[35] Harada M, Hanada S, Toivola DM, Ghori N, Omary MB. Autophagy activation by rapamycin eliminates mouse Mallory-Denk bodies and blocks their proteasome inhibitor-mediated formation. Hepatology, 2008, 47(6):2026-2035.
[36] Rautou PE, Mansouri A, Lebrec D, Durand F, Valla D,Moreau R. Autophagy in liver diseases. J Hepatol,2010, 53(6): 1123-1134.
[37] Gammoh N, Wilkinson S. Autophagy in cancer biology and therapy. Frontiers Biol, 2014, 9(1): 35-50.
[38] Kim J, Kim YC, Fang C, Russell RC, Kim JH, Fan W, Liu R, Zhong Q, Guan KL. Differential regulation of distinct Vps34 complexes by AMPK in nutrient stress and autophagy. Cell, 2013, 152(1-2): 290-303.
[39] Sydor S, Gu YL, Schlattjan M, Bechmann LP, Rauen U,Best J, Paul A, Baba HA, Sowa JP, Gerken G, Canbay A. Steatosis does not impair liver regeneration after partial hepatectomy. Lab Invest, 2013, 93(1): 20-30.
[40] Kele PG, van der Jagt EJ, Gouw ASH, Lisman T, Porte RJ,de Boer MT. The impact of hepatic steatosis on liver regeneration after partial hepatectomy. Liver Int, 2013,33(3): 469-475.
[41] Yang L, Li P, Fu SN, Calay ES, Hotamisligil GS. Defective hepatic autophagy in obesity promotes ER stress and causes insulin resistance. Cell Metab, 2010,11(6): 467-478.
[42] Fontana L, Zhao EP, Amir M, Dong HQ, Tanaka K, Czaja MJ. Aging promotes the development of diet-induced murine steatohepatitis but not steatosis. Hepatology,2013, 57(3): 995-1004.
[43] Kim KH, Jeong YT, Oh H, Kim SH, Cho JM, Kim YN,Kim SS, Kim DH, Hur KY, Kim HK, Ko T, Han J, Kim HL, Kim J, Back SH, Komatsu M, Chen H, Chan DC,Konishi M, Itoh N, Choi CS, Lee MS. Autophagy deficiency leads to protection from obesity and insulin resistance by inducing Fgf21 as a mitokine. Nat Med 2013,19(1): 83-92.
[44] Hernández-Gea V, Ghiassi-Nejad Z, Rozenfeld R, Gordon R, Fiel MI, Yue ZY, Czaja MJ, Friedman SL. Autophagy releases lipid that promotes fibrogenesis by activated hepatic stellate cells in mice and in human tissues. Gastroenterology, 2012, 142(4): 938-946.
[45] Thoen LFR, Guimarães ELM, Dollé L, Mannaerts I,Najimi M, Sokal E, van Grunsven LA. A role for autophagy during hepatic stellate cell activation. J Hepatol, 2011, 55(6): 1353-1360.
[46] He W, Wang B, Yang J, Zhuang Y, Wang LZ, Huang XD,Chen JP. Chloroquine improved carbon tetrachlorideinduced liver fibrosis through its inhibition of the activation of hepatic stellate cells: role of autophagy. Biol Pharm Bull, 2014, 37(9): 1505-1509.
[47] Puls F, Goldschmidt I, Bantel H, Agne C, Bröcker V,Dämmrich M, Lehmann U, Berrang J, Pfister ED, Kreipe HH, Baumann U. Autophagy-enhancing drug carbamazepine diminishes hepatocellular death in fibrinogen storage disease. J Hepatol, 2013, 59(3): 626-630.
[48] Jung J, Choi JH, Lee Y, Park JW, Oh IH, Hwang SG, Kim KS, Kim GJ. Human placenta-derived mesenchymal stem cells promote hepatic regeneration in CCl4 -injured rat liver model via increased autophagic mechanism. Stem Cells, 2013, 31(8): 1584-1596.
[49] Chang CP, Lei HY. Autophagy induction in T cell-independent acute hepatitis induced by concanavalin A in SCID/NOD mice. Int J Immunopathol Pharmacol,2008, 21(4): 817-826.
[50] Yang MC, Chang CP, Lei HY. Endothelial cells are damaged by autophagic induction before hepatocytes in Con A-induced acute hepatitis. Int Immunol, 2010, 22(8):661-670.
[51] Wang K, Damjanov I, Wan YJY. The protective role of pregnane X receptor in lipopolysaccharide/D- galactosamineinduced acute liver injury. Lab Invest, 2010, 90(2):257-265.
[52] Ni HM, Bockus A, Boggess N, Jaeschke H, Ding WX. Activation of autophagy protects against acetaminopheninduced hepatotoxicity. Hepatology, 2012, 55(1): 222-232.
[53] Igusa Y, Yamashina S, Izumi K, Inami Y, Fukada H,Komatsu M, Tanaka K, Ikejima K, Watanabe S. Loss of autophagy promotes murine acetaminophen hepatotoxicity. J Gastroenterol, 2012, 47(4): 433-443.
[54] Ni HM, Boggess N, McGill MR, Lebofsky M, Borude P,Apte U, Jaeschke H, Ding WX. Liver-specific loss of Atg5 causes persistent activation of Nrf2 and protects against acetaminophen-induced liver injury. Toxicol Sci,2012, 127(2): 438-450.
[55] Komatsu M, Kurokawa H, Waguri S, Taguchi K,Kobayashi A, Ichimura Y, Sou YS, Ueno I, Sakamoto A,Tong KI, Kim M, Nishito Y, Iemura S, Natsume T, Ueno T,Kominami E, Motohashi H, Tanaka K, Yamamoto M. The selective autophagy substrate p62 activates the stress responsive transcription factor Nrf2 through inactivation of Keap1. Nat Cell Biol, 2010, 12(3): 213-223.
[56] Apostolova N, Gomez-Sucerquia LJ, Gortat A, Blas-Garcia A, Esplugues JV. Compromising mitochondrial function with the antiretroviral drug efavirenz induces cell survival-promoting autophagy. Hepatology, 2011, 54(3):1009-1019.
[57] Manzanillo PS, Ayres JS, Watson RO, Collins AC, Souza G, Rae CS, Schneider DS, Nakamura K, Shiloh MU, Cox JS. The ubiquitin ligase parkin mediates resistance to intracellular pathogens. Nature 2013, 501(7468): 512-516.
[58] Tang H, Da L, Mao Y, Li Y, Li D, Xu ZH, Li F, Wang YF,Tiollais P, Li T, Zhao MJ. Hepatitis B virus X protein sensitizes cells to starvation-induced autophagy viaup-regulation of beclin 1 expression. Hepatology, 2009,49(1): 60-71.
[59] Sir D, Ann DK, Ou JJ. Autophagy by hepatitis B virus and for hepatitis B virus. Autophagy, 2010, 6(4): 548-549.
[60] Gracia-Sancho J, Guixé-Muntet S, Hide D, Bosch J. Modulation of autophagy for the treatment of liver diseases. Expert Opin Inv Drugs, 2014, 23(7): 965-977.
[61] Quétier I, Brezillon N, Duriez M, Massinet H, Giang E,Ahodantin J, Lamant C, Brunelle MN, Soussan P,Kremsdorf D. Hepatitis B virus HBx protein impairs liver regeneration through enhanced expression of IL-6 in transgenic mice. J Hepatol, 2013, 59(2): 285-291.
[62] Mizui T, Yamashina S, Tanida I, Takei Y, Ueno T,Sakamoto N, Ikejima K, Kitamura T, Enomoto N, Sakai T,Kominami E, Watanabe S. Inhibition of hepatitis C virus replication by chloroquine targeting virus-associated autophagy. J Gastroenterol, 2010, 45(2): 195-203.
[63] Chandra PK, Bao LL, Song K, Aboulnasr FM, Baker DP,Shores N, Wimley WC, Liu SH, Hagedorn CH, Fuchs SY,Wu T, Balart LA, Dash S. HCV infection selectively impairs type I but not type III IFN signaling. Am J Pathol,2014, 184(1): 214-229.
[64] Ni HM, Jaeschke H, Ding WX. Targeting autophagy for drug-induced hepatotoxicity. Autophagy, 2012, 8(4): 709-710.
[65] 鲁艳平. HGF、ERK/MAPK、ESM和CNTF信号通路在大鼠肝再生中对肝细胞分化的调节作用研究[学位论文]. 河南师范大学, 2013.
[66] Shen HM, Codogno P. Autophagic cell death: Loch Ness monster or endangered species? Autophagy, 2011, 7(5):457-465.
(责任编委: 陈雁)
Effect of autophagy on liver regeneration
Qiwen Wang1,2,3, Cuifang Chang1,2,3, Ningning Gu1,2,3, Cuiyun Pan1,2,3, Cunshuan Xu1,2,3
1. State Key Laboratory Cultivation Base for Cell Differentiation Regulation, College of Life Science, Henan Normal University, Xinxiang 453007, China;
2. Henan Bioengineering Key Laboratory, Henan Normal University, Xinxiang 453007, China;
3. Henan Engineering Laboratory for Bioengineering and Drug Development, Henan Normal University, Xinxiang 453007, China
Autophagy is a lysosome-mediated degradation pathway, which plays an important role in hepatic physiological and pathological processes, in eukaryotic cells. The liver has a remarkable regenerative capacity. After acute or chronic injury, the residual hepatic cells can be activated to enter the cell-cycle for proliferation, in order to compensate for lost liver tissue and recover liver function. In this review, we summarize the relationship between liver regeneration (LR) after various types of injury and autophagy. For example, autophagy is activated to accelerate LR after physically, alcohol and food borne induced liver injury, while the role of autophagy in animal models of LR after chemical injury remains controversial. Autophagy can also be used to promote the replication of virus particles by some hepatotropic viruses (e.g., HBV,HCV) and inhibit LR after viral infection. Studies on mechanisms of autophagy and LR will contribute to clarify the rege-nerative process and provide new methods for the treatment of liver disease.
liver regeneration; autophagy; liver function; liver injury
2015-04-16;
2015-07-24
国家重点基础研究发展计划(973计划)前期研究专项(编号:2012CB722304),河南省重大科技攻关项目(编号:111100910600),河南省高等学校重点科研项目计划(编号:15A180007),河南师范大学青年科学基金项目(编号:2014QK29)和河南师范大学博士科研启动费支持课题(编号:qd14175)资助
王棋文,博士研究生,讲师,研究方向:肝再生的分子机理。Tel: 0373-3325654; E-mail: wangqiwen123@hotmail.com
徐存拴,博士,教授,博士生导师,研究方向:肝再生的分子机理。E-mail: xucs@x263.net
10.16288/j.yczz.15-162
网络出版时间: 2015-8-715:18:37
URL: http://www.cnki.net/kcms/detail/11.1913.R.20150807.1518.004.html

