溴量法测定银杏黄酮的研究
许小英,李梦耀,马岚,张敏,同禄禄
(1.长安大学 环境科学与工程学院,陕西 西安 710054;2.旱区地下水文与生态效应教育部重点实验室(长安大学),陕西 西安 710054)
黄酮类化合物具有扩张血管、抑制血小板活化因子、抗氧化、调血脂和抗肿瘤等药理作用[1-2]。近年来,银杏叶黄酮的提取和测定方法研究十分活跃[3]。银杏黄酮的测定方法主要有紫外分光光度法[4]、荧光光度法[5]、高效液相色谱法[6]、薄层扫描法[7]、毛细管电泳法等[8]。本文依据银杏黄酮的性质和结构的特点,建立并采用溴量法对黄酮类化合物的含量进行测定,该方法具有较高的准确度和精确度,操作方法简单、快捷、经济,适合于测定天然产物提取液中黄酮的含量。
1 实验部分
1.1 材料与仪器
黄酮标准(芦丁)、溴酸钾、溴化钾、碘化钾、硫代硫酸钠等均为分析纯;重铬酸钾,优级纯;蒸馏水;银杏树叶(金黄色,洗净,阴干)。
AL204 电子天平;101-2AB 电热鼓风干燥箱;THZ-82 恒温振荡器。
1.2 黄酮标准液的配制
准确称取黄酮标准品0.664 6 g,加入少量乙醇微热至完全溶解,转移到200 mL 的容量瓶中,冷却到室温后,蒸馏水定容至刻度,即得到5 mmol/L 的黄酮标准贮备液。
1.3 测定原理
银杏叶中所含的黄酮类化合物主要是黄酮醇苷类成分[9-10],其分子结构含有酚羟基,在一定条件下,可与溴分子发生亲电取代反应,只要能够确定与一分子黄酮起反应的溴分子数,就可用溴量法测定黄酮的含量。
测定原理用反应方程式表示如下:
Br2的生成 5KBr+KBrO3+6HCl→3Br2+3H2O+6KCl
取代 黄酮 +zBr2→取代产物+zHBr
滴定 Br2(剩余)+ 2KI →I2+ 2KBr

平行进行空白实验,确定加入溴的总量,用黄酮标准作为样品进行实验,计算反应系数z。

式中 z——与1 分子黄酮进行反应的Br2分子数;

1.4 测定方法
准确移取黄酮标准液(或银杏黄酮提取液)10.00 mL 于250 mL 碘量瓶中,加入0.05 mol/L 的溴试剂10.00 mL,微开瓶塞,加入6 mol/L 的盐酸3.00 mL,立即盖上瓶塞,用少量蒸馏水封口,稍微振荡,置于暗处30 min。微开瓶塞,加入10%的碘化钾5.0 mL,立即盖上瓶塞,摇匀放置5 min。加氯仿2 mL,轻轻振荡,使沉淀溶解。用硫代硫酸钠标准溶液进行滴定,当溶液颜色变为浅黄色时,加入2 mL淀粉指示剂,滴定直至溶液蓝色褪去,即为滴定终点。平行进行空白实验。按下式计算银杏提取液中黄酮的浓度。
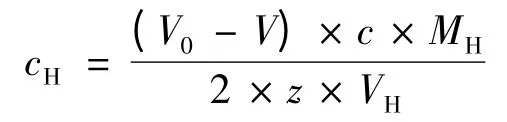
式中 cH——样品溶液中银杏黄酮的浓度,mg/L;

2 结果与讨论
2.1 黄酮与Br2反应系数的确定
2.1.1 反应时间 保持溶液的酸度不变,加入溴的物质量为黄酮的7 倍,考察反应时间对反应系数的影响,结果见表1。
由表1 可知,反应时间对反应系数的影响不大,但是反应时间短,反应不完全;而反应时间较长时,溴又易挥发,不利于反应系数的测定,综合考虑,选择30 min 作为最佳反应时间。
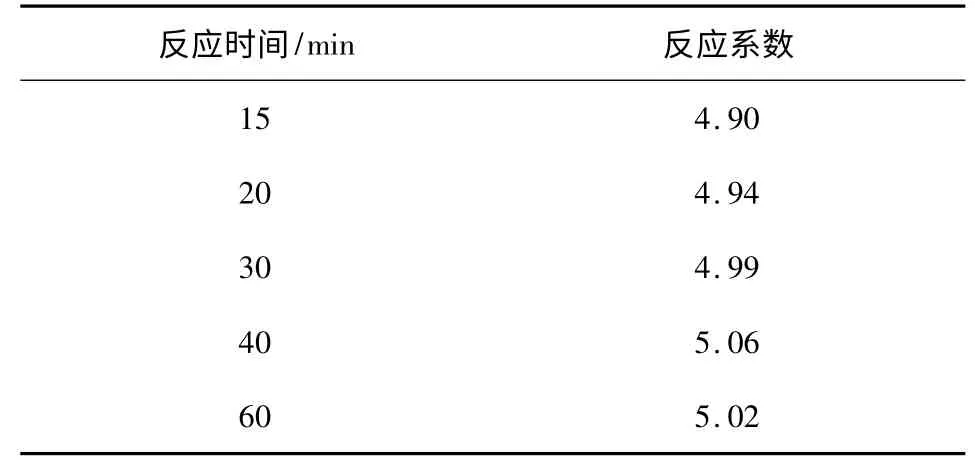
表1 反应时间对反应系数的影响Table 1 The impact of reaction time on reaction coeffient
2.1.2 盐酸用量 其他因素不变,反应时间为30 min 时,考察6 mol/L 盐酸用量对反应系数的影响,结果见表2。
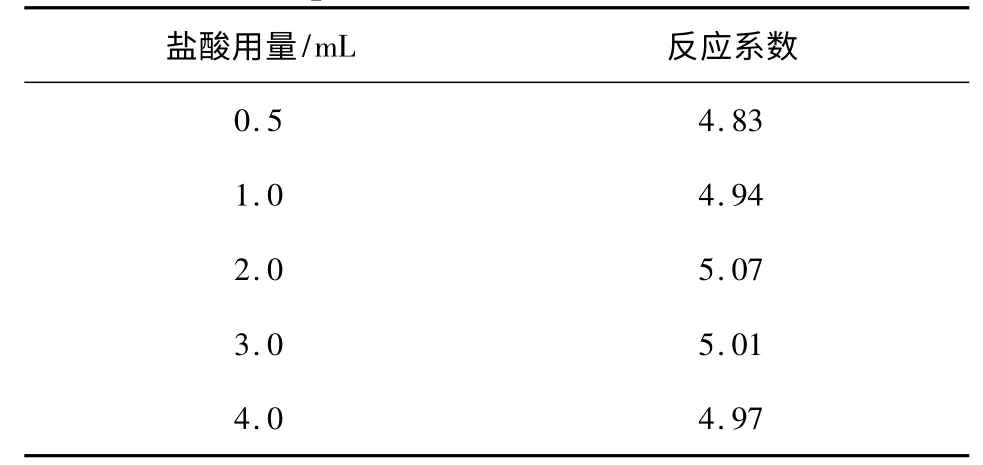
表2 盐酸用量对反应系数的影响Table 2 The impact of HCl amount on reaction coeffient
由表2 可知,盐酸用量对反应系数的影响不显著。但加入盐酸量较少时,使溴产生的不完全,影响反应系数的测定,选择加入的酸量为3.0 mL。
2.1.3 溴试剂用量 由表3 可知,在保证溴过量的情况下,溴试剂的量对反应系数没有显著影响,但溴试剂的加入量也不宜过多。通常情况下,溴过量20%即可,取n(Br2)∶n(黄酮)=5∶1。
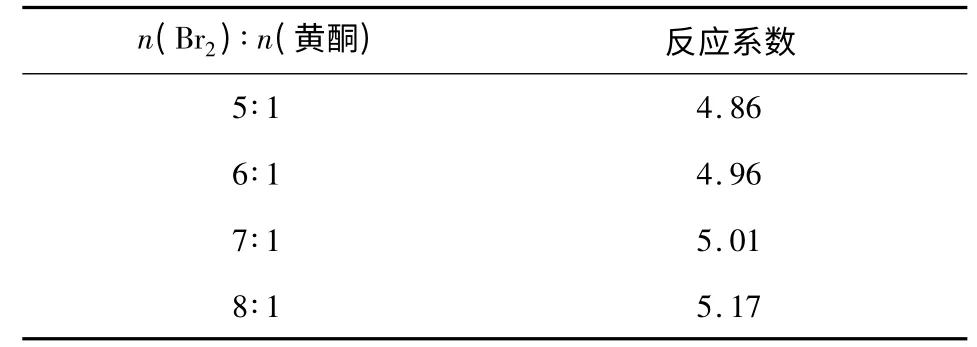
表3 溴试剂用量对反应系数的影响Table 3 The impact of bromine reagent amounton reaction coeffient
2.2 样品分析
准确称取10 g 干的银杏叶于250 mL 圆底烧瓶中,加入60 mL 95%乙醇,在恒温水浴锅中,60 ℃下回流90 min,倾倒出滤液。重复上述步骤3 次,合并4 次提取液,取上清液测定银杏黄酮的含量,结果见表4。
由表4 可知,10 次测定同一银杏黄酮提取液,黄酮的平均浓度为1.674 g/L,各次测定数值接近,说明溴量法测定银杏黄酮提取液重现性较好。
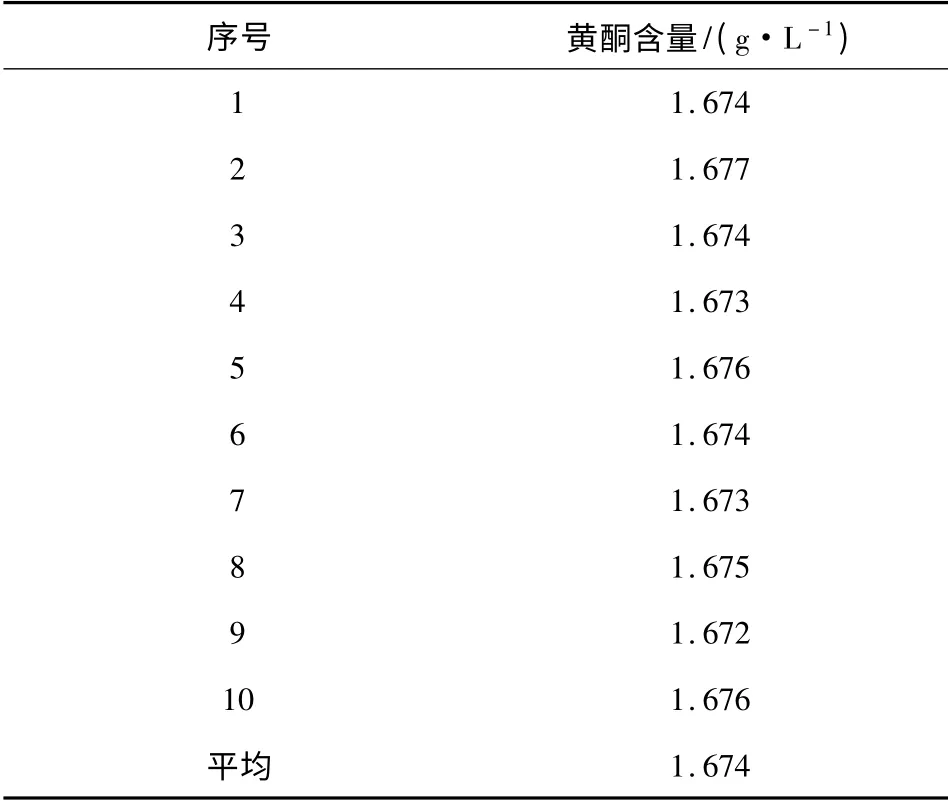
表4 银杏黄酮样品含量测定结果Table 4 The content measurement results of Ginkgo biloba extract sample
2.3 精密度
实验数据的精密度分析结果见表5。

表5 银杏黄酮标准品精密度分析结果Table 5 The accuracy analysis results of Ginkgo biloba extract standard sample
由表5 可知,对提取液1 和提取液2,10 次测定标准偏差都较小,说明测定方法具有良好的可信度。
2.4 准确度
对样品进行加标回收实验,结果见表6。
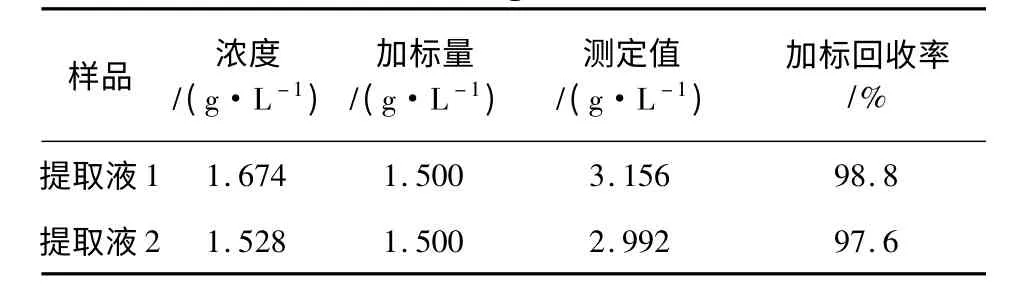
表6 银杏黄酮加标回收率测定结果Table 6 The add mark recovery rate measurement results of Ginkgo biloba extract
由表6 可知,溴量法测定银杏黄酮提取液的加标回收率为97. 6% ~98. 8%,该方法较为准确,可靠。
3 结论
(1)依据黄酮可以和溴分子发生亲电取代反应,建立了一种溴量法测定黄酮的新方法,实验测得1 分子黄酮与5 分子溴反应亲电取代反应,溴与黄酮反应系数比为5∶1。
(2)溴量法测定1.674 g/L 银杏黄酮提取液,10次测定的标准偏差为6.48 ×10-5,加标回收率为97.6%,98.8%,方法准确、可靠,适用于天然植物提取液中黄酮的测定。
[1] Xiong X J,Liu W,Yang X C.Ginkgo biloba extract for essential hypertension:A systemic review[J]. Phytomedicine,2014(21):1131-1136.
[2] Cook N C,Samman S.Flavonoids-Chemistry,metabolism,cardioprotective-effects,and dietary sources[J]. Nutritional Biochemistry,1996,7(2):66-76.
[3] 吕帮玉,杨新河,毛清黎. 银杏叶黄酮提取与测定研究进展[J].河北农业科技,2007,11(3):91-95.
[4] 潘见,骆祥峰,王国霞.紫外分光光度法测银杏黄酮苷含量误差分析[J]. 合肥工业大学学报:自然科学版,2000,23(4):464-467.
[5] 张敏,邱朝晖,曹庸,等. Al3+-芦丁二元络合物荧光光度法测定银杏叶中总黄酮的含量[J].分析科学学报,2005,21(2):188-190.
[6] 王靖,邹雨佳,唐华澄,等.高效液相色谱法(HPLC)测定银杏黄酮含量[J]. 食品工业科技,2006(3):184-186.
[7] 郭雪峰,岳永德.黄酮类化合物的提取、分离纯化和含量测定方法的研究进展[J]. 安徽农业科学,2007,35(26):8083-8086.
[8] 陆敏,张文娜.银杏叶中黄酮类化合物的提取、纯化及测定方法的研究进展[J]. 理化检验-化学分册,2012,45(5):616-620.
[9] 王成章,林祥. 银杏叶中黄酮类化合物及其分析方法[J].林产化学与工业,1996,18(1):83-88.
[10]胡卫兵,瞿万云,吴遵义,等. 银杏叶中总黄酮含量的库仑滴定法[J].化工科技,2003,11(1):42-44.

