新生儿常见致聋基因突变位点的大样本筛查分析
孙雪晶,席作明,张 静,刘保彦,黄 鑫,周 林,赵 青
(聊城市产前诊断中心 东昌府区妇幼保健院检验中心,山东 聊城 252000)
新生儿常见致聋基因突变位点的大样本筛查分析
孙雪晶,席作明,张静,刘保彦,黄鑫,周林,赵青
(聊城市产前诊断中心 东昌府区妇幼保健院检验中心,山东 聊城 252000)
[摘要]目的探讨新生儿常见聋病易感基因突变位点分布情况,为临床干预奠定基础。方法采用实时荧光聚合酶链反应(PCR)技术对11 121例新生儿进行常见聋病易感基因突变位点筛查,筛查位点为我国常见的3个致聋基因GJB2(c.235 del C、c.299-300 del AT)、线粒体DNA 12S rRNA(c.1494 C>T、c.1555 A>C)和SLC26A4 (c.2168 A>G、c.IVS7-2 A>G)的6个突变位点;基因突变者进行测序验证及听力诊断。结果11 121例新生儿中发生耳聋基因突变者517例,其中纯合突变39例、杂合突变469例、单基因复合杂合突变2例,双基因复合杂合突变7例,阳性率4.65%。基因突变包括:GJB2突变286例(包括2例c.235 del C杂合突变复合c.299-300 del AT杂合突变);线粒体DNA 12S rRNA 基因突变189例;SLC26A4基因突变35例;双基因复合杂合突变7例,男婴耳聋基因突变阳性率显著高于女婴(χ2=8.653,P<0.01)。测序结果与PCR结果一致,517例基因突变新生儿中13例发生听力损伤,其中轻度6例,中度3例,极重度4例。结论GJB2基因的 c.235 del C位点突变率最高,其次为SLC26A4基因的 c.IVS7-2A>G位点,线粒体DNA 12S rRNA 基因的c.1494C>T位点突变极低,不属于本地区的致聋热点基因,且男女婴之间突变阳性率存在显著差异,为该地区耳聋基因筛查方向提供了重要依据。
[关键词]耳聋基因;突变;新生儿;筛查;大样本
新生儿听力损失是较常见的出生缺陷之一,先天性耳聋在新生儿期的发病率约为1‰~3‰,是由多种环境和/或遗传因素共同作用导致[1-2]。先天性听力损失严重地影响儿童言语、认知和情感的发育,而它的早发现、早诊断、早治疗则是避免因聋致哑、促进患儿发育的有效措施。随着分子生物学和遗传学研究的逐渐深入,与耳聋相关的遗传性易感基因GJB2、线粒体DNA 12S rRNA和SLC26A4基因逐渐被确立[3]。新生儿聋病易感基因检测可明确部分遗传性耳聋的发病原因,并为耳聋的早期诊断、干预和预防提供重要依据。为此,本研究选取中国人群中最常见的3个致聋基因GJB2、线粒体DNA 12S rRNA和SLC26A4的6个位点对2014年在本院出生的11 121例新生儿进行检测,为临床干预提供循证决策数据。
1资料和方法
1.1研究对象
2014年1月至12月,本院出生的11 121例新生儿(来自聊城市区和辖区8个县市),其中男婴5 892例,女婴5 088例,男女比率为1.16:1。
1.2血样采集
在家长知情同意的原则上,填写新生儿信息卡,并签署耳聋基因筛查知情同意书,在新生儿出生后3~7d,严格按照采血规范采集新生儿足跟血100μL至新生儿遗传筛查采样卡,在通风环境中自然晾干。
1.3DNA提取
取直径约为3mm血片于1.5mL无菌EP管中,加双蒸水500μL,室温放置5min,期间震荡2~3次,12 000r/min,相对离心力为17 600g,离心1min,弃上清;重复上述步骤至血片无色,加入200μL DNA提取液(提取液应充分混匀,使颗粒悬浮)。100℃水浴8min,取出震荡15~30s,12 000r/min,相对离心力为17 600g,离心5min。取上清用于检测。DNA提取液由济南英盛生物技术有限公司提供。
1.4耳聋基因突变位点筛查
1.4.1检测位点
选取中国常见热点致聋基因GJB2基因c.235 del C、c.299-300 del AT位点、线粒体DNA 12S rRNA c.1494C>T、c.1555A>C位点和SLC26A4基因的c.2168A>G、c.IVS7-2A>G位点进行检测。
1.4.2检测方法
根据耳聋基因检测试剂盒(济南英盛生物技术有限公司)要求,采用荧光聚合酶链反应(PCR)法进行基因突变位点筛查,具体步骤:将PCR反应液室温下完全解冻、混匀、瞬时离心后分装入PCR反应管中,每管13μL反应液,再加入2μL待测DNA模板,在实时荧光定量PCR分析仪(美国ABI-vii7)上进行扩增。按标准操作流程设置PCR参数,并设定FAM、VIC通道进行检测。每批次试验均设定阴阳质控以保证结果的准确性。
1.4.3结果判读
PCR扩增结束后,根据试验调节扩增曲线基线和阈值,并转换为“线性函数linear”,查看仪器自动读取的Ct值,结合FAV通道、HEX通道的扩增曲线来判断实验的有效性并判断实验结果,扩增曲线为“S”型,且Ct值<35,表示阳性;扩增曲线为“S”型,且Ct值>35表示阴性,HEX通道的扩增曲线为阳性时表示突变。检测结果用“野生型”、“纯合突变”和“杂合突变”表示,当FAV和HEX通道曲线均为阴性时,实验判断无效。突变类型曲线见图1。
纯合突然

杂合突变

野生型
图1 不同突变类型曲线
1.5基因测序
对所有阳性结果所有上述PCR阳性检测结果均用DNA测序方法(仪器型号:ABI3500)进行了验证。
1.6听力诊断
对所有耳聋基因阳性者,采用听性脑干反应、多频稳态诱发电位(ASSR)、声导抗测听(AIA)、畸变产物耳声发射(DPOAE)、听性行为测试及耳科检查,部分小儿行颞骨CT扫描等方法,进行听力诊断,综合评估听力情况。根据国际卫生组织(WHO-1997)判断标准将听力损失分为轻度、中度、重度和极重度四级。
1.7统计学方法
采用SPSS 16.0进行统计分析,组间计数资料比较采用χ2检验,检验水准α为0.05。
2结果
2.1耳聋基因检测结果分析
11 121例新生儿中含有耳聋基因突变者517例,总突变率为4.65%,其中GJB2突变286例(包括2例c.235 del C杂合突变复合c.299-300 del AT杂合突变)、线粒体DNA 12S rRNA基因突变189例、SLC26A4基因突变35例。另外,还检测出双基因的复合杂合突变7例,见表1。
2.2耳聋基因突变在男、女婴儿间的分布频率比较分析
在11 121例新生儿中,男婴5 892人,女婴5 088人,男婴耳聋基因突变阳性为289人,阳性率为4.90%,女婴耳聋基因突变191例,突变阳性率为3.75%,男婴耳聋基因突变阳性率显著高于女婴(P<0.01)。GJB2基因c.235 del C位点及SLC26A4基因在男婴中的分布频率显著高于女婴(P<0.05),见表2。
表111 121例耳聋基因筛查各基因位点的突变例数及突变频率
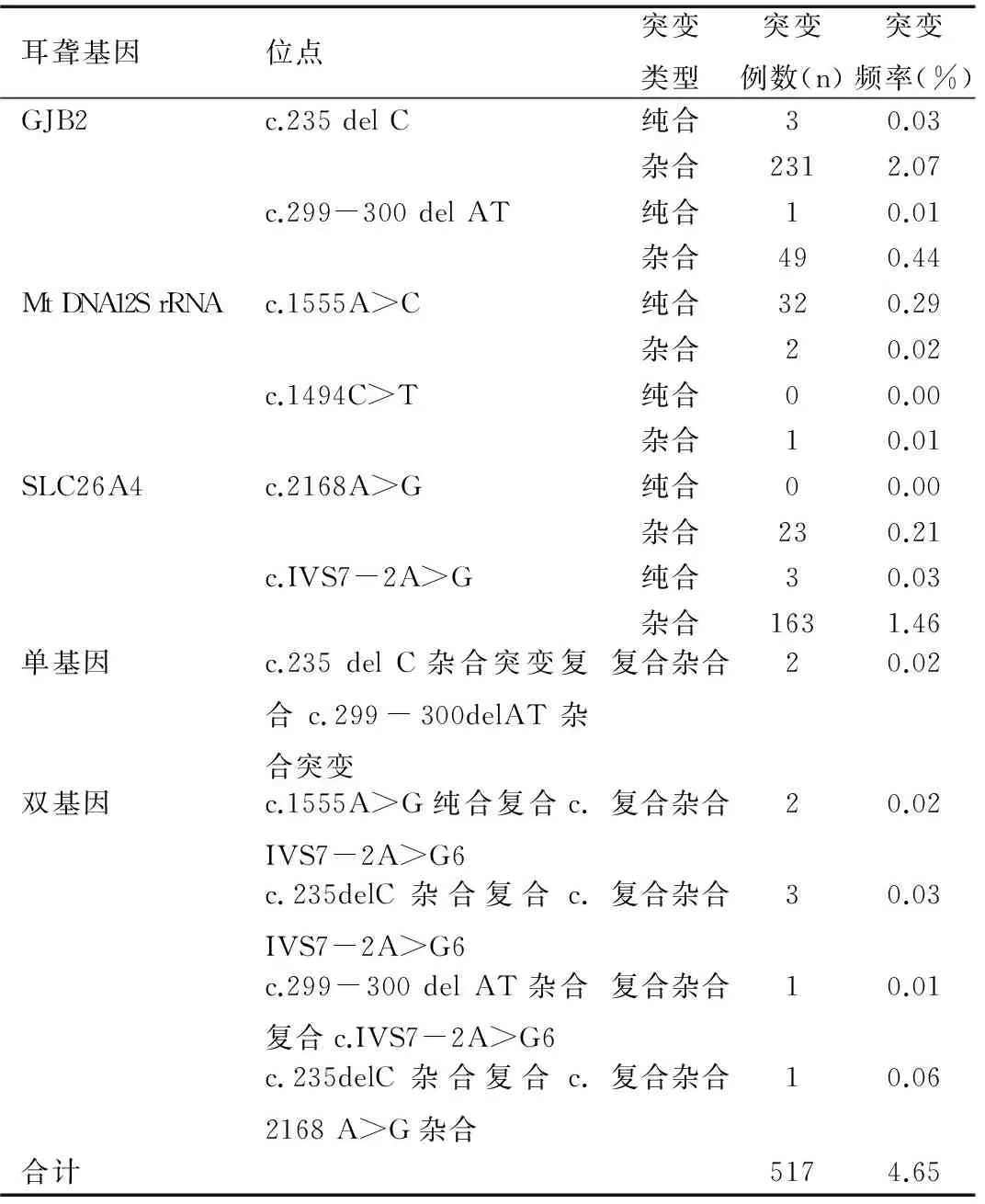
Table 1 The number and frequency of mutational sites at deafness-related genes in 11 121 cases of neonates
表2耳聋基因不同突变位点在男女中的突变频率
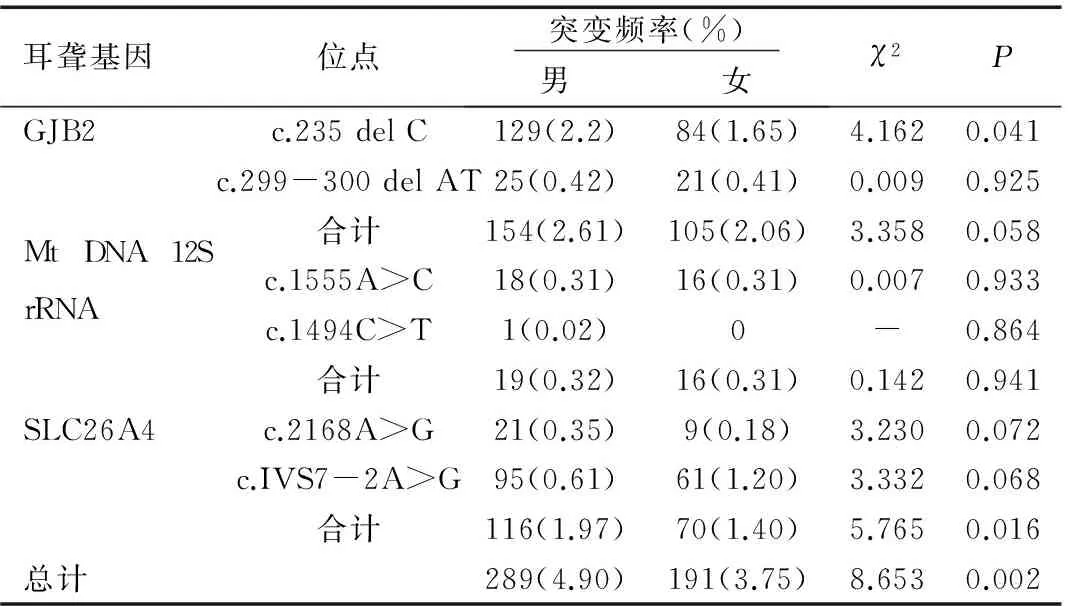
Table 2 The mutation frequency of different genetic mutational sites at deafness-related genes in female and male neonates
2.3听力损失新生儿基因型与临床表型分析
通过听力诊断,517例基因突变新生儿中发现有13例听力损伤,其中轻度6例,中度3例,极重度4例。听力损失新生儿的基因型与临床表型见表3。
表3听力损失新生儿的基因型和临床表型分析

Table 3 Analysis of genotype and clinical phenotype in neonates suffering from hearing loss
3讨论
我国每年通过新生儿听力筛查发现的听障儿童约为3万,但实际每年新增的耳聋患者有5~6万,漏筛的耳聋患者主要是迟发性耳聋和药物性耳聋。先天性耳聋可由不同的等位基因或基因座突变所引起,具有明显的异质性,不同的基因突变导致的耳聋临床表型具有多样性,所有的遗传和环境因素致聋在同一种族或不同种族之间会有极大的差异[4-5]。本实验通过对聊城地区大样本新生儿常见聋病易感基因的检测探讨该地区耳聋基因突变情况,给临床指导和干预奠定基础。
3.1聊城地区常见热点耳聋基因携带类型及突变频率
聊城地区11 121例新生儿耳聋基因突变率为4.65%,与北京市2012年耳聋基因筛查阳性率4.48%相似[6],高于国内其他文献报道2.87%~3.94%的阳性率[7-8]。其中,突变率最高的是GJB2基因的c.235 del C位点(2.10%),占耳聋基因突变总人数的45.3%(234/517),其次为SLC26A4基因的c.IVS7-2A>G位点(1.49%),占突变总人数的32.1%(166/517),两基因位点占突变总人数的77.4%。然而,线粒体DNA 12S rRNA基因的c.1494C>T位点仅检出1例杂合突变,在新生儿筛查群体中的携带率仅为0.01%,说明聊城地区新生儿中该位点突变极少,不属于本地区的致聋热点基因,其余位点均有不同程度的检出率。这对聊城地区耳聋基因的普遍筛查具有较大的指导意义。
3.2耳聋基因不同突变位点在男婴、女婴中的突变频率
在11 121例新生儿中,男婴耳聋热点基因突变阳性为289人,阳性率为4.90%,女婴耳聋基因突变191例,突变阳性率为3.75%,男婴耳聋热点基因突变总阳性率显著高于女婴(P<0.01)。其中GJB2基因c.235 del C位点及SLC26A4基因在男婴中的分布频率显著高于女婴(P<0.05),其它基因位点在男婴和女婴的阳性突变率无显著差异。
3.3听力损失新生儿基因型与临床表型的相关性及临床指导意义
GJB2基因突变导致的耳聋临床表型多样,可表现为先天性耳聋和迟发性耳聋,纯合突变患者多数表现为重度或极重度耳聋。发病年龄可从新生儿至成人,本研究发现GJB2基因突变者284例,占耳聋基因总突变的54.9%(284/517),与文献报道GJB2基因突变是我国非综合征性感音神经性耳聋的主要致病基因一致[8]。该研究中GJB2基因的纯合突变、复合杂合突变、杂合突变均诊断出不同临床表型的的先天性耳聋患者,其中,3例c.235 del C位点纯合突变患者均为重度听力障碍,目前2例已佩戴助听器,1例已进行人工耳蜗移植;1例c.299-300 del AT纯合突变和1例GJB2单基因复合杂合突变者(c.235 del C杂合复合c.299-300 del AT杂合突变)诊断为中度耳聋,已佩戴助听器;1例GJB2基因的c.235 del C位点杂合新生儿诊断为轻度耳聋,测序结果未发现该基因其他位点的复合突变,通过追踪随访,目前暂未发现其他导致先天性听力障碍的非遗传因素。本中心已告知家长密切注意孩子听力情况并定期复查,并将进一步跟踪该例婴儿的听力损失发展情况。GJB2基因的c.235 del C位点杂合突变的新生儿患者提示单基因杂合突变也是可能发生耳聋,应列为高危人群定期监测听力情况,避免迟发性耳聋。检测出的279例GJB2基因杂合突变者,将来生育时如果配偶也为GJB2基因杂合突变携带者,下一代将有1/4的概率为先天性耳聋,有1/2的概率为携带者。通过婚育指导和产前检测,可有效预防和避免聋儿的出生。
SLC26A4(PDS)基因是大前庭导水管综合征的密切相关基因,研究显示97.9%的大前庭导水管扩大患者具有SLC26A4基因突变[6]。SLC26A4基因突变者可能会造成先天性耳聋、渐进性耳聋,或因头部外伤、剧烈运动等因素导致的听力下降,临床表型多样。患儿必须定期检查,对听力下降者给予早期干预和治疗,可取得理想的效果。该研究检测出189例SLC26A4基因突变,基因突变率为1.70%,占基因突变者的36.6%(189/517),仅次于GJB2基因的突变率。其中,3例c.IVS7-2A>G纯合突变均诊断为中、重度耳聋,2例c.IVS7-2A>G杂合突变诊断为轻度耳聋,颞骨CT结果均显示有大前庭导水管的扩大,可能发展为重度感音神经性耳聋。已告知家长严格防止头部外伤、倒立,尽量避免感冒,禁止参加剧烈运动,预防进行性听力损失。SLC26A4基因突变者后代的遗传规律与GJB2基因突变者相同。
线粒体DNA(mtDNA)是氨基糖苷类抗生素所致的药物性耳聋的高度易感基因,其遗传方式为母系遗传,临床表型亦具有多样性。该基因突变的引起的耳聋表型受种族背景、环境因素、氨基糖苷类用药史、突变一致性等多种因素影响,致病性与个体对氨基糖苷类药物的敏感性相关,但基因突变不接触氨基糖苷类抗生素也会出现感音神经性耳聋。本研究中检出的35例该基因突变者,虽然目前未发现听力异常,但是如果使用氨基糖苷类药物就有可能造成突发性耳聋。本中心对所有Mt DNA 12S rRNA基因突变者给与"禁用氨基糖苷类抗生素等耳毒性药物"提示卡片,并告知其母系亲属亦应禁用耳毒性药物,以避免耳聋的发生。
研究还发现了1例c.235 del C杂合复合c.IVS7-2 A>G6杂合突变者为轻度听力损失,提示双基因杂合突变也会有发生迟发性耳聋的几率,同样需要定期听力检查。本中心将对所有携带耳聋基因突变的新生儿进行行为指导和用药提示以及远期的婚配指导,并定期进行随访,了解听力情况,以避免和减少迟发性耳聋的发生和子代聋儿的出生。
综上所述,在国内常见耳聋基因位点中,GJB2基因的c.235 del C位点、SLC26A4基因的c.IVS7-2A>G位点为本地区重点突变基因,而线粒体DNA 12S rRNA基因的c.1494C>T位点突变极低,为该地区耳聋基因筛查方向提供了重要依据。新生儿耳聋基因筛查可以对先天性耳聋患者或高危儿进行日常行为指导和临床干预,避免迟发性耳聋的发生具有十分重要的意义。
[参考文献]
[1]Driscoll C J,McPherson B.Newborn screening systems,the complete perspective[M]San Diego:Plural Pub,2010.
[2]Najmabadi H,Kahrizi K.Genetics of non-syndromic hearing loss in the Middle East[J].Int J Pediatr Otorhinolaryngol,2014,78(12):2026-2036.
[3]陆洋,孙晓勉.新生儿听力及耳聋基因联合筛查研究进展[J].中国妇幼健康研究,2015,26(5):1088-1091.
[4]韩德民.新生儿听力及耳聋基因联合筛查[J].中国医学文摘-耳鼻咽喉科学,2012,27(6):290-292.
[5]De Keulenaer S,Hellemans J, Lefever S,etal.Molecular diagnostics for congenital hearing loss including 15 deafness genes using a next generation sequencing platform[J].BMC Med Genomics,2012,5:17.
[6]韩冰,李倩,纵亮,等.新生儿听力及基因联合筛查临床实践及筛查模式研究[J]. 中华耳科学杂志,2013,11(3):380-383.
[7]刘俊秀,马芙蓉,马新春,等.北京市8200例和西宁市1940例新生儿听力筛查结果对比分析[J].听力学及言语疾病杂志,2012,20(5):413-416.
[8]吕康模,熊业华,俞皓,等.17 000名新生儿遗传性耳聋基因突变筛查[J].中华医学遗传学杂志,2014,31(5):547-552.
[专业责任编辑:周熙慧]
[收稿日期]2015-11-25
[基金项目]山东省医药卫生科技发展计划面上资助项目(2014WS0051);聊城市医学科研立项项目
[作者简介]孙雪晶(1981-),女,主管检验师,主要从事分子生物学、遗传学相关研究。
[通讯作者]赵青,副主任护师。
doi:10.3969/j.issn.1673-5293.2016.04.030
[中图分类号]R764.4
[文献标识码]A
[文章编号]1673-5293(2016)04-0506-04
Analysis of large sample screening for mutational sites at common deafness-related gene in neonates
SUN Xue-jing, XI Zuo-ming, ZHANG Jing, LIU Bao-yan, HUANG Xin, ZHOU Lin, ZHAO Qing
(Liaocheng Prenatal Diagnosis Center, Test Center of Maternal and Child Health Institute of Dongchangfu District,Shangdong Liaocheng 252000, China)
[Abstract]Objective To investigate the distribution of mutational sites of common deafness-related susceptibility genes in neonates so as to lay a foundation for clinical interventions. Methods A total of 11 121 cases of neonates were screened for mutational sites of deafness-related susceptibility genes by using real-time fluorescence quantitative polymerasechain reaction technology. Screened sites were six mutational sites at three common deafness-related genes in China. Those genes were GJB2 (c.235 del C, c.299-300 del AT), mtDNA 12S rRNA (c.1494 C>T, c.1555 A>C) and SLC26A4 (c.2168 A>G, c.IVS7-2 A>G). Gene sequencing and hearing diagnosis were performed for individuals with mutant genes. Results Among 11 121 neonates, 517 cases were deafness-related mutant gene carriers, including 39 cases of homozygous mutations, 469 cases of heterozygous mutations, 2 cases of single-gene compound heterozygous mutations and 7 cases of double-gene compound heterozygous mutations. The positive rate was 4.65%. Among 517 cases of genetic mutations, 286 cases of GJB2 mutations (including 2 cases of compound heterozygous mutations of c.235 del C and c.299-300 del AT), 189 cases of mtDNA 12S rRNA gene mutations, 35 cases of SLC26A4 gene mutations and 7 cases of double-gene compound heterozygous mutations were included. The positive rate of deafness-related genetic mutations in females neonates was higher than that in males (χ2=8.653, P<0.01). The results of gene sequencing were consistent with PCR results. Among 517 cases of neonates with genetic mutations, 13 cases suffered from hearing impairment, including 6 mild cases, 3 moderate cases, and 4 extremely severe cases. Conclusion The mutation rate reaches its peak at the mutation site c.235 del C of gene GJB2, followed by c.IVS7-2A>G of gene SLC26A4. However, the mutation rate is extremely low at the mutation site c.1494C>T of mtDNA 12S rRNA, indicating that it is not a hot-spot deafness-related gene in this area. In addition, there is significant difference in positive rate of mutation between female and male neonates. The preceding results have provided important evidences for directing the screening of deafness-related genes in this area.
[Key words]deafness-related gene; mutation; neonates; screening; large sample
【出生缺陷预防】

