β-半乳糖苷酶催化乳糖合成低聚半乳糖
李美玲,江波,张涛(食品科学与技术国家重点实验室,江南大学,江苏无锡214122)
β-半乳糖苷酶催化乳糖合成低聚半乳糖
李美玲,江波*,张涛
(食品科学与技术国家重点实验室,江南大学,江苏无锡214122)
通过对环状芽孢杆菌B.circulans SK28.003的发酵获得β-半乳糖苷酶酶液,经过浓缩、盐析沉淀和低温冷冻干燥,制备酶粉。利用β-半乳糖苷酶的转糖苷功能催化乳糖合成低聚半乳糖(Galactooligosaccharides,GOS),采用单因素和正交试验优化,通过高效液相色谱法检测,以GOS产率为评价指标,确定最佳合成条件为:乳糖起始质量浓度为50 g/dL,加酶量为6 U/g,反应温度为60℃,pH 7.5。在此条件下反应12 h,GOS产率可达45.5%。
β-半乳糖苷酶;低聚半乳糖;转糖苷功能;条件优化;正交试验
益生元作为一种促进健康的食品成分,近年来受到越来越多的关注[1]。大部分益生元是非消化性的寡糖,其中低聚半乳糖(GOS)已被证实能够发挥益生的作用[2]。GOS是母乳中天然含有的益生元,大量临床试验表明,它能够改善肠道菌群,提高免疫系统,具有降低血脂,增强抗肿瘤、抗衰老的功能[3-4]。GOS具有轻微的甜味,约为蔗糖甜味的30%~60%,同时GOS不会被胰酶和胃液消化,从而具有更低的GI(血糖生成指数)值,热量只有蔗糖的一半[5]。GOS因为其具有上述诸多健康益处而成为功能性食品领域的关注焦点[6]。
GOS含有2~10个半乳糖单元和一个终端葡萄糖单元,之间主要由β-(1→4)-或β-(1→6)键连接而成[7],化学结构为(Galactose)n-Glucose,n为1—10,如图1所示。
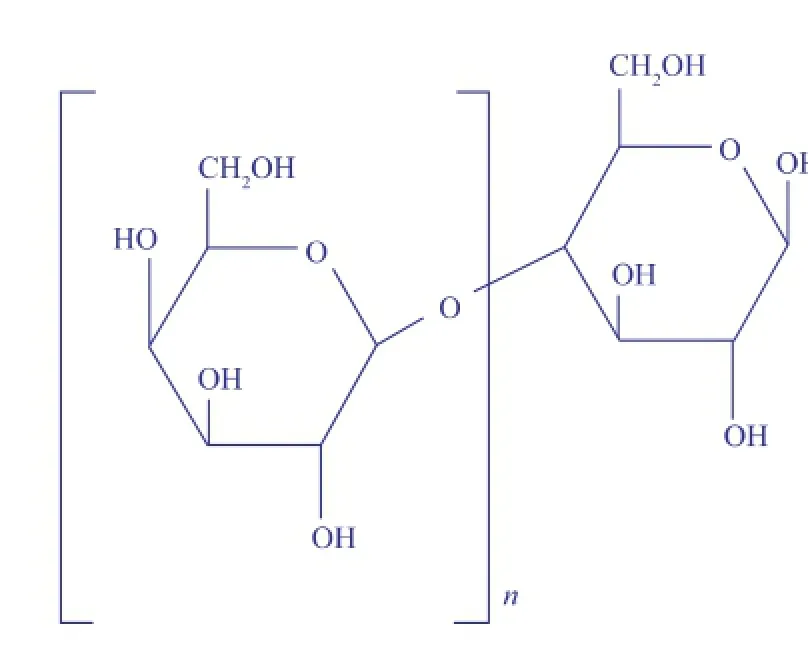
图1 低聚半乳糖结构Fig.1 Structure of galactooligosaccharides
利用酶法合成GOS被认为是最有效的生产途径之一,糖苷酶因其所需反应条件简单、酶来源广泛、价格低廉等优点,在酶法合成中被广泛采用[8]。酶法合成中通常是利用其水解反应的逆反应即转糖基反应获得所需的产物[9]。
工业上β-半乳糖苷酶是一种重要的生物催化剂,具有催化乳糖水解和转糖苷两种功能。传统意义上利用其水解活性来减少食物中的乳糖含量及处理废水[10]。然而,近年来,β-半乳糖苷酶常用作转糖基反应的催化剂,进而合成低聚半乳糖、乳果糖和低聚乳果糖等。
β-半乳糖苷酶可以从多种微生物中得到,例如环状枯草杆菌、米曲霉、黑曲霉、乳酸克鲁维酵母和脆壁氏酵母等,不同来源的酶的转糖基活性不同,生成的GOS产品类型和产量也有显著差异[11]。
本研究中利用环状芽孢杆菌B.circulans SK28.003发酵获得β-半乳糖苷酶酶液,该酶为胞外酶,酶蛋白质主要存在于发酵液,发酵液离心后去掉菌体即可得到酶液。然后利用超滤膜分离技术除去多余的水,不仅酶蛋白液起到浓缩作用,而且提高了单位体积发酵液的酶活力,便于β-半乳糖苷酶浓缩液进行硫酸铵沉淀,以及酶沉淀,进行低温真空冷冻干燥制取酶粉。通过该流程制备得到粗酶粉,有利于β-半乳糖苷酶保藏和后续工艺生产。
文中重点探讨以乳糖为底物,通过β-半乳糖苷酶的转糖苷作用制得GOS,确定了底物质量浓度、加酶量、温度、缓冲液pH值等关键条件对合成工艺的影响,为工业利用β-半乳糖苷酶合成GOS提供了科学依据[12]。
1 材料与方法
1.1材料
1.1.1菌种环状芽孢杆菌B.circulans SK28.003,江南大学食品科学与技术国家重点实验室保藏。
1.1.2主要试剂乳糖、葡萄糖、NaCl、MnSO4·H2O、NaH2PO4、Na2HPO4、NaOH、(NH4)2SO4(均为分析纯),国药集团产品或经销;蛋白胨(鱼粉)、邻硝基苯-β-D-吡喃半乳糖苷(o-nitrophenyl-β-D-galactopyranoside,oNPG)、酵母膏(均为生化试剂),国药集团产品或经销。
1.1.3培养基
1)种子培养基(g/L):葡萄糖20,蛋白胨10,酵母膏10,NaCl 5,MnSO4·H2O 0.005;pH 7.0。
2)发酵培养基(g/L):乳糖10,蛋白胨10,酵母膏10,NaCl 5,MnSO4·H2O 0.005;pH 7.0。
1.1.4主要仪器设备Sartorius stedim发酵罐,德国BIOSTATC Plus公司制造;GL-10MD大容量高速冷冻离心机,湘仪离心机仪器有限公司制造;冷冻干燥机,美国LABCONCO公司制造;Pellicon超滤器,美国Millipore公司制造;恒温水浴锅,江苏亿通仪器设备公司制造;1200型高效液相色谱仪器,美国Agilent公司制造;RI101型示差折光检测器,日本Shodexgo公司制造;DEL320 pH仪器,梅特勒-托利多实验仪器有限公司制造;Alpha-1系列紫外可见光分光光度计,上海谱元仪器有限公司制造。
1.2实验方法
1.2.1酶粉的制备
1)种子培养条件:配制500 mL种子培养基,高温灭菌(121℃,20 min),接种环状芽孢杆菌B. circulans SK28.003,30℃培养24 h,作为种子液。
2)发酵产酶条件:发酵培养基20 L,装入30 L的发酵罐,经高温灭菌(121℃,20 min),冷却至30℃,将种子液接入,在30℃、pH 7.0、0.1 mPa、200 r/min及通气量1 L/(L·min)的条件下发酵80 h。
3)发酵后处理:将发酵液20 L离心(4℃,8 000 r/min,20 min),除去菌体,上清液即为β-半乳糖苷酶。
4)超滤浓缩:将离心后所获上清液超滤浓缩,超滤的发酵液体积为18 L;进口压力为20~25 Psi,循环口压力为5~10 Psi,压力差控制在10 Psi,1 Psi=6.895 kPa;料液温度为25℃。
5)盐析沉淀:采用硫酸铵分级沉淀的方法沉淀超滤浓缩后的酶液,即先在硫酸铵饱和度40%时沉淀除去一部分杂蛋白质,然后继续缓慢添加硫酸铵使体系最终硫酸铵饱和度为60%,充分搅拌均匀,使硫酸铵完全溶解后,在0~4℃条件下静置4 h;收集所得沉淀物,用少量50 mmol/L、pH 7.0的磷酸氢二钠-磷酸二氢钠缓冲液溶解沉淀,并在相同的缓冲液中透析脱盐。
6)冷冻干燥:除盐后的浓缩酶液在-20℃冰箱内预冻4 h后转移至低温冷冻干燥机的物料盘内,冷阱温度-80℃,冷冻干燥24 h制得酶粉,可于4℃冰箱中长期保存。
1.2.2β-半乳糖苷酶酶活力的测定准确称取一定量的邻硝基苯-β-D-吡喃半乳糖苷(o-nitrophenylβ-D-galactopyranoside,oNPG)粉末和自制酶粉,分别用0.1 mol/L、pH 6.5的磷酸氢二钠-磷酸二氢钠缓冲液配制成1 mg/mL的oNPG溶液和1 mg/mL的酶液,取2.0 mL oNPG溶液在60℃保温10 min,然后加入0.5 mL酶液,振荡混匀后在60℃下计时反应15 min,加入2.5 mL浓度0.15 mol/L的Na2CO3溶液终止反应。空白实验对照先加Na2CO3溶液再加酶液,测定420 nm下的吸光度,计算酶活力[13]。酶活力单位定义:在上述检测条件下,每分钟催化oNPG生成1 μmol邻硝基苯酚(o-nitrophenol,oNP)所需要的酶量定义为1个单位酶活(即1 U)。
1.2.3GOS的合成依次改变GOS合成条件中的乳糖起始质量浓度、加酶量、反应温度和pH值,将10 g不同质量浓度的乳糖溶液置于50 mL酶反应器中,加入一定量的β-半乳糖苷酶,置于一定温度的恒温体系中搅拌反应,定时取样分析产物中糖类物质的组成。
1.2.4GOS产率的测定测定方法采用高效液相色谱法(HPLC)。色谱测定条件:Agilent 1260型高效液相色谱-示差折光检测器,色谱柱为Asahipak NH2P-504E,柱温30℃,流动相为V(乙腈)∶V(水)=65∶35,体积流量1.0 mL/min,进样量10 μL。在不同的工艺参数下反应,然后根据各糖类物质在HPLC上的峰面积,用归一化法计算GOS产率(GOS占总糖的面积分数)[14]。
2 结果与讨论
2.1乳糖起始质量浓度对GOS合成的影响
在60℃和加酶量6 U/g的条件下以0.1 mol/L、pH 7.0的磷酸氢二钠-磷酸二氢钠缓冲溶液溶解不同质量浓度的乳糖,考察不同乳糖起始质量浓度对GOS产率的影响。乳糖起始质量浓度是影响GOS合成的重要因素,但在该反应温度下,当乳糖质量浓度大于60 g/dL时,乳糖溶液会有结晶析出,故实验选用20~60 g/dL的起始质量浓度进行研究。
在24 h内每隔一定时间取样测定GOS产率,以GOS产率对时间作图得到图2。β-半乳糖苷酶合成GOS的产率与乳糖起始质量浓度有很大的相关性。当乳糖起始质量浓度为20 g/dL时,反应12 h 后GOS产率达到最大值42.1%。随着乳糖质量浓度的增加,GOS的产率也随之增加,并且达到GOS最高产率所需的时间也延长。当乳糖起始质量浓度提高至50 g/dL时,GOS最高产率提高了8.6%,反应16 h后产率达到45.7%。而当乳糖起始质量浓度增至60 g/dL时,GOS的最高产率明显下降到35.9%,同时反应速率减小。以上现象是因为,当乳糖溶液质量浓度水平较低时,反应体系中水分含量较高,更多的水分子有机会与β-半乳糖苷酶受体结合,从而发生水解反应,影响了GOS的合成;而随着乳糖起始质量浓度的提高,乳糖分子作为β-半乳糖苷酶受体的机会增多,则更容易与酶-半乳糖基复合物结合,发生转糖基反应,生成GOS[15]。然而,当乳糖质量浓度由50 g/dL继续增加至60 g/dL时,GOS的产率反而减小,这可能是因为在高乳糖质量浓度下酶的活性受到抑制,反应体系的黏度增加,不利于传质,同时乳糖有少量析出。综合考虑原料的充分利用以及高质量浓度下乳糖不易溶解和黏度大等因素,选取50 g/dL的乳糖起始质量浓度进行后续的实验。
2.2加酶量对GOS合成的影响
在60℃,以0.1 mol/L、pH 7.0的磷酸氢二钠-磷酸二氢钠缓冲溶液溶解50 g/dL的乳糖,探究不同的β-半乳糖苷酶添加量对GOS合成产率的影响,结果如图3所示。
当加酶量为4 U/g时,反应18 h后GOS产率接近42.2%,并继续呈增加趋势;当加酶量为6 U/g时,反应12 h后GOS产率即达到45.5%;当加酶量提高到8 U/g和10 U/g时,反应10 h达到最高产率,分别为45.1%和45.6%,但随着反应时间的延长,GOS的产率小幅下降,这可能是因为生成的GOS部分又被水解所致。总体来讲,随着β-半乳糖苷酶添加量的增多,GOS的产率也随之提高,并且达到GOS最高产率时所需的时间缩短。因此,加酶量的提高可以促进在更短的时间内生成更多的GOS,但当加酶量超过6 U/g后,GOS的最高产率并没有明显增加。这是因为在反应体系中酶以酶与底物络合物的形式存在,当加酶量较低时,这时酶与底物络合物的质量浓度不高,因此合成GOS的速率较慢,产率较小。随着加酶量的增加,酶与底物络合物的质量浓度增加,合成GOS的产率也增加。而加酶量过高时,由于过剩的酶没有被充分利用,会导致酶浪费,从而在实际生产中造成成本增加。综合考虑时间效益、酶的利用效率以及GOS产率,选用加酶量6 U/g进行后续试验。
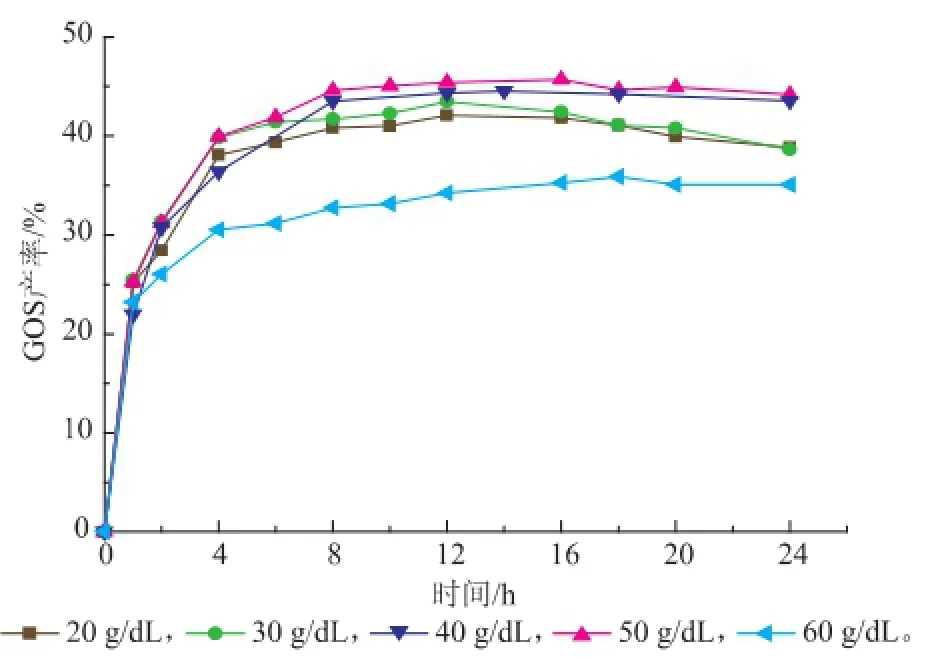
图2 乳糖起始质量浓度对GOS合成的影响Fig.2 Effects of the initial lactose concentrations on GOS synthesis
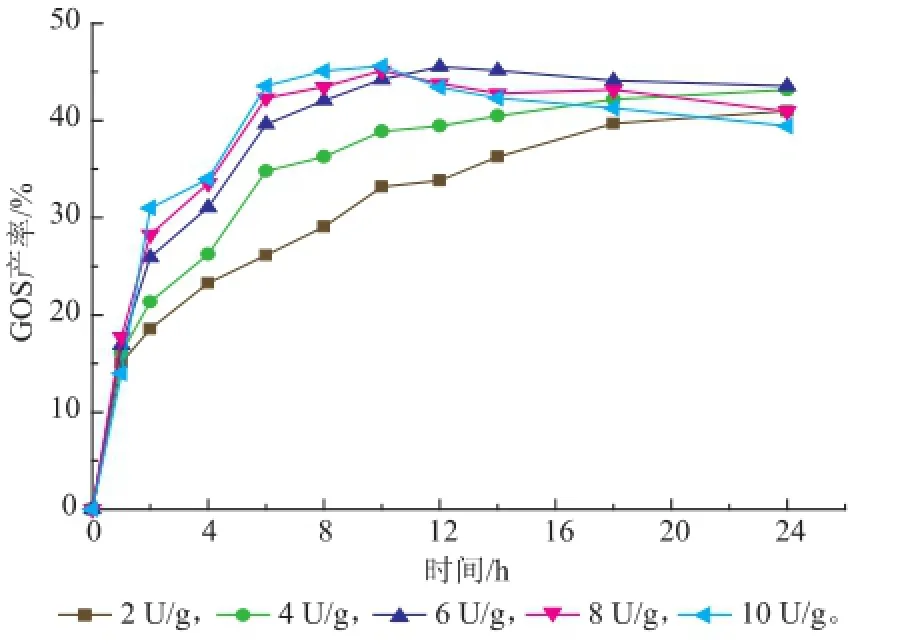
图3 加酶量对GOS合成的影响Fig.3 Effects of the loading amount of β-galactosidase on GOS synthesis
2.3反应温度对GOS合成的影响
在加酶量为6 U/g的条件下以0.1 mol/L、pH 7.0的磷酸氢二钠-磷酸二氢钠缓冲溶液溶解50 g/dL的乳糖,探究不同温度对GOS合成产率的影响,在24 h内每隔一定时间取样测定GOS产率,以GOS产率对时间作图4。
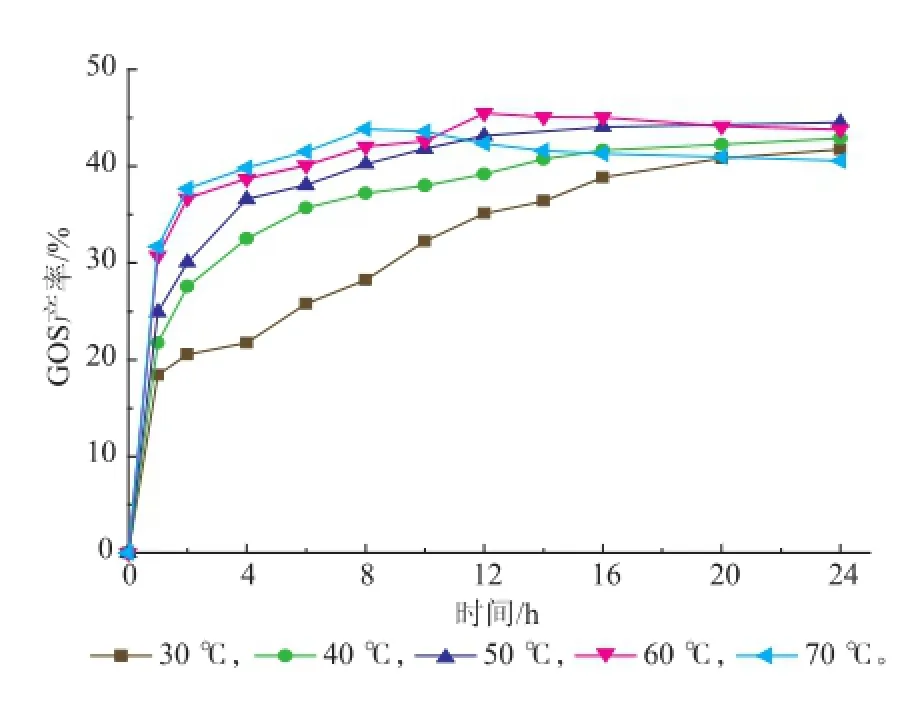
图4 反应温度对GOS合成的影响Fig.4 Effects of temperatures on GOS synthesis
由图4可知,不同温度下达到GOS最高产率所需的时间也不同。温度越高,达到最大值所需的时间越短。当反应温度低于50℃时,反应24 h GOS产率仍未达到最高。在70℃下反应8 h GOS产率达到43.9%,之后不再增加,这是因高温下酶蛋白质变性所致。在60℃,前8 h内,酶反应速率较快,GOS的产率快速增加;8~12 h内,GOS的产率缓慢增加,到第12小时GOS产率达到最大值45.49%,这一过程反应速率开始下降,这与β-半乳糖苷酶的热稳定性有关。在60℃,一开始酶的催化活性较高,但经长时间反应,酶活力会有下降的趋势。因此,在酶不快速失活的前提下,提高反应温度,可以促进反应体系中分子间的相互作用,提高反应速率,从而促进GOS的生成;而且提高温度还能增加底物乳糖的溶解度。综合上述,选取最适温度为60℃。
2.4pH值对GOS合成的影响
在60℃和加酶量6 U/g条件下以0.1 mol/L、不同pH的磷酸氢二钠-磷酸二氢钠缓冲溶液溶解50 g/dL的乳糖,探究不同pH对GOS合成产率的影响。在24 h内每隔一定时间取样测定GOS产率,以GOS产率对pH作图得到图5。
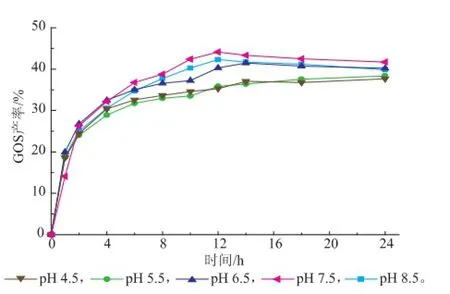
图5 pH对GOS合成的影响Fig.5 Effects of pH values on GOS synthesis
由图5可知,当pH为4.5.和5.5时,反应速率缓慢,且所得GOS产率较低,这是因为在酸性条件下,酶的催化活性降低。在pH 6.5~8.5的范围,反应速率明显加快,最大GOS产率相差不大,可知在此pH区间,β-半乳糖苷酶的活性比较稳定。其中,当pH为7.5时,GOS产率最大。这比之前Song等人[16]报道的最适pH 7.0高0.5个单位,比Hua等人[17]报导的最适pH 8.0低0.5个单位,这可能是因为酶的来源不同,但最适pH区间结论一致。综上所述,确定该反应体系最适pH为7.5。
2.5正交试验
利用正交试验综合考察不同因素和水平对GOS合成的交互影响,选取乳糖起始质量浓度、加酶量、反应温度、pH值,进行四因素三水平的正交试验,以GOS产率为评价指标,结果见表1。
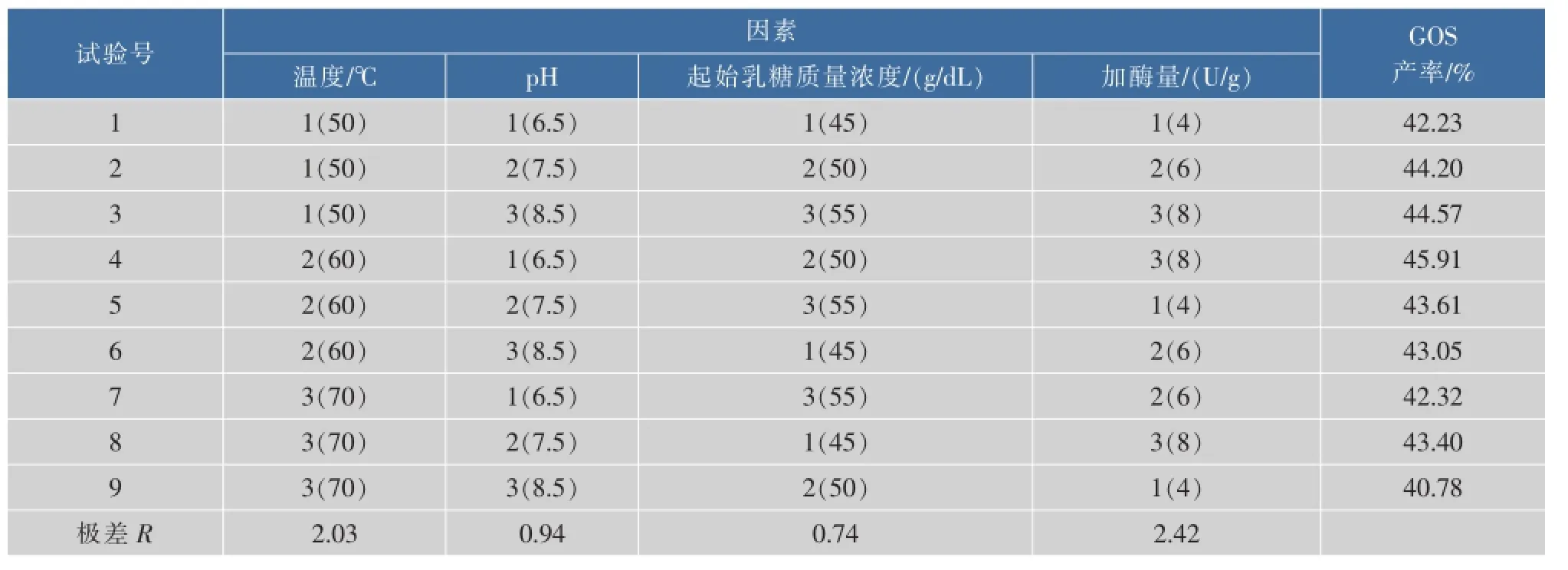
表1 酶反应正交实验设计及结果Table 1 Orthogonal experiment design of β-galactosidase reaction and results
正交试验数据极差R分析结果表明,对GOS产率影响的主次顺序为:加酶量>温度>pH>乳糖起始质量浓度。得到最佳条件:加酶量为8 U/g,反应温度为60℃,pH 6.5,乳糖起始质量浓度为50 g/dL。此时GOS最高产率达45.9%。
比较初步优化和正交优化的结果可以看出,两者的最高GOS产率仅相差0.4%,乳糖起始质量浓度和温度相同,但加酶量和pH不同,原因可能在于4个主要因素的交互作用。从加酶量上初步优化条件优于正交优化条件,更有利于节约成本。
3 结语
以作者所在实验室储藏的环状芽孢杆菌B. circulans SK28.003为酶源菌株发酵产酶,并经过浓缩、盐析沉淀和冷冻干燥制得酶粉。探究起始乳糖质量浓度、加酶量、反应温度、pH值等因素对β-半乳糖苷酶催化乳糖合成GOS的影响,并通过正交实验确定最佳工艺条件:乳糖起始质量浓度为50 g/dL,加酶量为6 U/g,反应温度为60℃,以0.1 mol/L、pH7.5的磷酸氢二钠-磷酸二氢钠缓冲溶液溶解乳糖。在此条件下,GOS产率可达45.5%。
[1]Delzenne N M.Oligosaccharides:state of the art[J].Proceedings of the nutrition Society,2003,62(1):177-182.
[2]Boesten R J,de Vos W M.Interactomics in the human intestine:Lactobacilli and Bifidobacteria make a difference[J].Journal ofClinical Gastroenterology,2008,42:163-167.
[3]Silk D B A,Davis A,Vulevic J,et al.Clinical trial:the effects of a trans-galactooligosaccharide prebiotic on faecal microbiota and symptoms in irritable bowel syndrome[J].Alimentary Pharmacology&Therapeutics,2009,29(5):508-518.
[4]Vulevic J,Juric A,Tzortzis G,et al.A mixture of trans-galactooligosaccharides reduces markers of metabolic syndrome and modulates the fecal microbiota and immune function of overweight adults[J].The Journal of Nutrition,2013,143(3):324-331.
[5]Borra S T,Bouchoux A.Effects of science and the media on consumer perceptions about dietary sugars[J].The Journal of Nutrition,2009,139(6):1214-1218.
[6]Barreteau H,Delattre C,Michaud P.Production of oligosaccharides as promising new food additive generation[J].Food Technology and Biotechnology,2006,44(3):323.
[7]Crittenden R G,Playne M J.Production,properties and applications of food-grade oligosaccharides[J].Trends in Food Science &Technology,1996,7(11):353-361.
[8]Depeint F,Tzortzis G,Vulevic J,et al.Prebiotic evaluation of a novel galactooligosaccharide mixture produced by the enzymatic activity of Bifidobacterium bifidum NCIMB 41171,in healthy humans:a randomized,double-blind,crossover,placebo-controlled intervention study[J].The American Journal of Clinical Nutrition,2008,87(3):785-791.
[9]Otieno D O.Synthesisof β-Galactooligosaccharides from lactose using microbial β-Galactosidases[J].Comprehensive Reviews in Food Science and Food Safety,2010,9(5):471-482.
[10]Chen C S,Hsu C K,Chiang B H.Optimization of the enzymic process for manufacturing low-lactose milk containing oligosaccharides[J].Process Biochemistry,2002,38(5):801-808.
[11]Boon M A,Janssen A E M,Van't Riet K.Effect of temperature and enzyme origin on the enzymatic synthesis of oligosaccharides [J].Enzyme and Microbial Technology,2000,26(2):271-281.
[12]Gosling A,Stevens G W,Barber A R,et al.Recent advances refining galactooligosaccharide production from lactose[J].Food Chemistry,2010,121(2):307-318.
[13]陈真真,张涛,江波,等.低聚半乳糖酶法合成条件的研究[J].食品与发酵工业,2012,38(10):35-39. CHEN Zhenzhen,ZHANG Tao,JIANG Bo,et al.Study on enzymatic synthesis conditions of Galactooligosaccharides[J].Food and Fermentation Industries,2012,38(10):35-39.(in Chinese)
[14]陈真真.β-半乳糖苷酶菌株筛选,酶的分离纯化和性质及酶法合成低聚半乳糖的研究[D].无锡:江南大学食品学院,2013.
[15]Chen C W,Ou-Yang C C,Yeh C W.Synthesis of galactooligosaccharides and transgalactosylation modeling in reverse micelles [J].Enzyme and Microbial Technology,2003,33(4):497-507.
[16]Song Y S,Lee J H,Kang S W,et al.Performance of β-galactosidase pretreated with lactose to prevent activity loss during the enzyme immobilisation process[J].Food Chemistry,2010,123(1):1-5.
[17]Hua X,Yang R,Zhang W,et al.Dual-enzymatic synthesis of lactulose in organic-aqueous two-phase media[J].Food Research International,2010,43(3):716-722
Synthesis of Galactooligosaccharides from Lactose by β-Galactosidase
LI Meiling,JIANG Bo*,ZHANG Tao
(Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
Beta-galactosidase solution was obtained through the fermentation of Bacillus circulans SK28.003,and its powder was prepared from the concentration of its solution,salting and precipitation,and freeze drying.To increase the efficiency of transgalatosylation and GOS yields,the optimal reaction conditions,such as initial lactose concentrations,loading amount of the enzyme,temperatures and pH values of the buffer,were determined through single factor and orthogonal experiments.Using the yields of GOS as the evaluation index,the maximum GOS yield was achieved up to 45.5%after 12 h synthesis when the reaction conditions were at 60℃,50 g/dL initial lactose concentration,6 U/g lactose in 0.1 M,and sodium phosphate buffer at pH 7.5.
β-galactosidase,galactooligosaccharides,transgalactosylation,optimization,orthogonal experiment
Q 814.9
A
1673—1689(2016)03—0234—06
2014-12-04
国家863计划项目(2013AA102102);国家自然科学基金重点项目(31230057)。
江波(1962—),男,江苏无锡人,工学博士,教授,博士研究生导师,主要从事酶学研究。E-mail:bjiang@jiangnan.edu.cn

