双酶体系高效制备(R)-2-氯-1-(3-氯苯基)乙醇
朱利娟,余涛,顾颖,杨标,邬敏辰*(.江南大学药学院,江苏无锡4;.江南大学无锡医学院,江苏无锡4)
双酶体系高效制备(R)-2-氯-1-(3-氯苯基)乙醇
朱利娟1,余涛1,顾颖2,杨标2,邬敏辰*2
(1.江南大学药学院,江苏无锡214122;2.江南大学无锡医学院,江苏无锡214122)
人工合成经密码子优化的羰基还原酶基因Sys1,并与葡萄糖脱氢酶基因Sygdh共克隆至双启动子表达质粒pETDuet-1中,获重组质粒pETDuet-Sygdh-Sys1。将其转化大肠杆菌(Escherichia coli)BL21(DE3),构建了共表达羰基还原酶和葡萄糖脱氢酶的重组工程菌E.coli BL21/pETDuet-Sygdh-Sys1。以经IPTG诱导的重组菌为生物催化剂,不对称还原间-氯苯甲酰甲基氯(m-CPC),制备手性药物中间体(R)-2-氯-1-(3-氯苯基)乙醇((R)-CCE)。在m-CPC 30 mmol/ L、重组湿菌体70 mg/mL、葡萄糖40 mmol/L、辅酶NADP+0.2 mmol/L,以及pH 7.0、反应温度40℃和反应时间3 h等条件下,所获手性化合物(R)-CCE的摩尔产率高达99.0%,对映体过量值(e.e.值)为100%。
双酶体系;羰基还原酶;葡萄糖脱氢酶;共表达;(R)-2-氯-1-(3-氯苯基)乙醇
手性醇是合成药物、香料、农药和功能性材料等的重要中间体[1]。例如,(R)-2-氯-1-(3-氯苯基)乙醇(2-chloro-1-(3-chlorophenyl)ethanol,(R)-CCE)用于合成多种β3-肾上腺素能受体(adrenergic receptor,AR)激动剂,如抗抑郁药SR 58611A,减肥药BRL 37344等[2-3]。手性醇的制备可采用化学法和生物法,而每种方法又可分为拆分法和合成法。化学拆分法或合成法需要昂贵的金属催化剂,以及对药物中金属离子的含量有严格标准,从而限制了其广泛的应用[4-6]。迄今为止,采用生物拆分法制备手性醇的报道较多,然而外消旋体拆分所获某种对映异构体的理论产率仅为50%[7]。
近年来采用生物合成法不对称还原羰基化合物制备手性醇已成为热点:
如Lin等[8]利用酿酒酵母(Saccharomyces cerevisiae)不对称还原间-氯苯甲酰甲基氯(mchlorophenacyl chloride,m-CPC)合成(R)-CCE,其产率达到97%,对映体过量(enantiomeric excess,e.e.)值为99%。
倪晔等[9]利用安大略假丝酵母(Candida ontarioensis)还原m-CPC所获(R)-CCE的产率和e.e.值分别为97.5%和99.5%。
朱敦明等[10]研究发现,来源于木兰假丝酵母(C. magnoliae)的羰基还原酶(EC 1.1.1.184)S1可以催化苯乙酮及其衍生物生成相应的手性醇,但未对m-CPC进行研究。
本研究基于羰基还原酶S1编码基因s1的核苷酸序列(GenBank登录号:AB036927),针对E.coli密码子偏爱性对编码基因s1进行密码子优化及人工合成,命名为Sys1。由于羰基还原酶催化的还原反应需要辅酶NADPH的参与,昂贵的辅酶限制了其应用,而葡萄糖脱氢酶[11]能够特异性地催化D-葡萄糖生成葡萄糖酸,并伴随NADP+向辅酶NADPH的转化。本研究中将Sys1与葡萄糖脱氢酶基因Sygdh[11]分别克隆至pETDuet-1双启动子的下游,转化E.coli BL21(DE3),构建共表达两种酶的重组工程菌E.coli BL21/pETDuet-Sygdh-Sys1,从而实现底物m-CPC的还原和辅酶NADPH的再生循环,如图1所示。为制备高摩尔产率和高e.e.值的(R)-CCE,研究中还对重组菌催化m-CPC不对称还原反应的条件(如底物、菌体、葡萄糖和辅酶浓度等)进行了优化。
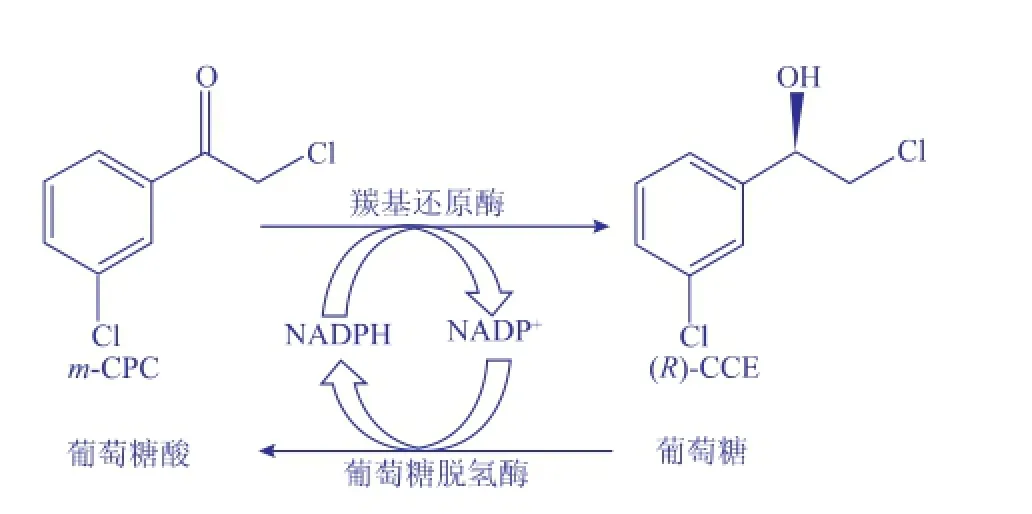
图1 重组菌E.coli BL21/pETDuet-Sygdh-Sys1不对称还原m-CPC制备(R)-CCEFig.1 Synthesis of(R)-CCE by asymmetrically reducing m-CPCusingtherecombinantE.coliBL21/ pETDuet-Sygdh-Sys1
1 材料与方法
1.1菌株、质粒和培养基
重组质粒pET28a-Sygdh,由作者所在实验室构建和保藏;大肠杆菌E.coli JM109,BL21(DE3)和表达质粒pETDuet-1,购自Novagen公司;克隆质粒pUCm-T,购自上海Sangon公司。
LB培养基(g/dL):蛋白胨1,酵母提取物0.5,NaCl 1(固体培养基添加1.5 g/dL琼脂粉);pH 7.2。
1.2主要试剂和仪器
各种限制性内切酶,rTaq DNA聚合酶,T4 DNA连接酶,DNA Markers和蛋白质Marker,购自大连TaKaRa公司;IPTG和EZ-10柱式DNA胶回收试剂盒,购自上海Sangon公司;NADPH和NADP+,购自上海源叶生物科技有限公司;m-CPC,(R)-CCE和(S)-CCE,Sumitomo公司产品;外消旋体(R,S)-CCE,由作者所在实验室合成;其他试剂均为国产或进口分析纯。
GC-2014型气相色谱仪,购于日本Shimadzu公司;CP-Chirasil-DEX CB手性气相色谱柱(25 m× 0.25 nm×0.25 μm),购于美国Agilent科技公司。
1.3密码子优化及基因Sys1合成
不同的宿主细胞对密码子有不同的偏爱性[12]。为高效表达羰基还原酶,参照宿主细胞E.coli的密码子偏爱性表,对源自木兰假丝酵母的羰基还原酶基因s1中的稀有密码子进行替换,并在基因5′和3′端分别添加NdeⅠ和XhoⅠ酶切位点。将密码子优化后的基因命名为Sys1(GenBank登录号:KJ522844),由上海Sangon公司合成并与pUCm-T连接,获重组质粒pUCm-T-Sys1。
1.4重组菌的构建及诱导表达
用NdeⅠ和XhoⅠ双酶切pUCm-T-Sys1,割胶回收目的基因Sys1,与经同样双酶切的质粒pETDuet-1连接,获重组质粒pETDuet-Sys1;再用NcoⅠ和HindⅢ双酶切pET28a-Sygdh,割胶回收Sygdh,与经同样双酶切的pETDuet-Sys1连接,获含有双基因的重组质粒pETDuet-Sygdh-Sys1。该重组质粒经测序验证正确后转化E.coli BL21(DE3),获重组工程菌E.coli BL21/pETDuet-Sygdh-Sys1。该重组菌的诱导表达参见文献[11]。8 000 r/min离心10 min收集菌体,用磷酸钾缓冲液(100 mmol/L、pH 7.0)洗涤菌体两次,用于SDS-PAGE分析和催化底物m-CPC还原反应,未经IPTG诱导的重组菌用作阴性对照。
1.5辅酶NADPH的再生循环
在磷酸钾缓冲液(100 mmol/L、pH 7.0)中加入10 mg经IPTG诱导的湿菌体、终浓度50 mmol/L葡萄糖、1 mmol/L NADPH或NADP+和2 mmol/L m-CPC,用缓冲液定容至1 mL,置于40℃、220 r/min摇床上反应12 h。8 000 r/min离心10 min,取0.6 mL上清液加入1 mL乙酸乙酯,激烈震荡后吸取上层有机相,无水硫酸镁干燥,过0.22 μm有机膜,用于气相色谱分析。
1.6(R)-2-氯-1-(3-氯苯基)乙醇的分析
样品分析采用GC-2014气相色谱仪、CPChirasil-DEX CB手性气相色谱柱和氢火焰离子检测器。参数设置:进样口和检测器温度均为250℃;初始柱温145℃维持2 min,再以5℃/min升温至200℃;载气氮气,体积流量2.0 mL/min,分流比1∶50。在此检测条件下,m-CPC、(R)-CCE和(S)-CCE的出峰时间分别为8.172、10.975和11.184 min,如图2所示。

图2 m-CPC和CCE的气相色谱图Fig.2 Gas chromatograms of m-CPC and CCE

式(1)(2)中,r为摩尔产率;n1、n2、n3、n4分别为(R)-CCE、m-CPC、(R)-CCE-(S)-CCE、(R)-CCE+(S)-CCE物质的量(mol);e为对映体过量值(e.e.值)。
1.7重组菌催化条件的优化
在磷酸钾缓冲液(100 mmol/L、pH 7.0)中加入不同终浓度的m-CPC、湿菌体、葡萄糖和NADP+,用缓冲液定容至1 mL,在40℃、220 r/min催化反应6 h。反应样品参照1.5和1.6进行处理和分析,以(R)-CCE的产率为指标,优化重组菌的催化条件。
2 结果与讨论
2.1含双基因重组表达质粒的构建
用NdeⅠ和XhoⅠ分别双酶切pUCm-T-Sys1和pETDuet-1,将目的基因Sys1与pETDuet-1进行连接、转化JM109,筛选得到重组菌JM109/pETDuet-Sys1。再对pETDuet-Sys1和pET28a-Sygdh分别进行NcoⅠ和HindⅢ双酶切,将基因Sygdh连接到pETDuet-Sys1中,转化E.coli BL21,筛选得到重组菌E.coli BL21/pETDuet-Sygdh-Sys1。分别用NdeⅠ和XhoⅠ、NcoⅠ和HindⅢ、NcoⅠ和XhoⅠ双酶切含有双基因的重组质粒pETDuet-Sygdh-Sys1,见图3(a),琼脂糖凝胶电泳分析如图3(b)所示,各基因长度与理论值相符。
2.2羰基还原酶与葡萄糖脱氢酶的表达与鉴定
重组菌E.coli BL21/pETDuet-Sygdh-Sys1经1.0 mmol/L的IPTG于25℃诱导12 h后。利用Quantity One软件分析SDS-PAGE电泳图,结果显示,与未诱导的对照组相比(图4,泳道1),重组菌E.coli BL21/pETDuet-Sygdh-Sys1的表达产物在表观相对分子质量30.0 kDa(羰基还原酶)和41.0 kDa
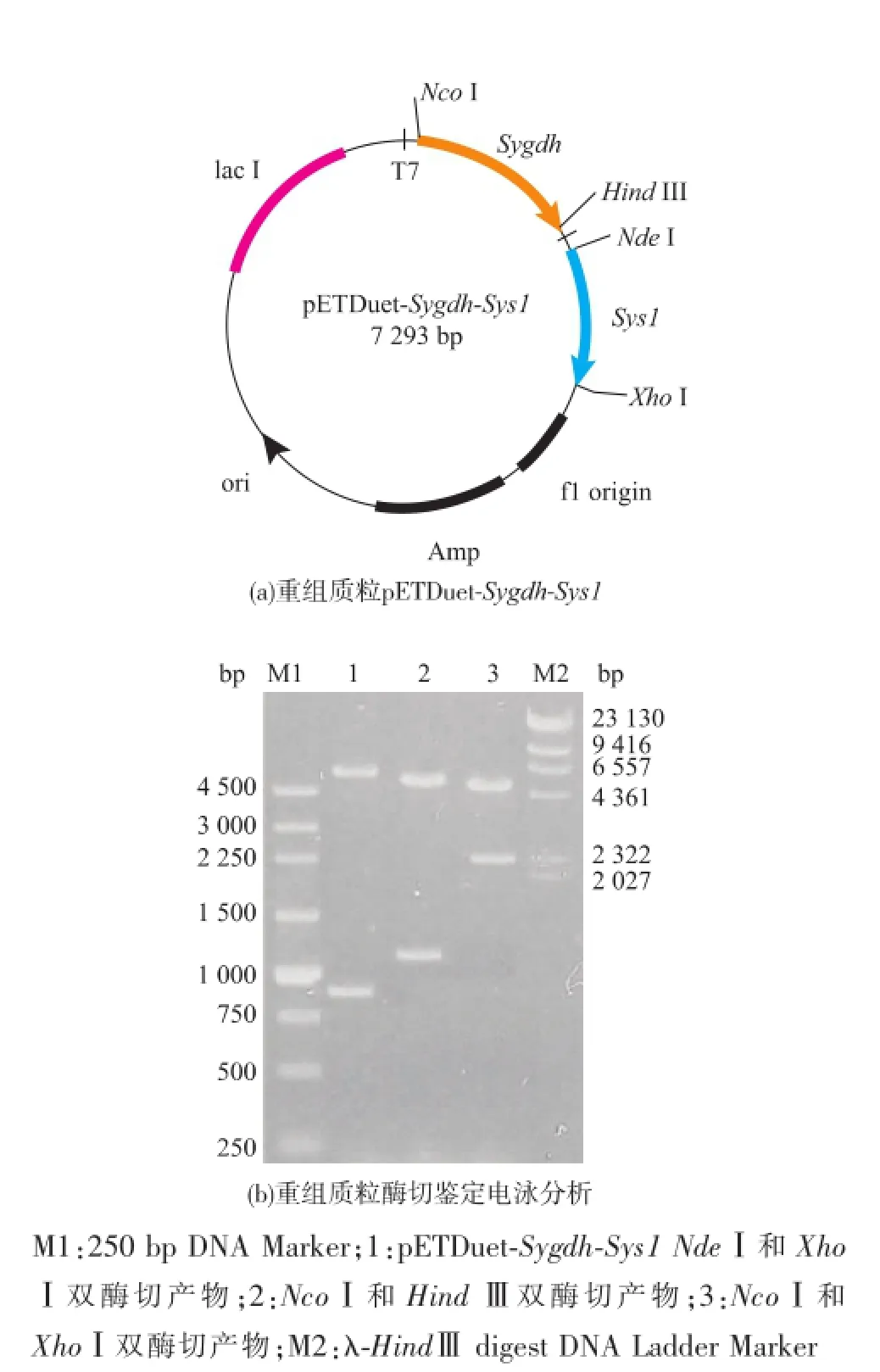
图3 pETDuet-Sygdh-Sys1及其酶切产物电泳图Fig.3 pETDuet-Sygdh-Sys1 and its digestion by NdeⅠ/ XhoⅠ,NcoⅠ/HindⅢand NcoⅠ/XhoⅠ,respectively
(葡萄糖脱氢酶)处有明显的蛋白质条带(图4,泳道2)。结果表明Sygdh和Sys1基因在大肠杆菌中实现了高效表达。
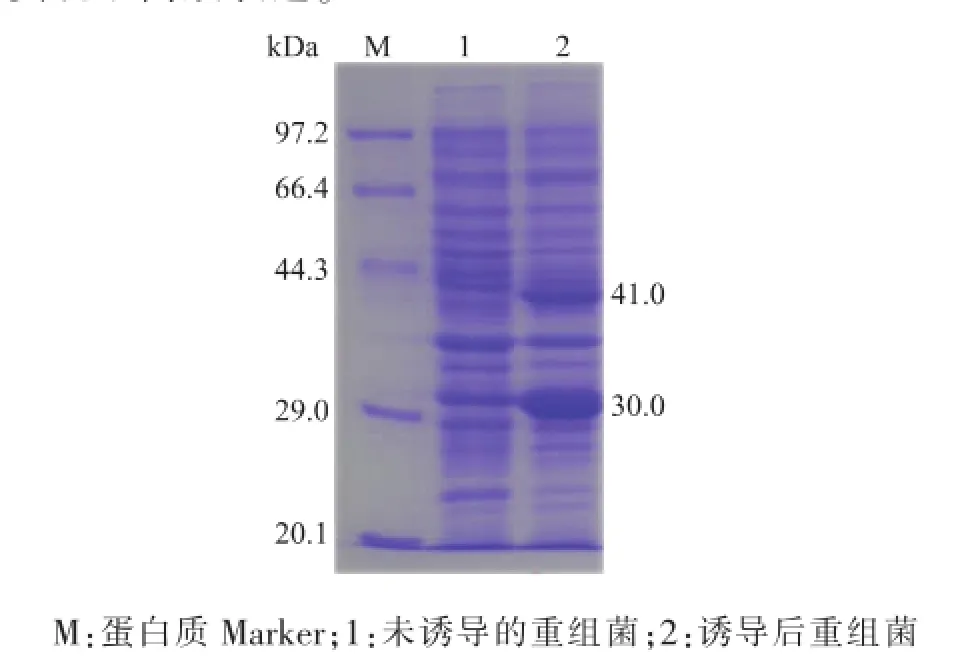
图4 重组蛋白质的SDS-PAGE分析图Fig.4 SDS-PAGE analysis of the recombinant proteins
2.3NADPH再生循环的验证
利用重组菌做反应前,需要验证辅酶再生的可能性。由表1反应体系1、2、3可知,葡萄糖脱氢酶成功完成辅酶的再生循环,且葡萄糖参与的体系3的产率是体系2的2.2倍。比较体系3、4、5的产率可知,NADP+和NADPH作用相当,由于NADPH的价格比较昂贵,用NADP+替代NADPH参与生物催化反应。

表1 不同反应体系分析辅酶再生Table 1 Analysis of cofactor regeneration with difference reaction systems
2.4重组菌催化条件的优化
2.4.1底物浓度对转化反应的影响重组菌E.coli BL21/pETDuet-Sygdh-Sys1转化体系中,底物m-CPC初始浓度为10~30 mmol/L时,产物(R)-CCE的产率变化不大,如图5所示。当底物浓度高于30 mmol/L时,产物的产率开始降低,这可能是由于过高的底物浓度使酶的活性中心饱和,从而造成酶的催化效率下降,但这个反应过程中e.e.值并不因受底物浓度的改变而改变。
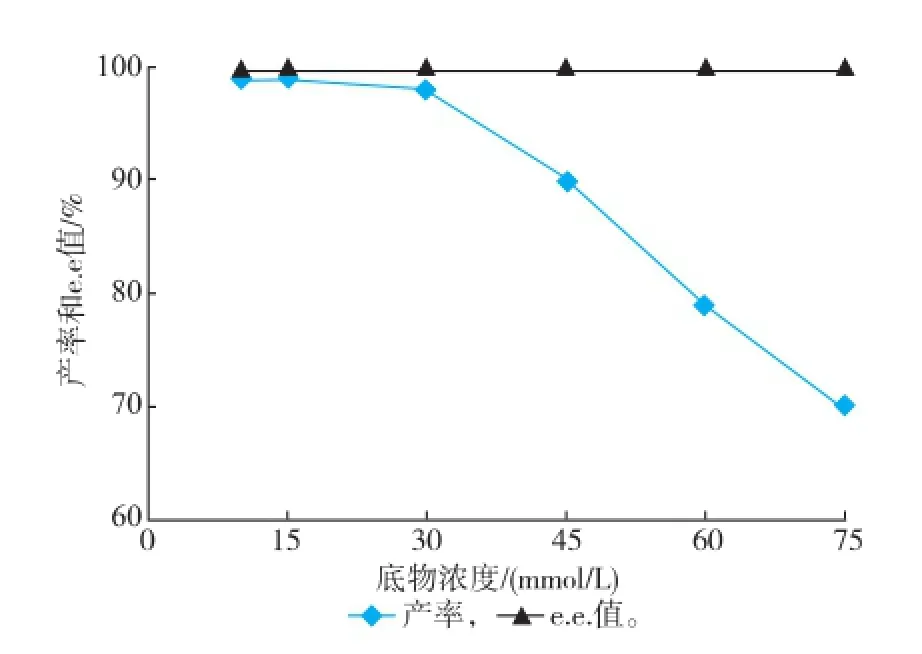
图5 底物m-CPC初始浓度对转化反应的影响Fig.5 Effectofinitialsubstrateconcentrationon biotransformation reaction
2.4.2菌体浓度对转化反应的影响由图6可知,当底物初始浓度为30 mmol/L、菌体湿质量浓度为50~70 mg/mL时,摩尔产率随细胞质量浓度的增加而增大;当细胞质量浓度为70、80、90、100 mg/mL时,得率分别为99.2%、99.6%、99.6%、99.8%,基本不变。可能是在一定范围内,菌体质量浓度增加导致参加催化反应的细胞内酶分子数增加,可提供给底物分子的活性结合位点增加,因而反应体系的催化效率明显提高。

图6 菌体质量浓度对转化反应的影响Fig.6 Effect of cell concentration on biotransformation reaction
2.4.3葡萄糖和辅酶浓度对反应的影响葡萄糖作为辅助底物参与辅酶的循环,在底物浓度30 mmol/L,菌体湿质量浓度70 mg/mL,葡萄糖浓度10~40 mmol/L时,产率随着葡萄糖浓度的增加而增加。当葡萄糖浓度超过40 mmol/L后产率基本不变,见图7(a)。辅酶(NADP+)理论上只需一点启动反应后,在葡萄糖脱氢酶的作用下就可以驱动辅酶作循环,完成生物催化反应,图7(b)表明0.2 mmol/L辅酶(NADP+)就能够完成底物99.0%的转化率。
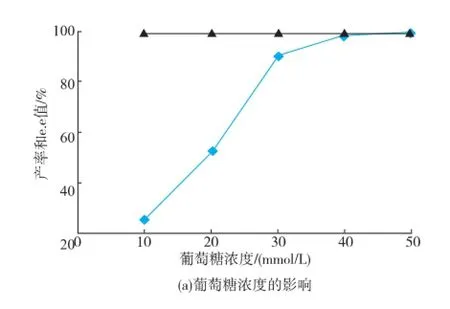

图7 葡萄糖和辅酶浓度对转化反应的影响Fig.7 Effect of glucose and NADP+concentrations on biotransformation reaction
2.4.4反应时间对反应的影响由图8可知,在底物浓度、湿菌体质量浓度、葡萄糖浓度、辅酶浓度、pH值和反应温度分别为30 mmol/L、70 mg/mL、40 mmol/L、0.2 mmol/L、7.0、40℃时,双酶体系中的摩尔产率在30~90 min内增加较快,90~180 min内产率增加较慢,而180 min后基本不变,摩尔产率可达到99%,此时反应时间由之前的6 h缩短到3 h,整个过程中e.e.值一直保持100%不变。
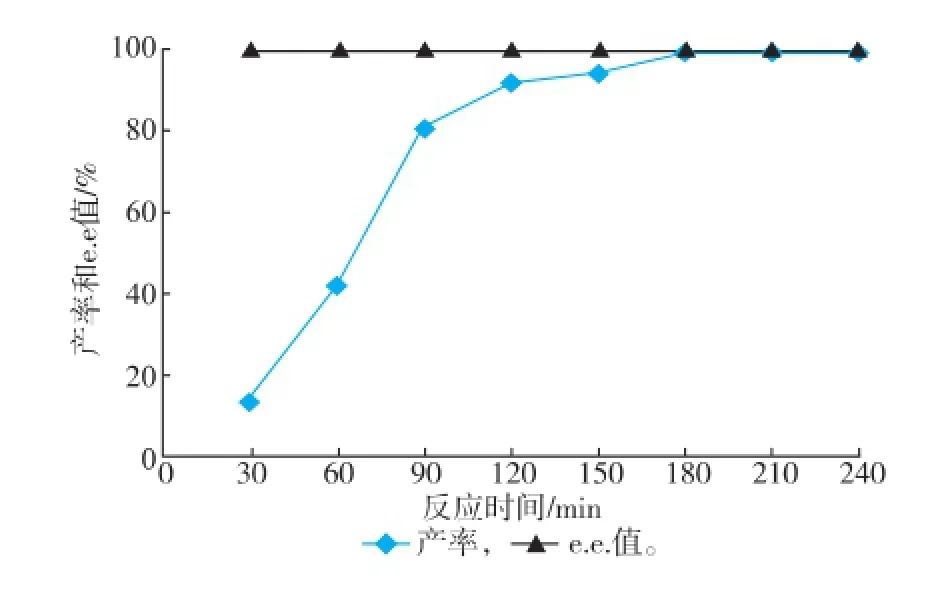
图8 反应时间对转化反应的影响Fig.8 Effect of reaction time on biotransformation reaction
3 结语
由于(R)-CCE是重要的药物中间体,将密码子优化后的羰基还原酶基因Sys1和葡萄糖脱氢酶基因Sygdh构建双酶共表达重组菌E.coli BL21/ pETDuet-Sygdh-Sys1,并作为生物催化剂。研究了反应条件对合成(R)-CCE效率的影响。研究结果表明,在底物30 mmol/L、菌体70 mg/mL、葡萄糖40 mmol/L、辅酶0.2 mmol/L、pH 7.0、反应温度40℃、反应时间3 h条件下,合成产物(R)-CCE的摩尔产率达99.0%,e.e.值可达100%。同时本研究工作也为生物催化解决辅酶再生问题奠定了良好的基础。
[1]郁惠蕾,黄磊,倪燕,等.羰基生物还原法合成手性醇的研究进展[J].生物加工过程,2013,11(3):71-82. YU Huilei,HUANG Lei,NI Yan,et al.Advances in synthesis of chiral alcohols by carbonyl bioreduction[J].Chinese Journal of Bioprocess Engineering,2013,11(3):71-82.(in Chinese)
[2]Harada H,Hirokawa Y,Suzuki K,et al.Novel and potent human and rat β3-adrenergic receptor agonists containing substituted 3-indolylalkylamines[J].Bioorganic&Medicinal Chemistry Letters,2003,13(7):1301-1305.
[3]Devocelle M,Mortreux A,Agbossou F,et al.Alternative synthesis of the chiral atypical β-adrenergic phenylethanolaminotetraline agonist SR58611A using enantioselective hydrogenation[J].Tetrahedron Letters,1999,40(24):4551-4554.
[4]儿玉浩宣,本河卓也,山口博志,等.2-卤代-1-(取代苯基)乙醇的生产:中国,CN1063422C[P].2001-03-21.
[5]Ohkuma T,Tsutsumi K,Utsumi N,et al.Asymmetric hydrogenation of α-chloroaromatic ketones catalyzed by η6-arene/ TsDPEN-ruthenium(II)complexes[J].Organic Letters,2007,9(2):255-257.
[6]Thayer A.Removing impurities:Metal scavengers and immobilized catalysts may make for cleaner pharmaceutical products[J]. Chemical&Engineering News,2005,83(36):55-58.
[7]Xia S W,Lin H,Chen Y Z.Preparation of(R)-2-chloro-1-(m-chlorophenyl)ethanol by Lipozyme TL IM-catalyzed second resolution[J].Chinese Chemical Letters,2012,23(3):289-292.
[8]Lin H,Chen Y Z,Xu X Y,et al.Preparation of key intermediates of adrenergic receptor agonists:Highly enantioselective production of(R)-α-halohydrins with Saccharomyces cerevisiae CGMCC 2.396[J].Journal of Molecular Catalysis B:Enzymatic,2009,57:1-5.
[9]Ni Y,Zhang B H,Sun Z H.Efficient synthesis of(R)-2-chloro-1-(3-chlorophenyl)ethanol by permeabilized whole cells of Candida ontarioensis[J].Chinese Journal of Catalysis,2012,33(4):681-687.
[10]Zhu D M,Yang Y,Hua L.Stereoselective enzymatic synthesis of chiral alcohols with the use of a carbonyl reductase from Candida magnoliae with anti-Prelog enantioselectivity[J].Journal of Organic Chemistry,2006,71(11):4202-4205.
[11]余涛,胡蝶,邬敏辰,等.重组葡萄糖脱氢酶的酶学性质及其偶联辅酶再生[J].食品与生物技术学报,2014,33(9):910-916. YU Tao,HU Die,WU Minchen,et al.Enzymatic characterization and coenzyme regeneration of a recombinant glucose 1-dehydrogenase[J].Journal of Food Science and Biotechnology,2014,33(9):910-916.(in Chinese)
[12]金光泽,段作营,张莲芬,等.重组融合人血清白蛋白-人白介素-2C125A突变体在毕赤酵母中的表达[J].食品与生物技术学报,2010,29(4):595-601. JIN Guangze,DUAN Zuoying,ZHANG Lianfen,et al.Expression of the fusion protein human serum albu/mutant human interleukin 2C125A in Pichia pastoris[J].Journal of Food Science and Biotechnology,2010,29(4):595-601.(in Chinese)
Efficient Preparation of(R)-2-Chloro-1-(3-Chlorophenyl)Ethanol by a Double Enzyme System
ZHU Lijuan1,YU Tao1,GU Ying2,YANG Biao2,WU Minchen*2
(1.School of Pharmaceutical Science,Jiangnan University,Wuxi 214122,China;2.Wuxi Medical School,Jiangnan University,Wuxi 214122,China)
A codon-optimized gene Sys1,which encodes a carbonyl reductase,was synthesized,and cloned into an expression plasmid pETDuet-1 with double promoters together with a glucose dehydrogenase-encoding gene Sygdh.The recombinant E.coli BL21/pETDuet-Sygdh-Sys1,expressing the carbonyl reductase and the glucose dehydrogenase together,was constructed by transforming the recombinant plasmid,pETDuet-Sygdh-Sys1,into E.coli BL21(DE3).Using recombinant E.coli cells induced by IPTG as biocatalysts,(R)-2-chloro-1-(3-chlorophenyl)ethanol((R)-CCE),achiraldrugintermediate,wassynthesizedbyasymmetricallyreducingmchlorophenacylchloride(m-CPC).Underthereactionconditionsof30mmol/Lofm-CPC,70mg/mLof wetrecombinant E.colicells,40mmol/Lofglucose,0.2 mmol/LofNADP+at pH7.0 and 40℃for 3 h,themolaryieldof(R)-CCEreached99.0%withanenantiomericexcess(e.e.)valueof100%.
double enzyme system,carbonyl reductase,glucose dehydrogenase,coexpression,(R)-2-chloro-1-(3-chlorophenyl)ethanol
Q 814.9
A
1673—1689(2016)03—0278—06
2014-12-12
国家自然科学基金项目(31271811)。
邬敏辰(1962—),男,江苏无锡人,理学博士,教授,博士研究生导师,主要从事酶工程与基因工程研究。
E-mail:bioch@163.com

