基于温控载体表达胆固醇氧化酶
袁晔,张玲,邵蔚蓝,王武,杨海麟*(.江南大学工业生物技术教育部重点实验室,江苏无锡4;.江苏大学食品与生物工程学院,江苏镇江000)
基于温控载体表达胆固醇氧化酶
袁晔1,张玲1,邵蔚蓝2,王武1,杨海麟*1
(1.江南大学工业生物技术教育部重点实验室,江苏无锡214122;2.江苏大学食品与生物工程学院,江苏镇江212000)
胆固醇氧化酶在医药检测、食品加工、农业生产等方面都有重要的应用价值。以来源于Rhodococcus sp.的胆固醇氧化酶基因为研究对象,构建于温控表达载体pHsh上,免去了诱导剂的使用,采用温度调控使胆固醇氧化酶基因在大肠杆菌中成功表达。在摇瓶水平对酶的表达量进行优化,最终的酶量为855 U/L。使用镍柱将酶纯化,得到单一条带,相对分子质量约为55 kDa。分析其酶学性质,最适pH 7.0,在pH 5.0~7.0稳定;最适反应温度40℃,在50℃保温,其半衰期为6.9 min。以胆固醇为底物,在pH 7.5、37℃条件下测酶活,计算得动力学参数Km为3.38 mmol/L,kcat/Km为6.09 s-1·(mmol/L)。
胆固醇氧化酶;pHsh热激表达载体;温度诱导
大肠杆菌表达系统是基因表达技术中发展最早,目前应用最广泛的经典表达系统。与其它表达系统相比,大肠杆菌表达系统具有遗传背景清楚,目的基因表达水平高,培养周期短,抗污染能力强等特点[1]。一个完整的大肠杆菌表达系统至少要有表达载体和宿主菌两部分构成。常见的表达体系有Lac/Tac表达体系[2],PL/PR表达体系[3]和T7表达体系[4-5],Lac/Tac表达体系需要添加诱导剂IPTG,但由于IPTG本身具有一定的毒性,常用乳糖代替;PL/ PR表达体系是利用温控启动的,热刺激过程中,大肠杆菌热休克,蛋白质表达也会被激活,其中一些是蛋白水解酶,有可能降解所表达的重组蛋白质,且大体积发酵培养菌体时,温度升高需要较长的时间,对重组蛋白质的表达量有一定的影响。T7启动子常融合前两种启动子,但是这是一种强启动子,目的蛋白质的过量表达常使其形成无活性的包涵体状态。3种表达体系各有利弊[6]。pHsh表达体系是基于E.coli胞内σ32因子调控热休克蛋白质的表达而设计的,当受到热激时,σ32因子的数量急剧增加,使目的蛋白质大量表达,诱导是由温度控制,并不需要添加诱导剂,操作简便[7-8]。
胆固醇氧化酶(COD)属于黄素氧化酶类,是胆固醇降解过程中的第一个酶,多数情况能催化胆固醇的氧化,并以氧气为电子受体生成胆甾鄄4鄄烯鄄3鄄酮和H2O2[9]。胆固醇氧化酶应用广泛[10],可用于医学检测[11]、甾体激素或甾体类药物的合成[12],以及针对鳞翅目昆虫的杀虫剂[13],还可用于生产低胆固醇且具有保健功能的食品,具有较好的经济价值[14]。
COD已经构建在E.coli BL21(DE3)鄄pET28a (+)表达系统中,由于表达载体pET28a是lac启动子,在表达的过程需要添加昂贵的诱导剂,而且具有T7强启动子,使表达产物快速过量而多呈无活性的包涵体状态。本研究中采用pHsh热激表达载体,构建并表达COD,研究了其酶学性质。
1 材料与方法
1.1材料
1.1.1菌株、载体与基因宿主大肠杆菌E.coli BL21(DE3),由作者所在实验室保存;重组E.coli BL21(DE3)/pET28a(+)鄄COD,作者所在实验室构建、保存;温控质粒pHsh,由南京师范大学邵蔚蓝教授惠赠。
1.1.2工具酶与试剂工具酶NcoⅠ,XbaⅠ,T4 DNALigase,Taq DNA聚合酶,均购自TaKaRa公司;质粒小提试剂盒,购自上海生工生物工程有限公司;胶回收试剂盒,DNA相对分子标准,购于上海捷瑞有限公司;酵母提取物和胰蛋白胨,Oxoid公司产品;辣根过氧化物酶,上海蓝园生物有限公司产品;其他试剂为国产分析纯。
1.1.3培养基LB培养基,M9培养基,LB+M9优化培养基,TB培养基,详见文献[15]。
1.2方法
1.2.1引物设计根据ChOb基因序列(GenBank登录号为DQ345780.1),以及质粒载体pHsh的序列,设计合成以下引物。上游引物:5'鄄TGCTCTAGACCCCCAGCCGCACCCT鄄3';下游引物:5'鄄CATGCCATGGCTGGATGTCGGACGAG鄄3'。引物由南京金斯瑞生物科技有限公司合成。
1.2.2分子操作技术重组E.coli BL21(DE3)/ pET28a(+)鄄COD接于LB培养基,在37℃、200 r/ min的摇床上过夜培养。8 000 r/min离心1 min收集菌体,质粒提取、酶切、连接、转化按产品说明书操作。
1.2.3ChOAb基因序列的扩增以重组质粒pET28a(+)鄄COD为模板,进行COD基因的扩增。PCR扩增反应参数:94℃预变性4 min;94℃变性45 s,64.8℃退火45 s,72℃延伸2 min,30次循环;72℃延伸10 min,4℃保存。用1 g/dL琼脂糖凝胶电泳验证PCR产物。
1.2.4pHsh鄄COD表达载体的构建用限制性内切酶NcoⅠ、XbaⅠ将PCR产物与质粒pHsh分别进行双酶切,37℃反应2 h。随后两个反应液分别用胶回收试剂盒纯化,将两个片段连接,使用化学转化法得到重组E.coli BL21(DE3)/pHsh鄄COD,利用含100滋g/mL氨苄青霉索的LB平板筛选具抗性单菌落,然后摇瓶培养阳性转化子,提质粒,双酶切鉴定。
1.2.5粗酶液的制备从固体LB培养基上取单菌落至含100滋g/mL氨苄青霉素的LB液体培养基中,选取较低温度30℃,200 r/min过夜培养,即为种子液。接体积分数5%种子液接种于新LB培养基,在较低温度30℃培养至OD600=0.7,42℃较高温度诱导5 h。发酵结束后,8 000 r/min离心5 min收集菌体,称湿质量,按1∶20(g/mL)的比例加入20 mmol/L pH 7.5的磷酸缓冲液重悬菌液,超声破碎4 min停1 min,超声30 min后8 000 r/min离心10 min,弃沉淀,即获得粗酶液。
1.2.6COD酶活测定酶活测定的原理及具体方法参照文献[16]。酶活力单位定义:在37℃下,每分钟转化1 μmol胆固醇生成胆甾鄄4鄄烯鄄3鄄酮所需的酶量定义为1个酶活力单位(U)。
1.2.7COD的纯化按镍柱使用说明书纯化。
1.2.8重组酶酶学性质分析以下都以酶活力最高值为100%计算相对活性,确定胆固醇氧化酶酶学性质:
1)最适pH:使用pH 4~10的检测液在37℃下测定酶活力。
2)pH稳定性:将酶在不同的pH值(4~12)缓冲液中37℃放置1 h后测定酶活。
3)最适温度:控制pH为7.5,在30~60℃范围内每隔5℃测定酶活。
4)温度稳定性:控制pH为7.5,在50℃保温不同的时间,测定酶活。
5)酶动力学参数测定:以0.2~2 mmol/L的胆固醇为底物,在37℃,pH 7.5条件下测定酶的活性。采用双倒数作图法,计算动力学参数。
2 实验结果
2.1重组pHsh鄄COD的构建
用1 g/dL琼脂糖凝胶电泳检测扩增的PCR产物,如图1所示,为一条约1.7 kb的特异性条带,与预期的COD基因大小一致。将PCR酶切产物与pHsh载体连接,转入大肠杆菌BL21,挑取转化子,37℃过夜培养提取质粒。根据引物上设计的相应酶切位点,分别用NcoⅠ、XbaⅠ酶切转化子质粒,产物经1 g/dL琼脂糖凝胶电泳检测,见图1,有1.7 kb 及2.4 kb两条带,与预期的目的条带一致,说明重组pHsh鄄COD构建成功。将重组pHsh鄄COD送上海生工生物工程有限公司测定其中ChOb基因序列,结果与GenBank中序列一致。
2.2E.coli BL21(DE3)/pHsh鄄COD发酵条件优化
2.2.1发酵培养基的选择培养基的营养组成不同,对重组蛋白质的表达有较大的影响[15,17-18]。选择不同的培养基对诱导表达的影响如图2所示。以TB培养基诱导COD时COD的酶活及比酶活较高,LB+M9培养基次之;仅以LB培养基诱导的COD酶活及产量最低,可能是LB培养基中没有缓冲体系,pH的改变影响酶的表达;M9培养基诱导表达的酶活也不高,M9培养基以无机盐为主,可能营养条件不足,影响大肠杆菌的生产及表达。所以选择TB培养基重组菌诱导表达的发酵培养基。
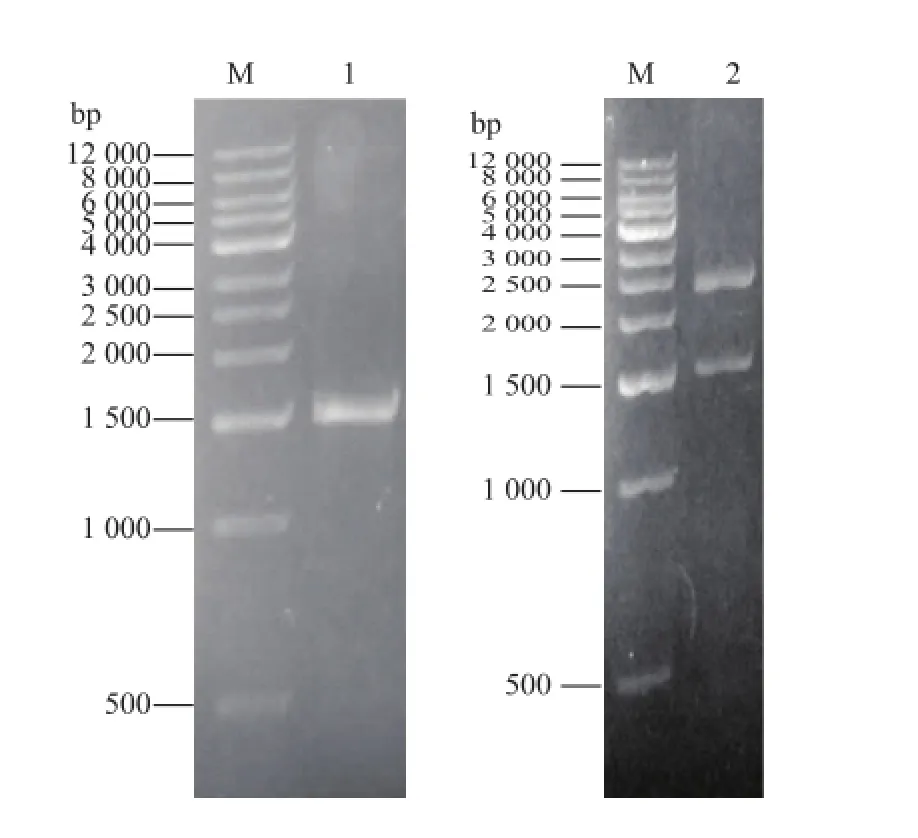
图1 ChOb基因的PCR扩增与重组pHsh鄄COD的双酶切验证Fig.1 PCR amplification of ChOb and analysis of pHsh鄄COD restriction enzyme digestion
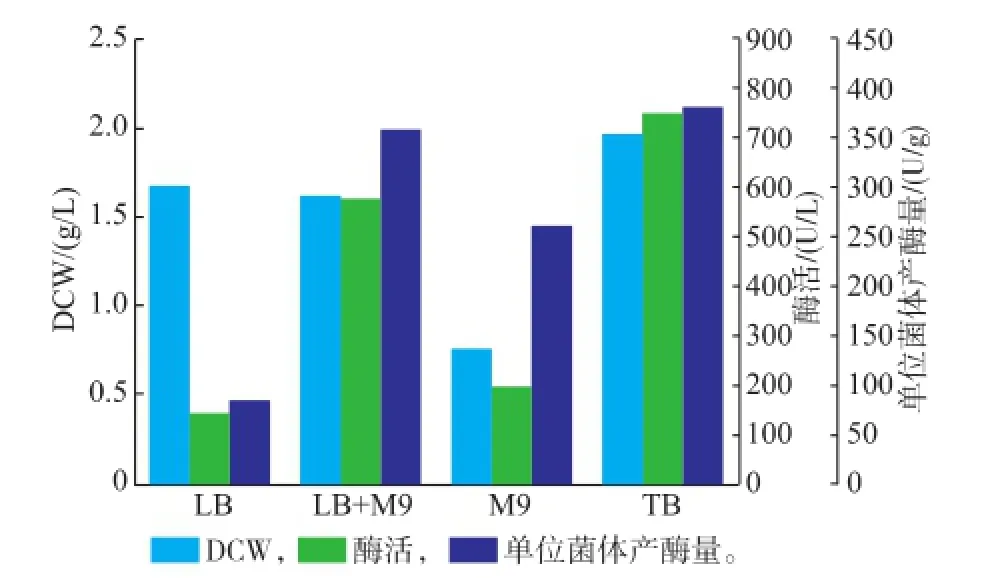
图2 不同培养基对诱导条件的影响Fig.2 Effect of different culture media on the induced condition
2.2.2诱导时机的确定将种子液按体积分数5%的接种量接入TB培养基,培养不同时间后诱导,确定最佳的诱导时机。如图3所示,随着诱导菌液OD600不断升高,诱导后的酶活及平均产率也在升高。当OD600为1.7左右后诱导,酶活及平均产率最高;OD600高于2后诱导,酶活及平均产率随之下降。由图,确定诱导时机为菌液培养至OD600为1.5~1.7。
2.2.3诱导温度的选择由于σ32因子在高温下被打开,低于30℃培养,重组蛋白质表达的量极少,选择将发酵液分别在30、37、42℃下诱导5 h,结果如图4所示。30℃诱导,并没有进行热激,此时菌体量多,但是酶活很低,表明此时主要是菌体量不断增长,而有酶活可能只是菌体的本底表达;37℃诱导,菌体量比较多,且酶活有所提高,表明37℃培养,即可激发启动子,让酶进行表达;42℃诱导,菌体量比较少,但是酶活较高,表明在42℃下培养,菌体主要进行酶的表达,单位菌体产酶量也最高。因此诱导温度选择42℃。
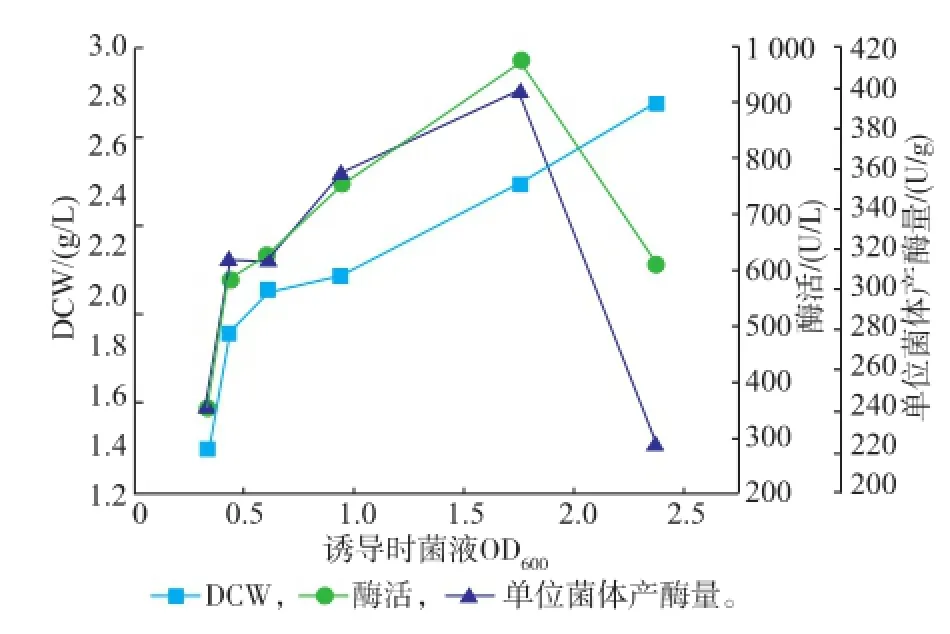
图3 不同诱导时机对酶产量的影响Fig.3 Effect of different induction opportunity on the induced condition
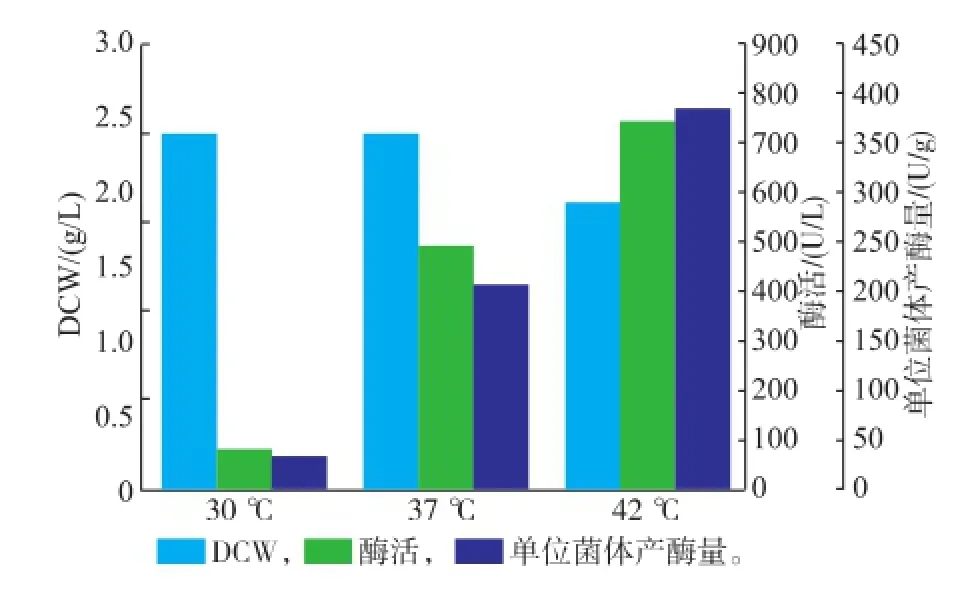
图4 不同诱导温度对酶产量的影响Fig.4 Effect of different induction temperature on the induced condition
2.2.4发酵时间优化将发酵液在42℃下诱导不同时间,如图5所示。菌体量在3~9 h内不断上升,超过13 h后菌体量开始下降,其中5 h的单位菌体产酶量最高,选择5 h为诱导时间。最终酶量855 U/L。
2.3COD的纯化
COD的纯化是依赖于酶的C端带有His鄄tag,可用镍柱进行纯化(见图6)。纯化过程配制咪唑浓度梯度进行洗脱,分别是50,100,200,300 mmol/L以及400 mmol/L,将洗脱液处理后,用SDS鄄PAGE鉴定,发现在使用400 mmol/L咪唑浓度洗脱时,出现单一条带,约为55 kDa,与目的条带大小一致。
2.4重组COD的酶学性质研究
对重组胆固醇氧化酶的酶学性质进行研究(图7—10)。该酶的最适pH为7.0,在pH 5.0~7.0保存较稳定,在pH 7.0~11.0酶活缓慢下降,在pH 4.0及pH 12.0的缓冲液中,酶已丧失活性。
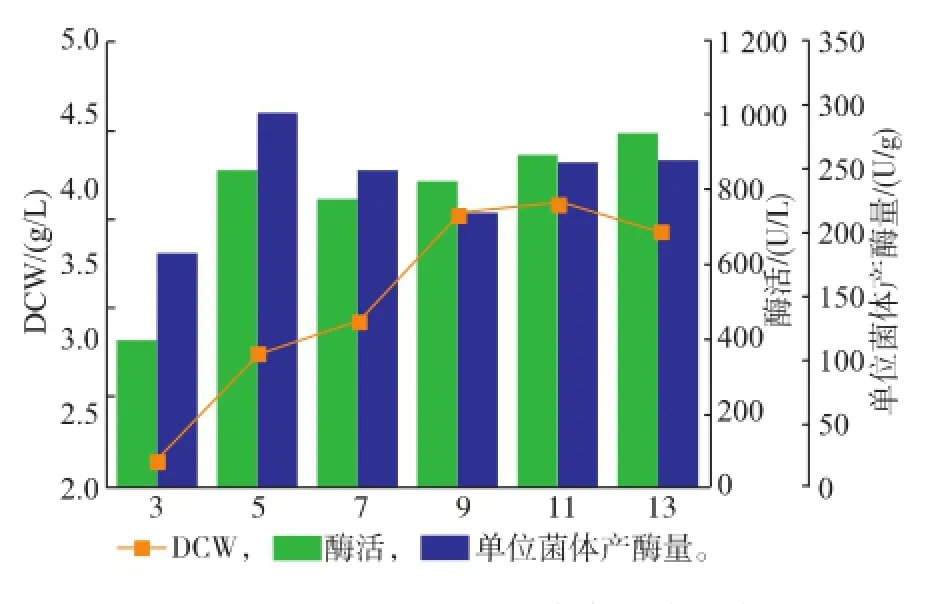
图5 不同诱导时间对酶产量的影响Fig.5 Effect of different induction time on the induced condition
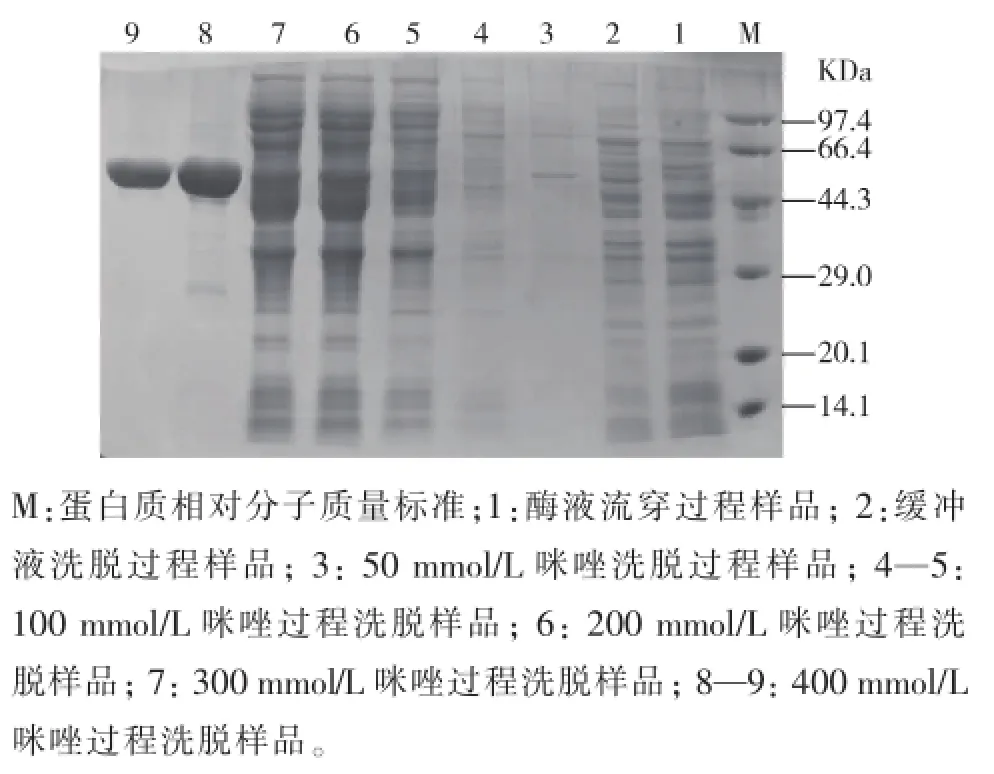
图6 COD纯化过程SDS鄄PAGE鉴定Fig.6 SDS鄄PAGE identification of COD purified process
该酶的最适反应温度为40℃,由于该酶的热稳定性较差,变性温度在55℃左右,选取50℃测其热稳定性,可以有效缩短测定时间。在50℃保温,测其半衰期为6.9 min,保温25 min后还剩9.08%的酶活力。以0.2~2 mmol/L的胆固醇为底物,在pH 7.5,37℃条件下测定酶活,计算得动力学参数Km为3.38 mmol/L,kcat/Km为6.09 s-1·(mmol/L)。
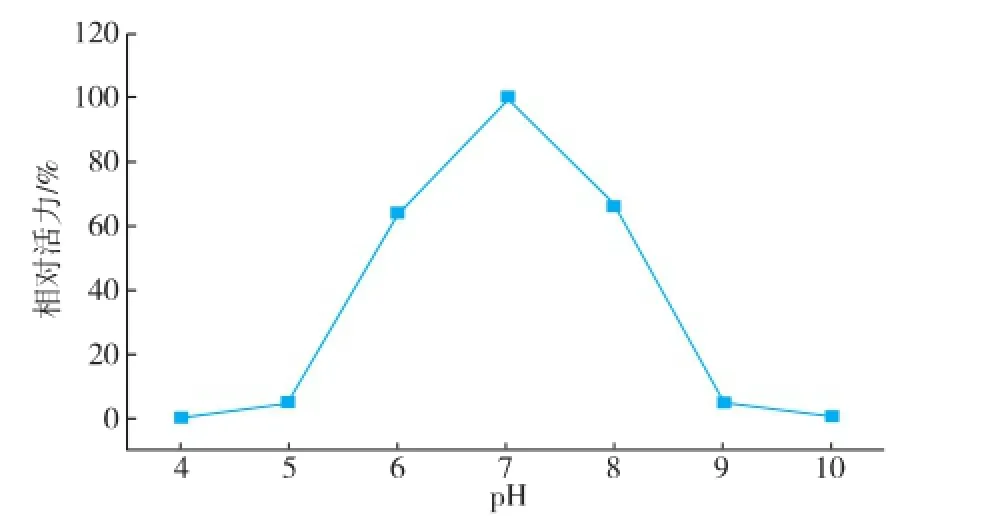
图7 COD最适反应pHFig.7 Optimum pH of COD
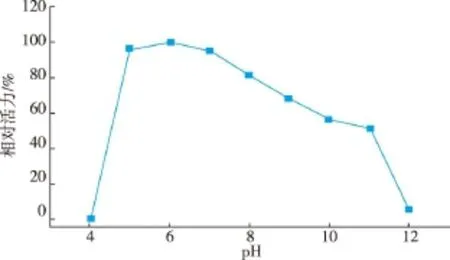
图8 COD的pH稳定性Fig.8 pH stability of COD
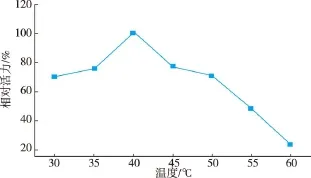
图9 COD的最适反应温度Fig.9 Optimum temperature of COD
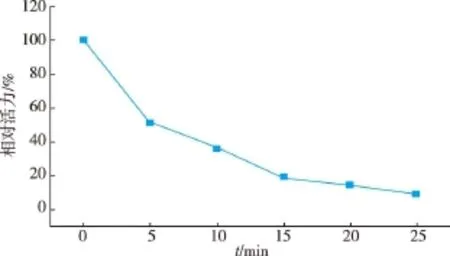
图10 COD的50℃时的稳定性Fig.1 0Temperature stability of COD
3 讨论
胆固醇氧化酶是黄素氧化还原酶家族的典型结构模式酶,利用温控诱导蛋白质表达的方式可以作为有效的方法来借鉴。
pHsh温控表达载体是受E.coli细胞内σ32调控,在较高温度下培养,刺激σ32因子的表达,随后激发目的蛋白质大量表达。由于诱导的条件需要较高的温度,耐高温的酶可能比较合适用这种载体进行表达,其中极耐热性的β鄄葡萄糖醛酸酶基因构建在pHsh载体上得到了高效的表达[19]。
胆固醇氧化酶的表达,作者所在实验室曾构建在pET鄄28a(+)载体上,诱导的过程需要添加IPTG或者乳糖,且多一步操作过程,也增加了染菌的风险;使用pHsh热激表达载体构建胆固醇氧化酶,由于其温控的原理,只需在合适的时候对温度进行控制,即可表达大量的酶,操作十分简便。重组pET鄄28a(+)鄄COD在大肠杆菌中的高水平表达导致蛋白质聚集而形成不溶的、无活性的包涵体[20];而重组pHsh鄄COD的表达产物并没有包涵体,但是由于此COD的稳定性较差,较高温度的诱导可能在诱导过程中一部分酶已经失活,从而影响表达的酶总量,重组pHsh鄄COD表达的酶量仅是pET鄄28a(+)鄄COD表达酶量的1/10。
4 结语
从实验结果中发现,重组pHsh鄄COD的表达最好是使用TB培养基,但从成本角度看,TB培养基的成本仍然比较高,因此可以进一步优化培养基,降低培养成本。
[1]Nuc P,Nuc K.Recombinant protein production in Escherichia coli[J].Postepy Biochemii,2006,52(4):448-456.
[2]Vectors bearing a hybrid trp-lac promoter useful for regulated expression of cloned genes in Escherichia coli[J].Gene,1983,25 (2-3):167-178.
[3]HU B,DR H.Use of the lambda phage promoter PL to promote gene expression in hybrid plasmid cloning vehicles[J].Methods in Enzymology,1979,68:482-492.
[4]FW S,BA M.Use of bacteriophage T7 RNA polymerase to direct selective high-level expression of cloned genes[J]. Journal of Molecular Biology,1986,189(1):113-130.
[5]CCR S T.A bacteriophage T7 RNA polymerase/promoter system for controlled exclusive expression of specific genes[J]. Proceedings of the National Academy of Sciences of the USA,1985,82(4):1074-1078.
[6]任增亮,堵国成,陈坚,等.大肠杆菌高效表达重组蛋白策略[J].中国生物工程杂志,2007,27(9):103-9. REN Zengliang,DU Guocheng,CHEN Jian,et al.Strategies for high-level expression of recombinant protein in Escherichia coli[J]. China Biotechnology,2007,27(9):103-109.(in Chinese)
[7]蒋钰瑶,何嘉荣,王未未,等.新型大肠杆菌高效表达载体pHsh的构建与应用[J].微生物学通报,2012,39(3):394-400. JIANG Yuyao,HE Jiarong,WANG Weiwei,et al.The approach to high production of recombinant protein via pHsh vectors for Escherichia coli[J].Bulletin of Microbiology,2012,39(3):394-400.(in Chinese)
[8]Wu H W,Pei J J,Jiang Y,et al.pHsh vectors,a novel expression system of Escherichia coli for the large-scale production of recombinant enzymes[J].Biotechnol Lett,2010,32(6):795-801.
[9]Vrielink A,Ghisla S.Cholesterol oxidase:biochemistry and structural features[J].Febs J,2009,276(23):6826-6843.
[10]Doukyu N.Characteristics and biotechnological applications of microbial cholesterol oxidases[J].Appl Microbiol Biotechnol,2009,83(5):825-837.
[11]Ernst N D,Cleeman J I.National cholesterol education program keeps a priority on lifestyle modification to decrease cardiovascular disease risk[J].Curr Opin Lipidol,2002,13(1):69-73.
[12]Guo L W,Wilson W K,Pang J,et al.Chemical synthesis of 7-and 8-dehydro derivatives of pregnane-3,17alpha,20-triols,potential steroid metabolites in Smith-Lemli-Opitz syndrome[J].Steroids,2003,68(1):31-42.
[13]Purcell J P,Greenplate J T,Jennings M G,et al.Cholesterol Oxidase-a potent insecticidal protein active against Boll-Weevil Larvae[J].Biochem Bioph Res Co,1993,196(3):1406-1413.
[14]吕陈峰,王龙刚,杨胜利,等.胆固醇氧化酶转化蛋黄胆固醇工艺的优化[J].无锡轻工大学学报,2001,20(6):555-559. LV Chenfeng,WANG Longgang,YANG Shengli,et al.Optimization of enzymatic bioconversion of yolk cholesterol[J]. Journal of Wuxi University of Light Industry,2001,20(6):555-559.(in Chinese)
[15]杨海麟,王长城,张玲,等.产胆固醇氧化酶重组大肠杆菌的发酵培养基和诱导条件的优化[J].食品与生物技术学报,2009,28(5):670-674. YANG Hailin,WANG Changcheng,ZHANG Ling,et al.Optimization of culture conditions for production of Cholesterol Oxidase using recombinant E.coli[J].Journal of Food Science and Biotechnology,2009,28(5):670-674.(in Chinese)
[16]陈亦.胆固醇氧化酶亲和纯化及酶稳定性研究[D].无锡:江南大学,2013.
[17]Modification in media composition to obtain secretory production of STxB-based vaccines using Escherichia coli[J].Virologica Sinica,2013,28(1):43-48.
[18]Li S,Xu H,Yu J,et al.Enhancing isomaltulose production by recombinant Escherichia coli producing sucrose isomerase:culture medium optimization containing agricultural wastes and cell immobilization[J].Bioprocess Biosyst Eng,2013,36(10):1395-1405.
[19]王卓,裴建军,李华钟,等.极耐热性β-葡萄糖醛酸酶的高效表达和酶学性质及其应用[J].生物工程学报,2008,24(8):1407-1412. WANG Zhuo,PEI Jianjun,LI Huazhong,et al.Expression,characterization and application of thermostable β-glucuronidase from Thermotoga maritima[J].Chinese Journal of Biotechnology,2008,24(8):1407-1412.(in Chinese)
[20]张玲.短杆菌胆固醇氧化酶基因的表达研究[D].无锡:江南大学,2013.
Expression of Cholesterol Oxidase with Temperature Induced Vector pHsh
YUAN Ye,ZHANG Ling,SHAO Weilan,WANG Wu,YANG Hailin
(1.Key Laboratory of Industry Biotechnology of Ministry of Education,Jiangnan University,Wuxi 214122,China;2.School of Food and Biological Engineering,Jiangsu University,Zhenjiang 212000,China)
Cholesterol oxidase is of great value to be applied in medicine,food and agriculture.In this study,cholesterol oxidase from Rhodococcus sp.was constructed into the temperature-induced vector pHsh and then by controlling the culture temperature,the gene was successfully expressed in E.coli without adding inducer.The fermentation optimization of cholesterol oxidase was carried out in the shake flask level.With the optimum condition,the enzyme activity reached 855 U/L.When purified to homogeneity using Ni-NTA,the resulting enzyme had the molecular mass of 55 kDa,the optimal pH 7.0 and temperature 40℃.The enzyme was also stable over a pH range of 5.0~7.0,with t1/2of 6.9 min at 50℃.With cholesterol as substrate at pH 7.5 and 37℃,the kinetic parameters Kmand kcat/Kmwere 3.38 mM and 6.09 s-1·mM-1,respectively.
cholesterol oxidase,pHsh,temperature-induced
Q 78
A
1673—1689(2016)03—0272—06
2014-12-25
国家自然科学基金项目(31340027);江南大学自主科研重点项目(JUSRP51402A)。
杨海麟(1971—),男,江苏无锡人,工学博士,副教授,主要从事发酵工程方面的研究。E-mail:19891996@sina.com

