石墨烯助剂与Ni活性位点协同增强TiO2制氢性能
张超颖 王苹 刘岩岩 胡灵娜
(武汉理工大学化学化工与生命科学学院应用化学系,武汉430070)
张超颖 王苹*刘岩岩 胡灵娜
(武汉理工大学化学化工与生命科学学院应用化学系,武汉430070)
采用水热法和低温浸渍法制备了电子助剂还原石墨烯(rGO)和界面活性位点Ni共修饰的高效TiO2光催化剂(简称Ni/TiO2-rGO)。制氢性能测试结果表明:相比于TiO2和单独还原石墨烯复合的TiO2,经还原石墨烯与Ni协同修饰后的TiO2表现出更高的光催化制氢性能。其中,Ni/TiO2-rGO(0.1mol·L-1)具有最高制氢性能,制氢速率达到77.0μmol·h-1,分别是TiO2(16.4 μmol·h-1)和TiO2-rGO(28.0μmol·h-1)的4.70倍和2.75倍。还原石墨烯助剂与Ni活性位点协同增强制氢性能的原理是:还原石墨烯作为电子助剂可以快速捕获和传输电子,Ni作为界面活性位点可以从溶液中捕获H+,提高界面反应速率,2种助剂协同作用加快了TiO2上的光生电子-空穴对的有效分离。
TiO2;协同效应;还原石墨烯;电子助剂;Ni;界面活性位点
21世纪以来,人类对于能源的需求越来越大,世界能源危机日益突出。因此,开发新型能源成为了各国科学家研究的热点。在各种新能源中,氢能因其储量大、产物无污染、利用形式多样等优点受到人们的青睐[1]。光催化分解水制氢的方法在众多获得氢能的途径中能够从根本上解决能源问题,是制备氢能最为理想的方法之一[2]。自1972年,由日本东京大学Fujishima和Honda两位教授首次报道发现TiO2半导体光催化分解水从而产生氢气这一现象,揭示了利用太阳能直接分解水制氢的可能性,也掀起了有关半导体光催化制氢研究的热潮[3]。TiO2虽然具有性能稳定、无毒、对环境无污染、抗化学和抗光腐蚀等优点,但却存在着光激发产生的电子-空穴对极易复合和量子效率较低的问题[4-5]。目前,采用各种方法对TiO2进行改性是增强光催化制氢性能的重要研究方向。常用的改性方法有染料敏化[6]、离子掺杂[7-8]、半导体复合[9]、助剂修饰[10]等等。
近期研究表明,石墨烯与光催化剂复合是一种有效提高光催化性能的改性方式[11-14]。本课题组之前的工作[15]采用一步水热法制备了还原石墨烯复合二氧化钛(简称TiO2-rGO)复合光催化剂,相比于TiO2具有优异的光催化性能。另外,张晓艳等[16]采用溶胶-凝胶法制备了TiO2与石墨烯复合光催化材料,在紫外-可见光照射下,复合光催化剂的光催化制氢活性是TiO2的2倍。这些研究证明石墨烯能够快速传输TiO2产生的光生电子,提高光生电子-空穴对的分离效率。另一方面,助剂修饰光催化剂被认为是一种有效提高光催化剂制氢性能的方法[17-18]。本课题组之前采用低温溶液浸渍法以Fe[19]、Ti[20-21]、Cu[22-23]和Ni[20]等助剂作为界面活性位点促进氧化还原反应进一步提高了光催化性能。显然,如果能结合石墨烯优越的电子传输特性和Ni等助剂的高界面活性,将可进一步提高半导体材料的光催化性能。本文采用水热法和浸渍法结合的方式,制备了高分解水析氢活性的石墨烯和Ni共修饰的Ni/TiO2-rGO复合光催化剂,分析了石墨烯和Ni协同作用提高TiO2制氢性能的机理。
1 实验部分
1.1 主要试剂
试剂Ni(NO3)2·6H2O和乙醇为分析纯,购于上海化学试剂公司。商业P25 TiO2购于Degussa公司。所有用水均为去离子水。氧化石墨稀(GO)为本课题组自制,方法见文献[15]。
1.2 样品制备
1.2.1 TiO2的制备
称取一定量的TiO2置于坩埚中,将坩埚放入马弗炉中,在550℃下煅烧2 h(升温速率为5℃· min-1),待坩埚冷却后取出。
1.2.2 GO分散液的制备
称取0.5 g GO在搅拌条件下加入到1 L蒸馏水中,超声3 h,得到浓度约为0.5 mg·mL-1的GO分散液。
1.2.3 TiO2-rGO的制备
将0.2 g TiO2加入4 mL GO分散液中搅拌0.5 h,制成1%(wGO/wTiO2)TiO2-GO分散液。将溶液转入聚四氟乙烯内衬的水热反应釜中,放入180℃烘箱反应12 h后,冷却至室温后取出。所得产物经抽滤并用去离子水洗涤3次,再放入60℃烘箱内干燥2 h,得到TiO2-rGO。
将0.2 g制备好的TiO2-rGO复合光催化剂,加入10mL不同浓度的Ni(NO3)2溶液中,在75℃条件下搅拌2 h。所得产物经抽滤并用去离子水洗涤3次,放入60℃烘箱内干燥2 h,得到Ni/TiO2-rGO复合光催化剂。当Ni(NO3)2溶液为分别为0.01、0.05、0.1和0.5 mol·L-1时,样品编号分别为Ni/ TiO2-rGO(X),X代表0.01、0.05、0.1和0.5。
1.3 光催化制氢性能测试
光催化制氢性能测试参考文献的方法进行[21]。具体步骤如下:在150mL的三口烧瓶中加入50mg催化剂,分散到80 mL含25%(V/V)乙醇的水溶液中。整个装置至于磁力搅拌机上,反应过程中溶液一直处于搅拌状态,转速在制氢过程中保持不变。光催化反应前,体系通氮气15 min,以便除去杂质气体。光催化反应过程中,以4个365 nm的LED灯为光源照射,反应容器放置的位置距离光源1 cm,每照射30 min测一次氢的含量,共测试120 min。产生的H2含量由GC-2014C(日本,岛津)气相色谱仪取样分析。
1.4 电化学测试
采用一个标准三电极系统的电导仪(CHI660E)测试样品电化学数据,其中Pt作为对电极,标准Hg/Hg2Cl2(浸泡在饱和KCl溶液中)作为参比电极,Na2SO4(0.5mol·L-1)溶液作为电导液。灯源是一个3 W LED灯(波长为365 nm,光强为80mW·cm-2)。工作电极是光催化剂采用旋涂方法负载在导电玻璃(FTO)表面制备。具体过程为:10mg的样品加入到1mL的无水乙醇和1mL的萘酚D-520溶液(5%)混合溶液中,超声至形成均一悬浮液。悬浮液通过旋转涂膜仪均匀涂在FTO上,放入烘箱中在60℃条件下干燥12 h。工作电极的光电流曲线(i-t)在0.5 V的基本电压和5次循环光照条件下测出,其中间隔60 s光照为一次循环。
1.5 样品表征
表征样品晶体结构的X射线衍射图(XRD)采用日本Rigaku公司生产的D/Max-RB型X射线粉末衍射仪测定(Cu Kα,λ=0.154 nm,U=40 kV,I=80mA, 2θ=5°~80°);表征样品形貌特征采用日本Hitachi公司的Quanta x50型的场发射扫描电子显微镜(FESEM);样品的TEM图谱采用日本JEOL公司的JEM-2100F透射电子显微镜;样品的紫外可见吸收光谱采用日本Shimadzu公司生产的型号为UV-2550的紫外-可见分光光度计测定,测试标样为BaSO4;样品的X射线光电子能谱分析光谱(XPS)的数据是由英国KRATOA公司的XSAM800XPS系统测定,X射线采用Mg Kα为辐射源,样品的结合能都以来自仪器本身的油污染碳(C1s,Eb=284.8 eV)为内标进行荷电校正;采用英国Renishaw公司的INVIA拉曼光谱仪测定样品的拉曼光谱。
2 结果与讨论
2.1 样品的微结构分析
图2是不同样品的XRD图。从图2a中可以看出,TiO2为锐钛矿和金红石混合(JCPDS 99-0008和99-0090),与原料P25相符。与rGO复合(图2b)后及进一步负载Ni(图2c~d)后,样品的XRD与原TiO2无明显差异,说明复合与负载不影响TiO2的晶型和晶化程度。
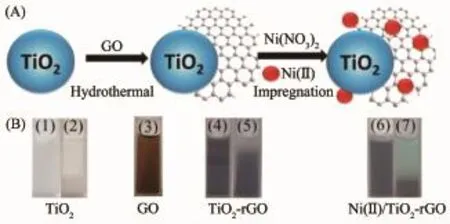
图1 Ni/TiO2-rGO合成示意图(A)和样品照片(B)Fig.1 Graphical illustration for the synthesis of nanocomposite(A)and photographs of various samples(B)
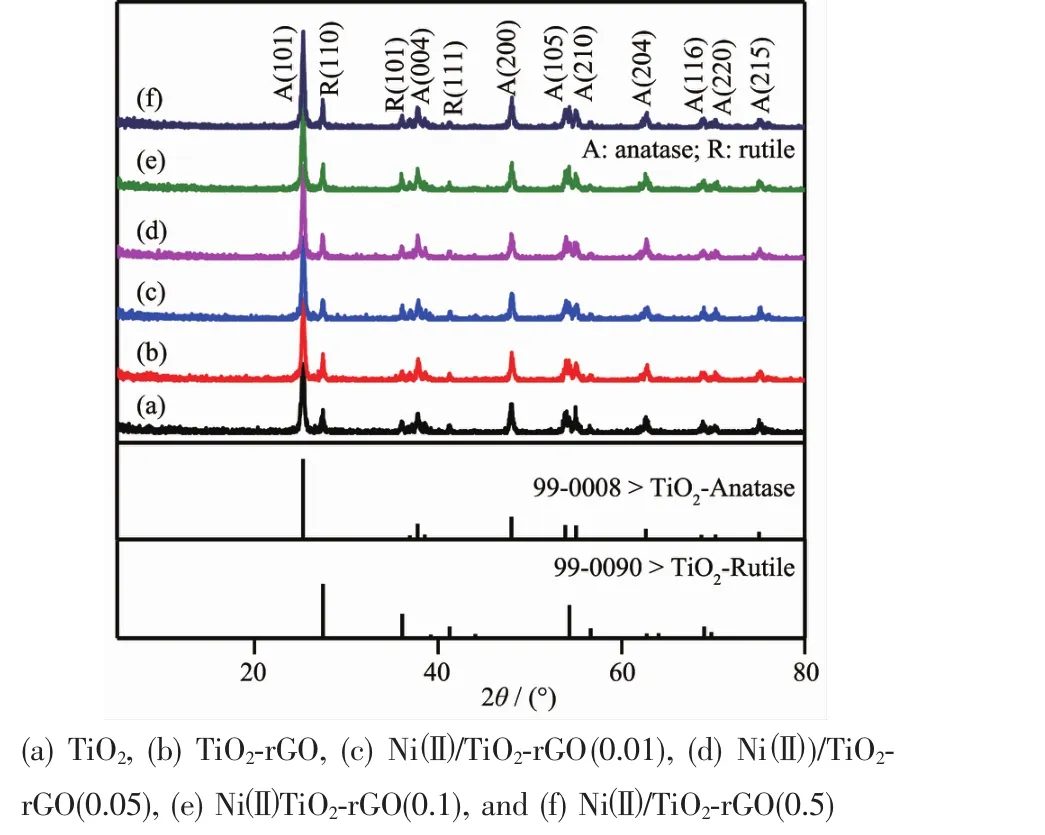
图2 不同样品的XRD图Fig.2 XRD patterns of different samples

图3 不同样品的场发射扫描电镜图(A~D)和Ni/ TiO2-rGO(0.5)TEM图(E,F)Fig.3 FESEM/EDX of different samples and TEM images of Ni/TiO2-rGO(0.5)(E,F)
图3 A~D是不同样品的场发射扫描电镜图。从图3A可以看出TiO2是颗粒状的,大小为20~50 nm。图3B表明TiO2与石墨烯复合之后颗粒大小没有明显变化,由EDX插图可以得知C元素来自于还原石墨烯。图3C和图3D是进一步用Ni修饰的TiO2-rGO样品,可以看出颗粒大小与图3A的TiO2相近,而且薄纱状的石墨烯表面附着大量TiO2颗粒,说明还原石墨烯与TiO2成功复合。由插图中的EDX表还可以看出样品中含有微量的Ni元素,且高浓度Ni(NO3)2溶液浸渍的Ni元素含量高于低浓度浸渍。从Ni/TiO2-rGO的TEM图(图3F)可以清晰地观察到TiO2(101)面的晶格条纹,间距为0.350 nm。而Ni则以无定型氧化物形式负载在TiO2表面。结合扫描电镜和透射电镜的结果,可以证明本研究成功制备了石墨烯与Ni共修饰的TiO2复合光催化剂。
图4A是TiO2、TiO2-rGO和Ni/TiO2-rGO(0.1)的XPS全谱图,该图谱表明了样品的元素组成。位于289、473和534 eV的特征谱峰分别归属于C1s、 Ti2p和O1s的结合能,说明3种样品都含有Ti、O和C元素。Ti和O元素主要存在于TiO2中。图4B是Ni元素进行高分辨扫描所得的谱图。与TiO2(图4B(a))和TiO2-rGO(图4B(b)对比,可明显看到Ni/ TiO2-rGO(0.1)(图4B(c))在854和874 eV处有Ni2p3/2和Ni2p1/2的特征峰,说明了Ni元素的存在,也同时表明了Ni以+2价态的无定型NiO或NiO(OH)形式存在[24]。图4C是C元素XPS谱图。与GO(图4C(a))对比,可看出图4C(b)和图4C(c)对应样品TiO2-rGO和Ni/TiO2-rGO(0.1)中含氧官能团C-OH、C-O-C、C=O和HO-C=O强度明显下降,说明含氧基团减少,氧化石墨烯被还原为还原石墨烯[15]。

图4 不同样品的XPS谱:(A)全谱、(B)Ni元素谱和(C)C元素谱Fig.4 XPS spectra of(A)survey,(B)Nielementand(C)C elementof different samples

图5不同样品的拉曼光谱图Fig.5 Raman spectra of different samples
图5 所示为4种样品的拉曼光谱。在TiO2(图5A(a))结构中拉曼峰在148 cm-1(Eg(1))、400 cm-1(B1g)、510 cm-1(A1g)和639 cm-1(Eg(2))处显示出很强的特征峰,与之前文献一致[19]。图5A(b)、图5A(c)、图5A(d)和图5A(e)都在1 340和1 605 cm-1处出现了石墨烯的D峰和G峰。图5B比较了D峰与G峰相对强度ID/IG。由图可知,相比于GO(0.942),TiO-rGO (1.044)、Ni/TiO2-rGO(0.1)(1.062)和Ni/TiO2-rGO (0.5)(1.021)显示了更高的ID/IG,表明水热后得到的rGO有更多sp3缺陷,这些缺陷与表面强作用力(如Ti-O-C键)的形成相关[19]。而当TiO2与rGO复合后TiO2本身的特征峰略有减弱,可能是因为少量rGO在TiO2表面掩盖了TiO2部分拉曼信息所致。综上所述,拉曼光谱中D峰与G峰为rGO与TiO2复合提供了明确的证据。
图6为不同样品的紫外可见漫反射光谱,插图为对应的样品。图6a可知TiO2样品的吸收边在410 nm左右,样品呈白色(插图a)。图6b是还原石墨烯与TiO2复合的样品的紫外可见漫反射光谱,样品呈灰黑色(插图b),吸收边略有红移,可能是由于还原石墨烯与TiO2之间形成了Ti-O-C键的原因[15]。图6c、d、e和f是不同Ni浓度的Ni/TiO2-rGO样品紫外可见漫反射光谱,其颜色也呈灰黑色(插图d、e),与TiO2-rGO样品颜色相似,吸收边也几乎相同。因此,Ni助剂对TiO2-rGO吸收光谱并无影响。

图6 不同样品的紫外-可见漫反射光谱Fig.6 UV-Vis diffuse reflectance spectra of different samples
2.2 光催化制氢性能及光催化制氢机理
图7是不同样品制氢速率柱状图。图7a表示TiO2的制氢速率,对应数值为16.4μmol·h-1。图7b是TiO2-rGO的制氢速率,数值为28.0μmol·h-1。从图7c~f中可以看出,在还原石墨烯含量相同的情况下(1%,w/w),NiTiO2-rGO复合光催化剂制氢速率明显高于TiO2-rGO和TiO2光催化剂。当Ni的浓度从0.01mol·L-1增加到0.1mol·L-1,样品的光催化制氢速率逐步提升,并达到最高制氢速率(77.0 μmol·h-1),分别是TiO2样品和TiO2-rGO样品的4.70倍和2.75倍。当Ni的浓度增加到0.5mol·L-1时,制氢速率相比0.1mol·L-1时虽略有下降,但依然比TiO2和TiO2-rGO的制氢速率要高。因此可以得出,还原石墨烯与Ni作助剂共同修饰的TiO2光催化制氢性能比TiO2和TiO2-rGO复合光催化剂的制氢性能都有显著提高。

图7 不同光催化剂的制氢速率图Fig.7 Photocatalytic H2-production activity of different samples

图8制氢循环性能图Fig.8 Cycling runs of the photocatalytic H2-production activity of the samples

图9 Ni/TiO2-rGO光催化制氢机理示意图Fig.9 Photocatalytic H2-productionmechanism of Ni/TiO2-rGO
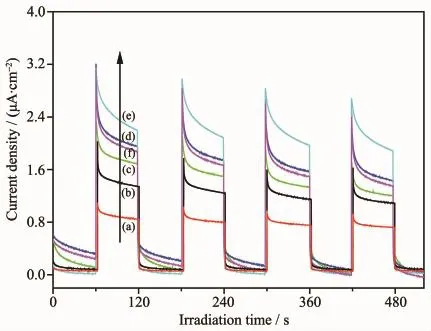
图10 不同样品的光电流Fig.10 Transient photocurrent response of different samples
3 结论
[1]Preethi V,Kanmani S.Mater.Sci.Semicond.Process.,2013, 16:561-575
[2]Ismail A A,Bahnemann DW.Sol.Energy Mater.Sol.Cells, 2014,128:85-101
[3]LICao-Long(李曹龙),WANG Fei(王飞),TANG Yuan-Yuan (唐媛媛),et al.Chinese J.Inorg.Chem.(无机化学学报), 2016,32:1375-1382
[4]YANG Xu(杨旭),LIXiao-Long(李小龙),HU Cai-Hua(胡彩花),et al.Chinese J.Inorg.Chem.(无机化学学报),2015,31:2167-2173
[5]NiM,Leung M K H,Leung D Y C,et al.Renewable Sustainable Energy Rev.,2007,11:401-425
[6]Wang P,Wang J,Ming T,etal.ACSAppl.Mater.Interfaces, 2013,5:2924-2923
[7]Le T T,Akhtar M S,Park D M,et al.Appl.Catal.,B,2012, 111-112:397-401
[8]Han C,Wang Y,Lei Y,etal.Nano Res.,2014,8:1199-1209
[9]Li K,Chai B,Peng T,etal.ACSCatal.,2013,3:170-177
[10]Tanaka A,Sakaguchi S,Hashimoto K,et al.ACS Catal., 2013,3:79-85
[11]Xiang Q,Yu J,Jaroniec M.J.Am.Chem.Soc.,2012,134: 6575-6578
[12]GUO Dan(郭丹),WANG Ping(王苹),ZHENG Qi-Ying(郑琪颖),et al.J.Inorg.Mater.(无机材料学报),2014,29:1193-1198
[13]Wang F,Zheng M,Zhu C,et al.Nanotechnology,2015,26: 345402-345410
[14]Chen D,Zou L,Li S,etal.Sci.Rep.,2016,6:20335-20343
[15]Wang P,Wang J,Wang X,et al.Appl.Catal.,B:Environ., 2013,132-133:452-459
[16]Zhang X Y,Li H P,Cui X L,et al.J.Mater.Chem.,2010, 20:2801-2806
[17]Li Z,Xiao JD,Jiang H,L.ACSCatal.,2016,6:5359-5365
[18]Indra A,Menezes PW,Kailasam K,et al.Chem.Commun., 2016,52:104-111
[19]Yu H,Tian J,Chen F,etal.Sci.Rep.,2015,5:13083-13094
[20]Yu H,Huang X,Wang P,et al.J.Phys.Chem.C,2016, 120:3722-3730
[21]Wang P,Lu Y,Wang X,et al.Appl.Surf.Sci.,2017,391: 259-266
[22]WANGMing-Fang(王明芳),WANG Ping(王苹),XU Shun-Qiu(徐顺秋),et al.Chinese J.Inorg.Chem.(无机化学学报),2015,31:1981-1986
[23]Wang P,Xia Y,Wu P,et al.J.Phys.Chem.C,2014,118: 8891-8898
[24]Yu J,Hai Y,Cheng B.J.Phys.Chem.C,2011,115:4953-4958
[25]Wang J,Xu F,Jin H,et al.Adv.Mater.,2017,DOI:10.1002/ adma.201605838
Synergistic Effect of Graphene as Electron-Transfer M ediator and Nias Interfacial Catalytic Active Site for Enhanced H2-Production Performance of TiO2
ZHANG Chao-Ying WANG Ping*LIU Yan-Yan HU Ling-Na
(School of Chemistry,Chemical Engineering and Life Science,Wuhan University of Technology,Wuhan 430070,China)
Highly efficient TiO2photocatalysts co-modified by reduced graphene oxide(rGO)as electron-transfer mediator and Nias interfacial catalytic active-sites(referred to as Ni/TiO2-rGO)were synthesized via a twostep process including the initial hydrothermal method of rGO on the TiO2surface and the following lowtemperature impregnation method of Nion the rGO.Photocatalytic experimental results indicated that all resulted Ni/TiO2-rGO photocatalysts exhibited obviously high H2-production performance.The highest H2-production rate of the resultant Ni/TiO2-rGO(0.1mol·L-1)reached 77.0μmol·h-1,while this value was higher than that of the TiO2(16.4μmol·h-1)and TiO2-rGO(28.0μmol·h-1)by a factor of 4.70 and 2.75,respectively.On the basis of the experimental results,a synergistic effectmechanism of rGO and Nibi-cocatalysts was proposed to account for its enhanced H2-production performance,namely,rGO functions as an electron-transfermediator to rapidly capture and transfer the photogenerated electron from TiO2surface,while the Nicocatalyst serves as an effectively active site for the following reduction.
TiO2;synergistic effect;reduced graphene oxide(rGO);electron-transfermediator;Ni;interfacial catalytic active-site
O643
A
1001-4861(2017)07-1132-07
10.11862/CJIC.2017.170
2017-03-21。收修改稿日期:2017-06-15。
国家自然科学基金(No.21477094)和国家级大学生创新创业训练计划项目(No.20161049720001)资助。*
。E-mail:wangping0904@whut.edu.cn

