溶胶-凝胶法合成Li1-xNaxM n2O4及其作为水系锂离子电池正极材料的电化学性能
陶洪亮 米常焕 张迎霞
(南京航空航天大学材料科学与技术学院,江苏省能量转换材料与技术重点实验室,南京210016)
溶胶-凝胶法合成Li1-xNaxM n2O4及其作为水系锂离子电池正极材料的电化学性能
陶洪亮 米常焕*张迎霞
(南京航空航天大学材料科学与技术学院,江苏省能量转换材料与技术重点实验室,南京210016)
用溶胶凝胶法合成了Na+离子掺杂的Li1-xNaxMn2O4(x=0,0.01,0.03,0.05)。X射线衍射图表明Na+取代Li+进入Li1-xNaxMn2O4晶格中,扫描电镜图看出产物是粒径为100~300 nm的颗粒。恒流充放电测试结果表明,Li0.97Na0.03Mn2O4在2C倍率下循环100圈后放电容量保持率比未掺杂的LiMn2O4从51.2%提升到84.1%。循环伏安测试表明Na+离子掺杂降低了材料极化且增大了锂离子扩散系数。10C倍率下Li0.97Na0.03Mn2O4仍有79.0mAh·g-1的放电容量,高于未掺杂样品的52.1mAh·g-1。Na+离子掺杂可以稳定材料结构并提高锂离子扩散系数,从而提高LiMn2O4的电化学性能,是一种可行的改性方法。
水系锂离子电池;Na+掺杂;LiMn2O4
0 引言
近年来,随着石油,煤等不可再生能源的不断消耗环境污染等问题的日益严峻,锂离子电池作为二次能源越来越得到关注[1-3]。锂离子电池已经被广泛应用于手机、笔记本等便携设备的领域,但在需要大规模储能的场合发展相对缓慢,由于锂离子电池所使用的有机电解液存在着导电性较差,环境污染,可燃性,成本较高等缺点,Dahn等[4]为了改善上述有机电解液的缺点,在1994年提出了与有机系锂离子电池机理类似的水系锂离子电池的概念。水系电池一经提出便吸引了研究者们的目光,研究者们开始将有机系中适用的正极材料尝试在水系中使用[5-8]。然而,水系锂离子电池也存在着循环性能差,能量密度低等问题,并且所选用的正极材料的充放电电压窗口必须在水电解液所允许的范围内,不可发生析氧或析氢反应,因此水系电池的发展速度并不快。目前,水系锂离子电池已经有了多种可行的正极材料,如LiMn2O4[9]、LiCoO2[10]、LiFePO4[11]、MnO2[12]等。LiMn2O4作为锂离子电池正极材料具有生产成本低,环境友好,锰元素储量丰富等优点,然而LiMn2O4作为正极材料,其循环性能差,容量衰减速度快。因此研究者们为了改性材料的性能而做了大量的工作[13-14]。
将一种元素掺杂到材料中,可能会影响材料中元素的化合价,材料的晶胞大小等等,无论是何种影响都会改变材料固有的性能,因此研究者们常用体相掺杂的方法来改善材料的性能。Kraytsberg等[15]通过计算得出少量的元素掺杂到材料晶格中不会改变材料固有的尖晶石的结构并且可以改善材料电化学性能的结论。研究者们尝试使用Al、Ni、Co、Fe、Mg等多种元素掺杂到材料中并改善了材料的性能[16-21]。若用碱金属离子掺杂Li+可能会产生不同的结果,因此研究者们使用Na+来掺杂LiFePO4、LiNi0.5Mn0.5O2、Li1.16Ni0.18Mn0.548Co0.105O2[22-24],也提高了材料的性能。在LiMn2O4的晶胞中,四面体位点全部被Li+占去,因此材料在充电完毕完全脱锂后,材料的结构将变得非常不稳定,因此我们想通过Na+掺杂来稳定材料在完全脱锂后的结构,提高材料的稳定性,并且由于Na+半径比Li+大[25],掺杂Na+后可以增大材料的晶格尺寸,为Li+在材料中传输提供新的通道。我们通过一步溶胶凝胶法合成Li1-xNaxMn2O4(x=0,0.01,0.03,0.05)材料,并测试其性能以确定Na+离子掺杂对LiMn2O4产生的影响。
1 实验部分
1.1 样品合成
采用一步溶胶凝胶法制备Na+掺杂的Li1-xNaxMn2O4:将醋酸锂、醋酸锰、醋酸钠、柠檬酸、葡萄糖以物质的量1.05(1-x)∶2∶x∶1∶2的比例溶解在100mL去离子水中,将得到的混合溶液先在室温下搅拌15 h,再在80℃搅拌4 h,随后放入干燥箱中80℃干燥12 h即得深褐色凝胶。将凝胶在管式炉中空气氛下先400℃预烧4 h,然后取出研磨均匀后再空气氛下800℃煅烧8 h即得所需要的样品。
1.2 物相表征与电化学性能测试
X射线衍射分析(XRD)测试采用D8 advance-X射线衍射仪(德国Bruker公司制造),以Cu Kα(λ= 0.154 18 nm)为射线源,管电压和管电流分别采用40 kV、40 mA,2θ=10°~80°。采用德国NETZSCH STA 409 PC热重分析仪测试,空气气氛下,以10℃·min-1的速率升温。采用日本HITACHI公司生产的S-4800型电场发射式-扫描电子显微镜(FE-SEM)来观察材料的微观形貌。
使用三电极体系进行电化学测试。将所制备材料:乙炔黑:PTFE以8∶1∶1质量比混合搅拌至均匀浆料后涂覆在不锈钢网上,放入烘箱于60℃干燥8 h即得工作电极。铂电极作对电极,饱和甘汞电极(saturated calomel electrode,SCE)作参比电极,用5 mol·L-1LiNO3水溶液作电解液。恒流充放电测试在武汉蓝电CT2001A电池测试仪(LAND Electronic Co.)上进行,电位区间为0~1.1 V。使用上海辰华CHI760进行循环伏安测试,扫描范围为0~1.4 V,扫描速度为1、2、5、10mV·s-1。
2 结果与讨论
2.1 材料的物理性质
图1是制备Na+掺杂的Li1-xNaxMn2O4示意图,用Na+取代原来晶格中8a位点的Li+,由于在充放电过程中所掺杂的Na+不会参与脱嵌,因此Na+可以在材料完全脱锂后继续存在在晶格中支撑材料的晶格结构,从而提高材料的循环性能。

图1 Li1-xNaxMn2O4的制备示意图Fig.1 Preparation of Li1-xNaxMn2O4
图2 是所合成的Li1-xNaxMn2O4(x=0,0.01,0.03,0.05)样品的XRD图,从图中的衍射峰可以看到合成的所有样品都属尖晶石,Fd3m空间群。衍射峰强度大,峰形尖锐,这表明晶体生长完好。与LiMn2O4(PDF.35-0782)的标准卡片对比可以看出所合成样品的衍射峰与标准卡片一致,说明合成出纯相的LiMn2O4材料。Na+和Li+的离子半径[25]分别为0.099和0.059 nm,当Na+掺入四面体位点代替部分Li+时,会使材料的晶胞体积增大,随着x值的渐渐增大,样品并没有出现杂峰,说明尖晶石的晶胞可以完全容纳掺杂进去的Na+代替Li+。而在x=0.05时,XRD图中出现新相,这主要是因为掺杂的量太大导致Na+无法全部进入LiMn2O4晶格中,从图中可以看出多余无法进入晶格中的Na+以Na4Mn9O18的形式存在。使用Jade5软件计算材料的晶胞参数a,x= 0、0.01、0.03、0.05时材料的晶胞参数a分别等于0.824 40、0.824 53、0.824 68、0.824 37 nm,可以看出随着Na+的掺杂量增大,材料的晶胞参数也在随之增大,而在x=0.05时材料的晶胞参数反而减小,这可能是由于体系中无法掺入晶格中的Na+与晶格中本来含有的Mn形成了Na4Mn9O18杂相导致晶格中的本来锰变少,使材料的晶胞参数减小。
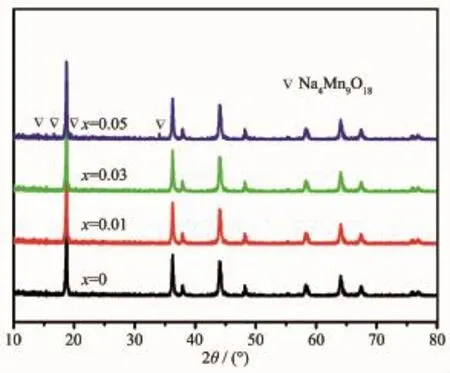
图2 Li1-xNaxMn2O4(x=0,0.01,0.03,0.05)的XRD图Fig.2 XRD pattern of Li1-xNaxMn2O4(x=0,0.01,0.03,0.05)
为了分析在煅烧过程中前驱体凝胶的反应过程以便确定预烧结的温度,我们对前驱体进行了热重分析,温度范围为25~800℃。图3是前驱体凝胶的热重曲线,从图中可以看出25~175℃的质量分数流失为22.43%,为水和柠檬酸的分解,175~375℃的质量分数流失为56.51%,是醋酸盐和葡萄糖的分解过程,375~800℃的过程中,样品的质量不再下降,剩余为锂锰氧化物,质量分数为21.06%。根据实验开始时投入的反应物质量计算锂锰氧化物的质量,与最后剩余21.06%的结果相符,前驱体凝胶在400℃可以完全分解成锂锰的氧化物,因此选择在400℃进行预烧。

图3前驱体凝胶25~800℃的热重曲线Fig.3 TG curve for precursor gel(25~800℃)
图4 为Li1-xNaxMn2O4(x=0,0.01,0.03,0.05)的SEM图。从图中可以看出样品为均匀且形状相似的颗粒,说明Na+掺杂不会改变材料的形貌。颗粒之间有略微的团聚,颗粒的粒径在100~300 nm之间,随着掺Na+的量逐渐增加,材料的颗粒粒径逐渐减小,这可能是由于Na4Mn9O18杂相的存在,在烧结过程中阻碍了尖晶石颗粒的生长[26]。

图4 Li1-xNaxMn2O4样品的SEM照片Fig.4 SEM image of Li1-xNaxMn2O4
2.2 材料的电化学性质
为了研究Na+掺杂对材料电化学性能的影响,分别使用Li1-xNaxMn2O4(x=0,0.01,0.03,0.05)装配水系电池测试其充放电性能。图5a为Li1-xNaxMn2O4(x= 0,0.01,0.03,0.05)在2C电流密度下的首圈充放电曲线,充放电电位窗口为0~1.1 V,可以看出4个样品充放电曲线的形状是类似的,充电和放电平台都有2个,与CV曲线中出现的2对氧化还原峰结果相一致,说明Na+掺杂不影响材料的充放电机理。4个样品首圈的库伦效率分别是82.9%、93.2%、89.6%、81.6%,对比发现掺杂Na+后,材料的首圈库伦效率有所提升,原因可能是Na+在材料完全脱锂后支撑住材料的结构,使锂离子能更好的可逆嵌入材料中,而x=0.05时材料的库伦效率反而比x=0时更低,可能是因为Na+的掺杂量过大生成杂相,晶格中本身的锰脱出晶格,使材料的结构变得不稳定,导致锂离子在充电完毕后无法嵌回材料晶格中,反而降低了材料的库伦效率。图5b为Li1-xNaxMn2O4(x=0、0.01、0.03、0.05)在2C电流密度下常温充放电100圈的循环性能图,充放电的电压范围为0~1.1 V。4个样品的首圈放电比容量分别为113.5、106.8、103.8、99.5mAh·g-1,可以看出在掺杂Na+后,材料的首圈放电比容量有所降低,这是因为掺杂在晶格中的Na+在充放电的过程中不进行脱嵌,导致材料的首圈放电容量有所降低。在充放电100圈后,4个样品的容量保持率分别为51.2%、67.7%、84.1%、80.5%,可以看出随着x值的增大,材料的容量保持率也逐渐增大,这是因为Na+掺杂后可以提高材料的稳定性,特别是在完全脱锂以后,材料在完全脱锂后存在的形式可以写成Mn2O4,进行Na+掺杂以后的存在形式可以写成Nax[Mn2O4],Na+留在材料中支撑材料的结构,这有利于提高材料的循环性能。在x=0.03时,材料的容量保持率最大,而x=0.05时容量保持率反而降低,这是因为x=0.05时材料体系中未能掺入晶格中的Na+与晶格中本身的Mn产生了Na4Mn9O18杂相,使原本材料的存在形式转变成Li1-yNay[Mn2-zLiz]O4,即晶格中锰的含量反而降低,这导致了材料的结构变得不稳定,尖晶石相的含量进一步减少,使其损失了较多的首圈容量并且循环性能不佳。因此掺杂量x=0.03时材料的性能最佳。

图5 Li1-xNaxMn2O4的电化学性能图(a)首圈的充放电曲线(b)Li1-xNaxMn2O4的循环性能Fig.5 Electrochemical performance of Li1-xNaxMn2O4(a)charge and discharge figure of 1st cycle(b)cycle performance of Li1-xNaxMn2O4
为了研究材料充放电的电化学机理,对材料进行了循环伏安测试,测试的电压范围为0~1.4 V,扫速为1~10mV·s-1,图6a,b是LiMn2O4和Li0.97Na0.03Mn2O4两个样品的CV曲线。从图中可以明显看出掺杂前后的样品,都具有两对氧化还原峰,与材料充放电时脱嵌锂的两步反应和充放电曲线中的电压平台相对应。随着扫速的增加,峰电流也随着增加,氧化峰的峰电位会增大,还原峰的峰电位会减小,这代表氧化峰和还原峰分离,而峰分离越明显,也就说明材料的极化越明显,这是因为材料的尖晶石结构本身锂的扩散速度不够快。而从图中可以看出在掺杂Na+以后材料的极化要比掺杂Na+以前小,这说明掺杂Na+加快了Li+的扩散速度,减小了材料的极化。研究者们普遍认为锂离子的扩散速度是影响材料电化学性能的关键,为了探究Na+掺杂对材料中锂离子扩散的影响,锂离子的扩散系数DLi可以通过CV来测定,并通过下式计算:
Ip=2.69×105×n3/2ADLi1/2CLiv1/2(1)式(1)中Ip为峰电流(A),n为电荷转移个数,A为电极和电解液的接触面积(cm2),CLi为材料中Li+的浓度(mol·cm-3),v为扫速(V·s-1)。将2个样品不同扫速下的峰电流与对应扫速的平方根作图如图5c,d,从图中Ip和v1/2的线性关系可以看出LiMn2O4中锂离子的脱嵌在动力学上受锂扩散控制[25],因此可以根据式(1)来计算Li+的扩散系数(其中以LiMn2O4的理论容量为148mAh·g-1可以算出CLi=0.023 78 mol· cm-3)[27]。2个样品的扩散系数计算后列出表1,分别为DO1、DO2、DR1、DR2。由扩散系数的结果可以看出材料在掺杂过后,锂离子的扩散系数至少提升了25%,说明Na+的掺杂增大了Li+的扩散通道,提高了锂离子的扩散系数。

图6 LiMn2O4和Li0.97Na0.03Mn2O4的CV曲线和扫速平方根-峰电流图(a,c)LiMn2O4(b,d)Li0.97Na0.03Mn2O4Fig.6 CV curve and v1/2-I pattern for LiMn2O4and Li0.97Na0.03Mn2O4(a,c)LiMn2O4(b,d)Li0.97Na0.03Mn2O4

表1 LiM n2O4和Li0.97Na0.03M n2O4的锂离子扩散系数计算结果Table 1 Calculation results of lithium ion diffusion coefficient for LiM n2O4and Li0.97Na0.03M n2O4

图7 LiMn2O4和Li0.97Na0.03Mn2O4的倍率性能(a)倍率性能(b)标准化容量Fig.7 Rate performance of LiMn2O4and Li0.97Na0.03Mn2O4(a)rate performance(b)standardized capacity
由于Na+掺杂增大了Li+的扩散通道,因此测试了LiMn2O4和Li0.97Na0.03Mn2O4的倍率性能,图7a是 LiMn2O4和Li0.97Na0.03Mn2O4的倍率性能图,从图中可以看出,随着电流密度从1C增大到10C,由于材料尖晶石的结构自身锂传输的速度有限,样品的比容量表现出不同程度的衰减。然而明显可以看出Li0.97Na0.03Mn2O4性能要好于LiMn2O4,即使在10C的电流密度下,Li0.97Na0.03Mn2O4放电容量依然有79.0 mAh·g-1,而LiMn2O4只剩下52.1mAh·g-1,这是因为LiMn2O4的尖晶石结构本身传锂能力有限,而Na+的掺杂增大了材料的晶胞尺寸,增大了Li+的扩散通道,提高了材料的传锂能力。最后的5圈回到1C电流密度下,掺杂前后的样品相比于起始5圈的容量保持率分别为79.2%和84.7%,容量保持率的提高说明Na+的掺杂也可以使材料的结构更加稳定。为了更直观的比较,将样品不同倍率的标准化容量作7b图,从图中可以看出在10C的电流密度下,未掺杂的样品容量相比10C时仅剩余48.6%,而掺杂量x=0.03的样品还剩下76.0%,这说明Na+掺杂改善了材料的倍率性能。对比循环性能和倍率性能,与Kim等在综述中提到关于水系LiMn2O4正极的性能基本持平[28]。
3 结论
由于LiMn2O4材料在充电完毕完全脱锂后,材料的结构会变得不稳定,因此想在材料中进行Na+掺杂以求在材料完全脱锂后可以起到稳定材料结构的作用,并且由于Na+半径大于Li+,Na+掺杂也可以增大晶格尺寸,使Li+的扩散通道增大,加快Li+扩散。我们采用溶胶凝胶法成功地制备了Na+掺杂的Li1-xNaxMn2O4(x=0,0.01,0.03,0.05)材料。XRD测试发现所掺杂的Na+进入晶格中,SEM测试显示材料为粒径100~300 nm的均匀颗粒。对材料进行了电化学性能测试,材料Li0.97Na0.03Mn2O4具有最佳性能,在常温下2C的电流密度100圈,Li0.97Na0.03Mn2O4的放电容量保持率比未掺杂的LiMn2O4从51.2%提升到84.1%,循环伏安测试的结果说明Na+的掺杂不改变材料原本的充放电机理,降低材料的极化并提高锂离子扩散系数。Li0.97Na0.03Mn2O4在10C倍率下放电比容量从未掺杂LiMn2O4的52.1 mAh·g-1提升到79.0mAh·g-1。对LiMn2O4材料进行Na+掺杂可以稳定材料的晶体结构,加快Li+的扩散,从而改善材料的电化学性能。
[1]Armand M,Tarascon JM.Nature,2008,451(7179):652-657
[2]Wang Q,Ping P,Zhao X,etal.J.Power Sources,2012,208: 210-224
[3]Ruffo R,Mantia F,Wessells C,et al.Solid State Ionics, 2011,192(1):289-292
[4]LiW,McKinnon W R,Dahn JR.J.Electrochem.Soc.,1994, 141(9):2310-2316
[5]Luo JY,Xia Y Y.Adv.Funct.Mater.,2007,17(18):3877-3884
[6]Deutscher R L,Florence TM,Woods R.J.Power Sources, 1995,55(1):41-46
[7]Wang G J,Zhao N H,Yang L C,et al.Electrochim.Acta, 2007,52(15):4911-4915
[8]Manjunatha H,Venkatesha T V,Suresh G S.Electrochim. Acta,2011,58(1):247-257
[9]Zhao S,Chang Q,Jiang K,et al.Solid State Ionics,2013, 253:1-7
[10]Ruffo R,Wessells C,Huggins R A,et al.Electrochem. Commun.,2009,11(2):247-249
[11]Hou Y,Wang X,Zhu Y,et al.J.Mater.Chem.A,2013,1: 14713-14718
[12]Toupin M,Brousse T,Bélanger D.Chem.Mater.,2004,16 (16):3184-3190
[13]Mao F,Guo W,Ma J.RSC Adv.,2015,5(127):105248-105258
[14]Kim H,Hong J,Park K Y,et al.Chem.Rev.,2014,114(23): 11788-11827
[15]Kraytsberg A,Ein-Eli Y.Adv.Energy Mater.,2012,2:922-939
[16]Yuan A,Tian L,Xu W,et al.J.Power Sources,2010,195: 5032-5038
[17]Prabu M,Reddy M V,Selvasekarapandian S,et al.Electrochim.Acta,2013,88:745-755
[18]Shu J,Yi T F,Shui M,et al.Comput.Mater.Sci.,2010,50: 776-779
[19]Xiang M,Su CW,Feng L,et al.Electrochim.Acta,2014, 125:524-529
[20]Kikkawa J,Akita T,Tabuchi M,et al.Electrochem.Solid-State Lett.,2008,11:A183-A186
[21]Numata K,Sakaki C,Yamanaka S.Solid State Ionics,1999, 117:257-263
[22]Li J,Li S,LiQ.Mater.Res.Innovations,2015,19:133-136
[23]Lim SN,Seo JY,Jung D S,et al.J.Alloys Compd.,2015, 623:55-61
[24]Wang J,Lin W,Wu B,et al.Electrochim.Acta,2014,145: 245-253
[25]Xiong L,Xu Y,Lei P,et al.J.Solid State Electrochem., 2013,18:713-719
[26]Shen L,Li H,Uchaker E,et al.Nano Lett.,2012,12:5673-5678
[27]Guo D,Chang Z,Tang H,et al.Electrochim.Acta,2014, 123:254-259
[28]Kim H,Hong J,Park K Y,et al.Chem.Rev.,2014,114: 11788-11827
Aqueous Li-Ion Battery Cathode M aterial Li1-xNaxM n2O4Prepared by Sol-gel M ethod and Its Electrochem ical Performance
TAO Hong-Liang MIChang-Huan*ZHANG Ying-Xia
(College ofMaterial Science and Engineering,Nanjing University of Aeronautics and Astronautics, Jiangsu Key Laboratory ofMaterials and Technology for Energy Conversion,Nanjing 210016,China)
The Na-doped Li1-xNaxMn2O4(x=0,0.01,0.03,0.05)was successfully synthesized by a sol-gelmethod. X-ray diffraction showed Na is successfully doped into LiMn2O4structure.SEM images showed thematerial is a uniform particle with 100~300 nm particle size.Galvanostatic charge/discharge results show the discharge capacity retention of Li0.97Na0.03Mn2O4after 100 cycles at 2C was increased from 51.2%to 84.1%compared with that of undoped LiMn2O4.The results of cyclic voltammetry indicate that Na doping reduced the polarization and increased the diffusion coefficient of lithium ions.When the current density is increased to 10C,the doped sample still has a discharge capacity at 79.0 mAh·g-1,which is higher than that of the undoped sample(52.1 mAh·g-1).Na doping can stabilize the material structure and improve the diffusion coefficient of lithium ions, thereby improving the electrochemical properties of LiMn2O4,is a viablemodificationmethod.
aqueous Li-ion battery;Na-dope;LiMn2O4
O646
A
1001-4861(2017)07-1147-06
10.11862/CJIC.2017.156
2017-02-24。收修改稿日期:2017-06-01。
中央高校基本科研业务费专项资金(No.NJ2016058)和江苏高校优势学科建设工程资助项目。*
。E-mail:mchmse@nuaa.edu.cn

