水通道蛋白AQP3缺失对小鼠坐骨神经损伤修复的影响
张 迪, 苏维恒, 赵 元, 龚 倩, 曲桂娟, 裴志花, 刘树明, 马红霞
(1.吉林农业大学动物科学技术学院 , 吉林 长春 130118 ; 2.吉林大学生命科学学院 , 吉林 长春 130012)
水通道蛋白AQP3缺失对小鼠坐骨神经损伤修复的影响
张 迪1, 苏维恒2, 赵 元1, 龚 倩1, 曲桂娟1, 裴志花1, 刘树明1, 马红霞1
(1.吉林农业大学动物科学技术学院 , 吉林 长春 130118 ; 2.吉林大学生命科学学院 , 吉林 长春 130012)
为探明水通道蛋白AQP3缺失对小鼠坐骨神经损伤修复能力的影响,本文通过建立小鼠坐骨神经损伤修复模型,分别比较了野生型(AQP3+/+)和基因敲除(AQP3-/-)小鼠的坐骨神经功能指数(SFI)、神经传导速率及雪旺细胞的迁移能力。结果显示,同野生型小鼠相比,AQP3基因敲除小鼠的SFI在损伤后7 d和14 d时呈现显示性差异,神经传导速率显著降低。细胞穿孔试验表明,AQP3基因敲除小鼠同野生型小鼠相比雪旺细胞迁移能力也显著降低。研究结果表明,AQP3的缺失可导致小鼠雪旺细胞的迁移能力降低,从而影响了小鼠坐骨神经损伤后的修复能力。
水通道蛋白 ; 坐骨神经损伤修复 ; 小鼠 ; 雪旺细胞
外周神经的损伤修复是一个漫长而又复杂的生物学过程,是创伤外科和整形外科至今未能解决的难题之一。雪旺细胞作为外周神经系统的主要胶质细胞,是构成坐骨神经髓鞘的主要细胞,并且雪旺细胞的迁移可促进神经纤维的再生,在神经损伤修复过程中发挥着至关重要的作用[1]。研究表明,小鼠坐骨神经髓鞘及雪旺细胞上存在AQP3基因和蛋白表达[2]。AQP3基因缺失可导致小鼠的角化细胞迁移率降低,体外的伤口愈合抓痕试验也表明AQP3敲除后伤口愈合变慢,伤口周围的隆起也减小,这些结果都提示AQP3与细胞的迁移有关[3]。因此我们推测,表达在小鼠雪旺细胞中AQP3缺失可能会影响雪旺细胞的迁移,从而影响坐骨神经损伤后的修复过程。
1 材料与方法
1.1 动物和试剂 本试验所用野生型(AQP3+/+)小鼠和AQP3基因敲除(AQP3-/-)小鼠,平均体重20g±3g,均由大连医科大学麻彤辉教授馈赠,由本实验室SPF级动物室饲养。DMEM和IMDM培养基(Invitrogen公司); 青霉素和链霉素(华北制药厂产品)、胎牛血清 (GIBCO公司); 胶原酶及Dispase (Sigma公司); 其余为实验室常规试剂,购自哈尔滨博仕生物技术有限公司。
1.2 试验方法
1.2.1 坐骨神经损伤修复模型的建立 本试验采用钳夹法建立小鼠坐骨神经损伤修复模型[4]。具体操作方法为,小鼠于术前8 h禁食禁水,1.5%戊巴比妥钠(30 mg/kg体重)腹腔注射麻醉,取俯卧、后腿伸直位固定于手术台上,常规备皮、消毒、铺巾。于右大腿后部正中切口,分离股二头肌和半腱肌、半膜肌之间的肌间隙,显露坐骨神经。在梨状肌下缘15 mm处(定位),用同一把新的18 cm弯全齿血管钳的同一部位钳夹坐骨神经,压满3扣(定量),维持5 s后放开血管钳,间隔10 s后再夹闭5 s,再放松10 s,第3次钳夹5 s(定时)。神经干挤压伤宽度3 mm,可见神经干变菲薄,但未断裂。损伤部位远端用4-0无创尼龙线标记。彻底止血,创口处滴入庆大霉素注射液0.4 mL预防感染。关闭肌间隙,缝合皮肤,术毕。完全清醒6 h后,随机抽取试验动物12只,每组6只。本试验所有手术均由试验者一人在同一助手协助下完成。
1.2.2 坐骨神经功能指数(SFI,sciatic functional index)测定 根据Lukas F等人介绍的坐骨神经功能指数(SFI)的计算方法,分别取损伤前,损伤后2,4,7,14,21 d和28 d的AQP3+/+和AQP3-/-小鼠各6只,做足迹试验,评估坐骨神经功能恢复情况[5]。小鼠双侧后足蘸黑色墨水在白纸上行走,每侧足留5个足印。 SFI计算公式如下:
SFI=0为完全正常,SFI=-100为神经完全断离。
EPL:损伤脚足印长度 NPL:正常脚足印长度
ETS:损伤脚足趾长度(1st-5th脚趾) NTS:正常脚足趾长度(1st-5th脚趾)
EIT:损伤脚足趾长度(2nd-4th脚趾) NIT:正常脚足趾长度(2nd-4th脚趾)
SFI=0为完全正常,SFI=100为神经完全离断
1.2.3 坐骨神经传导速率测定 本试验采用自制坐骨神经传导速率测定装置。6个电极依次为一对刺激电极,一对接收电极Ⅰ,另一对接收电极Ⅱ。接收电极Ⅰ和接收电极Ⅱ之间的距离恒定为s(2 cm)。通过BL-420S生理记录仪(成都泰盟公司)刺激电极发出电刺激信号,沿着坐骨神经向下传导,分别记录电信号到达接收电极Ⅰ和接收电极Ⅱ的时间为t1和t2。神经传导速率v= s /(t2-t1)[6]。
1.2.4 小鼠雪旺细胞的分离及纯化 参照Patel等人介绍的方法分离及纯化小鼠雪旺细胞[7-9]。取6-8周龄小鼠断颈处死,用75%乙醇浸泡5 min消毒,至超净台无菌操作。分离其双侧后腿的坐骨神经,在解剖镜下尽可能除去其表面的包膜。用无菌的剪刀尽可能剪碎坐骨神经,将其放入消化液(DMEM +10%FCS+0.125%collagenase+1.25 UmL dispase)中消化24 h。消化后,加入10 mL DMEM培养基中,终止消化。800 r/min离心5 min,弃上清,重悬底层细胞接种在事先用gelatin包被的6孔板上,放入培养箱中培养。细胞贴壁后,把完全培养基换成基础培养基,来抑制成纤维细胞的生长,3~4 d后便可得到较纯净的雪旺细胞。
1.2.5 细胞穿孔迁移试验 将AQP3+/+和AQP3-/-小鼠的雪旺细胞分成二组,以每孔10 000 个铺到Boyden Chanber插入式培养板(直径6.5 mm,底部孔径8 μm;预先用0.5 mg/mL纤连蛋白包被)上室小槽中,上室细胞用含1%FBS的IMDM培养液,下室用含10%FBS的IMDM培养液。5% CO2条件下培养6 h后,PBS轻洗细胞1次,经考马斯亮蓝染色10 min,显微镜下照相(迁移+未迁移细胞)。然后用棉签小心檫去小槽上室细胞,再照相(穿孔迁移至小槽下层的细胞).对于每组细胞,显微镜下随机选取8~10个(40 mm×40 mm)视野,进行细胞计数,并计算12 h内细胞迁移率[10-12]。细胞迁移率=下层细胞数/(上层细胞数+下层细胞数)×100%。
1.2.6 统计学分析 所有试验数据采用SPSS3.0软件进行统计分析。试验结果以x±s表示,两组数据间差异比较采用t检验,检验显著性水平定于Plt;0.05为有统计学差异。
2 试验结果
2.1 坐骨神经功能指数测定 为评价小鼠坐骨神经损伤修复能力,我们分别对比了损伤前和损伤后7、14 d和21 d小鼠后肢的足印情况。结果如图1A所示,AQP3+/+小鼠坐骨神经损伤14 d时,其脚趾功能已基本恢复,5指可正常展开;而AQP3-/-小鼠的5个脚趾不能正常展开。通过计算SFI,可以看出在小鼠坐骨神经损伤后7 d和14 d时,AQP3-/-小鼠同AQP3+/+小鼠相比SFI呈现显著性差异,说明AQP3-/-小鼠的损伤修复能力比AQP3+/+小鼠明显减弱,见图1B。
2.2 坐骨神经传导速率测定 为进一步比较坐骨神经损伤修复能力,我们分别测量了AQP3+/+小鼠和AQP3-/-小鼠损伤前和损伤后7 d、14 d和21 d的坐骨神经传导速率。AQP3+/+小鼠坐骨神经传导速率分别为24.64±1.29、14.64±1.02、18.05±1.44、22.44±1.25 m/s;AQP3-/-小鼠坐骨神经传导速率分别为23.40±1.52、11.35±1.39、14.13 m±1.85、21.45±2.12 m/s。统计学分析表明,在损伤后7 d和14 d时,AQP3-/-小鼠坐骨神经传导速率同AQP3+/+小鼠相比显著降低,见图2。
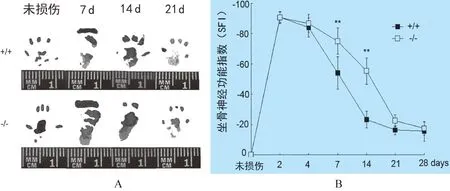
图1小鼠坐骨神经功能指数(SFI)测定
A:损伤不同时期小鼠脚印; B:损伤不同时期小鼠坐骨神经功能指数(n=6,x±s),**:Plt;0.01
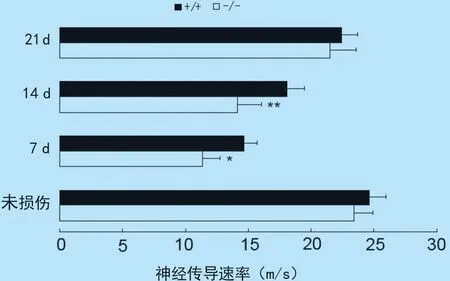
图2坐骨神经传导速度测定
(n=6,x±s),*:Plt;0.05;**:Plt;0.01
2.3 AQP3缺失对雪旺细胞迁移的影响 为了验证AQP3缺失后对雪旺细胞的迁移能力的影响,我们采用细胞穿孔迁移(Transwell)的方法测定了AQP3+/+小鼠和AQP3-/-小鼠雪旺细胞迁移能力。结果如图3所示,AQP3-/-小鼠的雪旺细胞迁移率仅为AQP3+/+小鼠的39%左右。表明AQP3敲除后,雪旺细胞的迁移能力明显降低。
3 讨论
雪旺细胞对再生轴突具有趋化作用,在坐骨神经损伤、再生及修复过程中起着至关重要的作用,它不但分裂增殖,为再生轴突提供机械性生长管道,而且提供具有引导力的活性表面,促进轴索细胞的贴壁生长[13]。坐骨神经损伤后,雪旺细胞分化增殖、迁移,形成Bunger带。雪旺细胞及其基底膜管一起为轴突提供生长通道。雪旺细胞可以表达分泌多种神经营养因子(NTF)、细胞外基质(ECM)、神经细胞粘附因子(NCAM),有利于神经元存活,且能促进轴突生长[14]。雪旺细胞膜能包绕再生轴突,形成髓鞘,促进轴突的成熟。因此,雪旺细胞的迁移能力对于神经损伤后的修复,起着至关重要的作用。
水通道蛋白(Aquaporin,AQP)是广泛存在于原核和真核细胞膜上快速转运水分子的特异性蛋白孔道,迄今为止哺乳动物中已经克隆的水通道蛋白家族有13个成员(AQP0~AQP12)[15]。其中AQP3除了可以转运水分子外,还可以转运甘油和尿素等中性小分子,因此也被命名为水-甘油通道(Aquaglyceroporin)[16]。很多试验已经证实,AQP3能够影响细胞的迁移和增殖。2008年,Hara等人通过transwell试验证明培养的AQP3敲除鼠的角化细胞迁移率明显下降,体外的伤口愈合抓痕试验也表明AQP3敲除的角化细胞,伤口愈合变慢,伤口周围的隆起也减小[17]。这些结果都提示AQP3与角化细胞的迁移有关。2006年,Levin等人发现,AQP3敲除后的角膜上皮细胞迁移和增殖发生了障碍,从而导致了角膜伤口愈合的减慢[18]。2007年,Thiagarajah等人报道说AQP3敲除小鼠的结肠炎模型中,由于AQP3缺乏影响了结肠细胞的迁移和增殖,从而导致了严重的结肠炎[19]。2016年,Zhu等人也报道了AQP3的缺失可以导致人支气管上皮细胞(human bronchial epithelial cells)迁移降低,导致上皮细胞损伤修复能力降低[20]。由此可见,AQP3的缺失可以导致细胞迁移能力降低,影响细胞的修复功能。

图3 雪旺细胞迁移功能测定
总之,AQP3的缺失可导致雪旺细胞迁移能力降低,从而影响坐骨神经的损伤修复能力。
[1] Zheng M, Duan J, He Z,etal. Transplantation of bone marrow stromal stem cells overexpressing tropomyosin receptor kinase A for peripheral nerve repai[J]. Cytotherapy, 2017, 19(8): 916-926.
[2] Zhang D, Guo L, Zhu N,etal. Aquaporin-3 Deletion Reduces Glycerol and ATP Content in Mouse Sciatic Nerve [J]. CHEM RES CHINESE UNIVERSITIES, 2010, 26(6), 955-957.
[3] Hara M , Verkman A S. Glycerol replacement corrects defective skin hydration, elasticity and barrier function in aquaporin-3-deficient mice [J].Proc Natl Acad. Sci USA, 2003, 100(12): 7 360-7 365.
[4] Sumiyuki M, Fuminari U, Shuya Y,etal. Nestin- Expressing Stem Cells Promote Nerve Growth in Long-Term 3-Dimensional Gelfoam-Supported Histoculture [J]. PLoS One, 2013, 8(6):e67153.
[5] Lukas F, Vincenzo P, Florian L,etal. A self-made, low-cost infrared system for evaluating the sciatic functional index in mice[J]. Neural Regen Res, 2016, 11(5): 829-834.
[6] Barry D M, Carpenter C, Yager C,etal. Variation of the neurofilament medium KSP repeat sub-domain across mammalian species: implications for altering axonal structure [J].J Exp Biol, 2010, 213(1):128-136.
[7] Patel J R, McCandless E E, Dorsey D,etal. CXCR4 promotes differentiation of oligodendrocyte progenitors and remyelination[J]. Proc Natl Acad Sci, 2010, 107(24):11 062-11 067.
[8] De Guzman R C, Loeb J A, Vande P J. Electrospinning of matrigel to deposit a basal lamina-like nanofiber surface [J]. J Biomater Sci Polym Ed, 2010, 21(8): 1 081-1 091.
[9] Coulpier F, Decker L, Funalot B,etal. CNS/PNS boundary transgression by central glia in the absence of Schwann cells or Krox20/Egr2 function [J].J Neurosci, 2010, 30(17):5 958-5 967.
[10] Mantuano E, Jo M, Gonias S L,etal. Low density lipoprotein receptor-related protein (LRP1) regulates Rac1 and RhoA reciprocally to control Schwann cell adhesion and migration[J].J Biol Chem, 2010, 285(19): 14 259-14 266.
[11] Afshari F T, Kwok J C, White L,etal. Schwann cell migration is integrin-dependent and inhibited by astrocyte-produced aggrecan [J]. Glia, 2010, 58(7): 857-869.
[12] Zujovic V, Thibaud J, Bachelin C,etal. Boundary cap cells are highly competitive for CNS remyelination: fast migration and efficient differentiation in PNS and CNS myelin-forming cells[J].Stem Cells, 2010, 28(3):470-479.
[13] Inoue S, Cho B H, Song C H,etal. Migration and distribution of neural crest-derived cells in the human adrenal cortex at 9-16 weeks of gestation: an immunohistochemical study [J].Okajimas Folia Anat Jpn, 2010, 87(1):11-16.
[14] Krinke G J, Vidotto N, Weber E. Teased-fiber technique for peripheral myelinated erves: methodology and interpretation[J].Toxicol Pathol, 2000, 28(1):113-121.
[15] Reddy M, Dony E. Role of aquaporins in oral cancer [J]. J Cancer Res Ther, 2017, 13(1): 137-138.
[16] Jay R T, Jeffrey C, Jeremy A G ,eta1.Aquaporin-3 mediates hydrogen peroxide-dependent responses to environmental stress in colonic epithelia [J].Proc Natl Acad Sci, 2017 J, 114(3): 568-573.
[17] Hara-Chikuma M, Verkman A S. Prevention of skin tumorigenesis and impairment of epidermal cell proliferation by targeted aquaporin-3 gene disruption [J]. Mol Cell Biol, 2008, 28(1): 326-332.
[18] Levin M H, Verkman A S.Aquaporin-3-dependent cell migration and proliferation during corneal re-epithelialization. Invest Ophthalmol Vis Sci, 2006, 47(10):4 365-4 372.
[19] Thiagarajah J R, Zhao D, Verkman A S. Impaired enterocyte proliferation in aquaporin-3 deficiency in mouse models of colitis [J].Gut, 2007, 56(11): 1 K529-1 535.
[20] Zhu H X, Zhou J B, Zhu X D,etal. Impaired self-healing capacity in airway epithelia lacking aquaporin-3[J]. Respir Physiol Neurobiol, 2016, 233 (11):66-72.
EffectofAquaporin3deficiencyonfunctionalrecoveryofinjuredsciaticnervesinmice
ZHANG Di1, SU Wei-heng2, ZHAO Yuan1, GONG Qian1, QU Gui-juan1, PEI Zhi-hua1, LIU Shu-ming1, MA Hong-xia1
(1.College of Animal Science and Technology, Jilin Agricultural University, Changchun 130118,China ; 2.School of Life Science, Jilin University, Changchun 130012,China)
To investigate the effects of Aquaporin 3 deficiency on the functional recovery of injured sciatic nerves in mice, we detected the sciatic functional index (SFI), nerve conduction velocity (NCV) and Schwann cell migration between AQP3+/+ and AQP3-/- mice. The results showed that the SFI and NCV of AQP3-/- mice were significantly different when compared with AQP3+/+ mice. Migration of AQP3-/- Schwann cell also significantly decreased in transwell assay compared with AQP3+/+. These results suggest that AQP3 plays an important role in the functional recovery of injured sciatic nerves in mice.
Aquaporin 3 ; sciatic nerve injury and repair ; Mice ; Schwann cell
MA Hong-xia
S852
A
0529-6005(2017)10-0098-04
2017-05-25
国家自然科学基金青年科学基金项目(31402205)
张迪 (1980- ),男,讲师,博士,从事细胞膜的结构与功能方面的研究,E-mail:zhangdi@jlau.edu.cn
马红霞,E-mail:hongxia0731001@163.com

