Cdk5抑制剂Roscovitine对神经病理性疼痛大鼠痛行为学的影响及机制
钟妤,陈佳林,谢玉波,陈静
(广西医科大学第一附属医院,南宁530021)
神经病理性疼痛是神经系统损伤或功能紊乱引起的疼痛,可严重影响患者的生活质量,但其发病机制不明,目前缺乏有效的治疗措施。因此,探讨神经病理性疼痛的发生机制,寻找有效的治疗药物具有重要意义。近年研究表明,脊髓星形胶质细胞活化是神经病理性疼痛发病的重要原因[1,2]。胶质纤维酸性蛋白(GFAP)是星形胶质细胞特有的骨架蛋白,是星形胶质细胞活化的特异性标志物。细胞周期依赖性蛋白激酶5(Cdk5)属于细胞周期依赖性蛋白激酶家族,广泛分布于神经系统。研究发现,脊髓水平Cdk5参与介导慢性疼痛长时程的伤害性行为,是疼痛异常调节的一个新靶点[3]。有研究表明,应用Cdk5拮抗剂Roscovitine可有效缓解疼痛[4,5],但其是否通过参与星形胶质细胞活化,从而减轻神经病理性疼痛尚不清楚。2017年11月~2018年7月,我们采用Roscovitine鞘内注射干预神经病理性疼痛大鼠,观察其对大鼠痛行为学及脊髓背角星形胶质细胞活化的影响,旨在探讨Cdk5在神经病理性疼痛中的作用机制。
1 材料与方法
1.1 动物、试剂与仪器 成年雄性SPF级SD大鼠64只,体质量200~220 g,由广西医科大学实验动物中心提供,室温饲养,自由摄食饮水,适应性饲养1周后进行实验。Cdk5抑制剂Roscovitine(美国Targetmol公司),二甲基亚砜(DMSO,美国Sigma公司),GFAP抗体、GAPDH抗体、HRP二抗(美国CST公司),von Frey纤维丝(美国Stoelting公司),ME410C型全自动热辐射刺激仪(中国医学科学院生物医学工程研究所),5-0可吸收铬肠线(上海医疗器械有限公司)。
1.2 动物分组 按随机数字表法将大鼠随机分为正常对照组(N组)8只、假手术组(S组)8只、坐骨神经结扎(CCI)组(I组)8只、CCI+溶剂组(D组)8只,其余32只作为CCI+给药组(R组)。
1.3 鞘内置管方法 为避免鞘内置管操作对大鼠痛行为学的影响,在行CCI造模前7天,按文献[6]方法对各组鞘内置管。大鼠麻醉后俯卧于手术台上,腰部备皮,在L5~L6间隙作长约1 cm的纵切口,切开筋膜,显示L5和L6棘突间隙,用25G针穿破黄韧带及硬脊膜,可见清亮的脑脊液外溢,经硬脊膜破口处插入PE-10导管约2 cm,导管经皮下隧道于颈部引出,外露2 cm固定,术毕立即腹腔注射青霉素20万单位,并单笼饲养。大鼠清醒后若出现双侧下肢瘫痪,表明脊髓损伤,排除本实验;术后3天经PE-10导管注入2%盐酸利多卡因5 μL、生理盐水10 μL冲管,约10 s大鼠可出现双下肢瘫软,并于30 min左右恢复,即鞘内置管成功。
1.4 神经病理性疼痛模型制备 I组、D组和R组鞘内置管7天后,采用CCI法建立神经病理性疼痛模型[5]:腹腔注射40 mg/kg戊巴比妥钠麻醉,切开右大腿后侧中部,暴露坐骨神经主干,于坐骨神经分叉处以上用5-0可吸收铬肠线结扎4道,间隔1 mm,结扎时以肢体轻微抽动为度。造模后以出现明确的抬足和舔足等行为,术后第7天机械性缩足阈值(PWMT)、热缩足潜伏期(PWTL)明显下降,表明大鼠神经病理性疼痛模型制备成功。S组暴露坐骨神经但不予结扎,N组不做任何处理。
1.5 干预方法 D组和R组分别于术后第7天鞘内注射5%DMSO 20 μL和Cdk5抑制剂Roscovitine 100 μg(溶于20 μL 5% DMSO中),然后均注入5 μL生理盐水冲洗导管,以保证药品全部注入蛛网膜下腔。N组、S组、I组均不注射药物。
1.6 痛行为学指标测定
1.6.1 PWMT测定 按照文献[4]方法,分别于术前(T0)、术后3天(T1)、术后5天(T2)、术后7天(T3)以及给药后0.5(T4)、2(T5)、6(T6)、12 h(T7)检测PWMT。将大鼠置于金属筛网上,用10 cm×10 cm×15 cm的透明有机玻璃箱罩住,适应15 min后,采用标准化von Frey纤维丝垂直刺激术侧后足中部,持续时间≤4 s,刺激力度从2.0 g开始,以出现抬足或舔足为阳性反应,若不能引出阳性反应,给予相邻大一级力度刺激,直至找到出现阳性反应的最小刺激力度。以此力度刺激5次,间隔30 s,以出现3次或以上阳性反应时的刺激力度为PWMT;若刺激力度超过15.0 g或低于1.0 g,则直接记为15.0 g或1.0 g。
1.6.2 PWTL测定 参照文献[7]方法,分别于T0~T7时检测PWTL。将大鼠置于底部为3 mm厚玻璃板的10 cm×10 cm×15 cm透明有机玻璃箱内,用ME410C型全自动热辐射刺激仪照射大鼠术侧后足中部,从开始照射至术侧后肢出现特征性甩动、抬足或舔足时的时间为PWTL,最长照射时间为25 s。每次测定间隔5 min,连续测定3次,取其平均值作为PWTL。
1.7 脊髓星形胶质细胞胶GFAP表达检测 采用Western blotting法。R组于给药T4~T7时痛行为学检测后各取8只取材;N组、S组、I组于术后7天取材,D组于术后7天鞘内注射后取材。大鼠腹腔注射2%戊巴比妥钠深麻醉后,于冰台迅速取脊髓腰膨大处(L4~L6),加入RIPA裂解液和蛋白酶抑制剂研磨匀浆,提取细胞总蛋白,经BCA法蛋白定量合格。取等量蛋白样本加入上样缓冲液,在沸水浴5 min充分变性。加样至10% SDS-聚丙烯酰胺凝胶上电泳,湿电转法转印至聚偏二氟乙烯膜,5%脱脂牛奶室温封闭1 h。分别加入一抗GFAP抗体(1∶1 000)、GAPDH抗体(1∶1 000),4 ℃孵育过夜;TBST洗涤,加入HRP二抗(1∶5 000),室温孵育1 h。采用ECL扫膜仪进行扫膜。利用Image J软件分析各蛋白电泳条带灰度值,以GFAP电泳条带灰度值与内参GAPDH电泳条带灰度值的比值作为反映GFAP相对表达量。

2 结果
2.1 各组不同时间PWMT比较 与T0比较,I组、D组和R组术后各时间点PWMT均明显降低(P均<0.05);与N组、S组比较,I组、D组和R组术后各时间点PWMT均明显降低(P均<0.05);与I组比较,R组T5~T7时PWMT均明显升高(P均<0.05)。见表1。
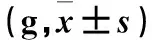
表1 各组不同时点PWMT比较
注:与本组T0时比较,*P<0.05;与N组、S组比较,﹟P<0.05;与I组比较,△P<0.05。
2.2 各组不同时间点PWTL比较 与T0时比较,I组、D组和R组术后各时间点PWMT均明显降低(P均<0.05);与N组、S组比较,I组、D组和R组术后各时间点PWTL均明显降低(P均<0.05);与I组比较,R组T5~T7时PWTL均明显升高(P均<0.05)。见表2。

表2 各组不同时点PWTL比较
注:与本组T0时比较,*P<0.05;与N组、S组比较,﹟P<0.05;与I组比较,△P<0.05。
2.3 各组脊髓星形胶质细胞GFAP表达比较 N组、S组、I组、D组GFAP相对表达量分别为0.44±0.03、0.47±0.02、1.30±0.04、1.31±0.02,R组T4~T7时GFAP相对表达量分别为1.23±0.09、0.79±0.07、0.68±0.02、0.82±0.34。与S组比较,I组、D组和R组T4~T7时脊髓GFAP相对表达量均明显上调(P均<0.05),N组脊髓GFAP相对表达量变化不明显(P>0.05);与I组比较,R组T5~T7时脊髓GFAP相对表达量均明显下调(P均<0.05),D组脊髓GFAP相对表达量变化不明显(P>0.05)。
3 讨论
神经病理性疼痛是机体由于周围神经系统或中枢神经系统损伤造成的一种慢性病理状态[8],表现为自发性疼痛、痛觉过敏和痛觉异常。中枢神经系统含有丰富的星形胶质细胞。研究表明,在神经病理性疼痛的形成和维持期,可出现星形胶质细胞肥大、活化增殖等现象,而过度活化增殖可导致炎性介质释放增加,从而加重损伤。脊髓背角神经元上的Cdk5激活在慢性疼痛的伤害性信号转导方面具有重要作用,并成为镇痛药物作用的一个靶目标[9]。然而神经病理性疼痛发生机制复杂,抑制Cdk5激活是否影响其他蛋白的表达,从而发挥镇痛作用,目前尚不明确。
研究发现,伤害性感受的存在依赖于中枢敏感化形成,在中枢敏感化过程中Cdk5激活被认为是神经病理性疼痛发生的一个关键环节[10]。Cdk5是丝/苏氨酸蛋白激酶,大部分Cdk5以单体形式存在,没有激酶活性,只有与p35或p39结合才表现激酶活性,其中p35作为特异性蛋白结合及活化Cdk5的能力更强。研究表明,Cdk5与神经系统发育、神经元正常功能维持密切相关,可参与发育过程中神经元的迁移、神经突起的生长、轴突运输、胞吐、药物成瘾等。近年研究发现,Cdk5在疼痛中发挥着重要作用[11]。研究表明,鞘内注射Cdk5抑制剂Roscovitine可显著减轻神经病理性疼痛大鼠痛行为学,且不引起运动功能损伤[12]。本研究发现,I组各时间点PWMT、PWTL均低于S组,提示神经病理性疼痛大鼠模型制备成功;与I组比较,R组T5~T7时PWMT、PWTL均升高,提示抑制Cdk5抑制剂可有效减轻神经病理性疼痛大鼠的痛行为学表现。
GFAP是星形胶质细胞特有的骨架蛋白,是星形胶质细胞活化的特异性标志物。星形胶质细胞活化主要发生于中枢神经系统脊髓上水平(如延髓腹外侧区)和脊髓水平(主要是脊髓背角)[13]。活化的星形胶质细胞与神经病理性疼痛的维持有关,抑制星形胶质细胞的活化可缓解神经病理性疼痛[14]。体外研究表明,Cdk5和p35除在神经元表达外,还可表达于星形胶质细胞,在原代培养的星形胶质细胞中,Cdk5、p35表达上调,给予Cdk5抑制剂Roscovitine能抑制损伤导致的星形胶质细胞活化[15]。Cdk5和p35形成免疫复合物导致星形胶质细胞形态学改变和进一步延伸,在病理状态下导致GFAP重构增多[16],引起星形胶质细胞增殖活化,释放一系列炎性因子,如TNF-α、IL-6、IL-1β等,这可能是神经病理性疼痛维持的基础[17]。本研究发现,与I组比较,R组T5~T7时脊髓GFAP相对表达量均明显下调,提示抑制Cdk5能使脊髓背角GFAP表达下调,表明Cdk5可参与星形胶质细胞活化的抑制过程,抑制Cdk5可能抑制星形胶质细胞活化,从而减轻神经病理性疼痛。
综上所述,抑制Cdk5可减轻大鼠神经病理性疼痛,其机制可能与抑制脊髓星形胶质细胞GFAP表达,进而抑制星形胶质细胞活化有关。

