趋化因子CCL2对血小板内p38MAPK-HSP27通路的活化作用
曹禹,乔锐,刘丹,李春辉,于淼
在冠心病进展的过程中,如果血小板在动脉粥样硬化(atherosclerosis,AS)斑块形成及不稳定斑块破裂部位触发聚集反应,会引起血栓栓塞,同时还可引起持续的AS炎症反应及微循环障碍。血小板的持续活化与急性冠脉事件互为因果[1],活化后的血小板在血栓性血管闭塞中发挥着重要作用,并同时参与急性心肌梗死(acute myocardial infarction,AMI)发展进程中相关微小血栓的形成、血管收缩、斑块进展、炎症反应等过程。斑块内的血小板可释放多种生长因子和趋化因子进入微环境,促进斑块进展[2]。不断发展的炎症反应或斑块破裂所致的冠脉栓塞与临床预后密切相关[3]。我们前期研究发现,ST抬高型心肌梗死(ST-elevation myocardial infarction,STEMI)患者服用替格瑞洛后仍存在一定程度的残余血小板活化,血小板高反应患者血浆及血小板内趋化因子CCL2表达较血小板正常反应患者高。残余血小板聚集率也与血浆中CCL2的表达,提示CCL2参与了血小板的聚集和活化,且与患者预后相关[4]。然而,CCL2调控血小板活化的具体机制尚未明确,本研究应用蛋白芯片筛选经CCL2因子刺激后人血小板内发生磷酸化的激酶,比较野生型C57小鼠与CCL2–/–小鼠血小板内相关激酶的变化。
1 材料与方法
1.1 研究对象
1.1.1 健康志愿者 选取20位健康志愿者,年龄20~45岁,无冠心病、经皮冠状动脉介入或冠状动脉搭桥手术史,无吸烟史、糖尿病史、高血压病史,无先天性心脏病、心脏瓣膜疾病、心肌疾病,无脑卒中、外周血管病变、肾动脉狭窄,无血液系统疾病、肿瘤性疾病、严重肝肾疾病、自身免疫病、活动性炎性疾病等慢性疾病及家族性遗传病史。近2周未服用过替格瑞洛、阿司匹林等抗血小板药物及抗凝药或他汀类药物。研究经沈阳军区总医院伦理委员会批准,入选对象均签署知情同意书。
1.1.2 实验动物 野生型C57小鼠和CCL2–/–小鼠各10只,雄性,8~10周龄。C57小鼠由沈阳军区总医院动物实验科提供;CCL2–/–小鼠品系背景为C57BL/6J,先期由南京大学南京生物医药研究院负责代繁。所有动物实验严格遵守实验动物保护和使用法规。
1.2 蛋白芯片筛选人血小板内发生磷酸化的激酶抽取8位健康志愿者静脉血,分离血小板,并按照是否进行CCL2(终浓度1000ng/ml)刺激分为CCL2组(n=4)及对照组(n=4),采用蛋白芯片筛选两组血小板内发生磷酸化的激酶。步骤如下:①提取人血小板总蛋白,测蛋白浓度。芯片每孔中加入1ml缓冲液(Array Buffer 1),将膜编号朝上放置于相应的孔中,置摇床上室温孵育1h。②取200μg蛋白样品,先加入缓冲液(Lysis Buffer 6)稀释至334μl,充分混匀后,再加入缓冲液(Array Buffer 1)至2ml。③弃去芯片孔中的缓冲液(Array Buffer 1),加入1ml稀释后的蛋白样品,置摇床上2~8℃孵育过夜。④将每张膜轻轻移至装有20ml缓冲液(1×Wash Buffer)的独立塑料容器中,置摇床上洗膜10min,重复3次。⑤取20μl Detection Antibody Cocktail A/B,加入至1×Array Buffer 2/3中充分混匀,用1×Array Buffer 2/3定容至1ml。芯片孔中加入1ml稀释后的Detection Antibody Cocktail A/B。⑥将置于塑料容器中的膜移出,用纸巾吸干液体,轻轻放回芯片每个对应的孔中,置摇床上室温孵育2h。重复步骤4。⑦于芯片孔中加入1ml稀释后的Streptavidin-HRP。将置于塑料容器中的膜移出,用纸巾吸干液体,放回芯片对应的孔中,置摇床上室温孵育30min。重复步骤4。⑧将置于塑料容器中的膜移出,用纸巾吸干液体,平铺至塑料薄膜的底层上。吸取1ml Chemi Reagent Mix均匀滴在膜上,盖上塑料薄膜的顶层,挤出气泡,室温孵育1min。⑨将膜置于暗匣中压片。应用Image Pro Plus软件进行灰度分析。
1.3 Western blotting检测人血小板内P38MAPK和HSP27的表达 抽取10例健康志愿者静脉血,分离血小板,加入CCL2因子(终浓度1000ng/ml),37℃孵育30min,室温下3000r/min离心5min,弃上清,提取总蛋白。根据测得蛋白浓度计算上样容量并将蛋白稀释,于100℃水浴中煮沸5min,室温下12 000r/min离心5min;灌胶、蛋白上样及电泳后PVDF转膜;将转印好的PVDF膜置于5%脱脂奶粉中,封闭2h;将PVDF膜置于一抗溶液(总P38MAPK 1:1000,pho-P38MAPK 1:1000,总HSP27 1:1000,pho-HSP27 1:1000,β-actin 1:2000)中,4℃条件下孵育过夜;次日将PVDF膜置于室温下复温,TBS-T洗膜,每次20min,重复3次;将PVDF膜置于二抗溶液(1:10 000)中,室温下孵育2h;TBST洗膜,每次20min,重复3次。将ECL适量滴于PVDF膜上,置暗匣内压片,采用Image Pro Plus软件对条带灰度进行分析。
1.4 Western blotting检测小鼠血小板内P38MAPK和HSP27的表达 分离野生型C57及CCL2–/–小鼠血小板,加入胶原(终浓度5μg/ml),于37℃孵育30min,室温下3000r/min离心5min,弃上清,提取总蛋白行Western blotting检测,步骤同1.3。
1.5 统计学处理 采用SPSS 21.0软件进行统计分析。计量资料以表示,两组样本间的比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 蛋白芯片检测CCL2因子刺激后的激酶磷酸化水平 经CCL2因子(1000ng/ml)体外刺激人血小板后,有12种激酶磷酸化位点的磷酸化程度明显升高,包括p38α(T180/Y182)、EGF R(Y1086)、MSK1/2(S376/S360)、AMPKα1(T183)、HSP27(S78/S82)、Lck(Y394)、STAT2(Y689)、Yes(Y426)、Chk-2(T68)、FAK(Y397)、PDGF Rβ(Y751)、c-Jun(S63)等(图1)。

图1 经CCL2刺激后12种磷酸化位点磷酸化程度升高的激酶(n=4)Fig.1 Twelve phosphokinases increased by stimulation of CCL2 (n=4)
2.2 Western blotting检测CCL2因子刺激后的激酶磷酸化水平 Western blotting检测结果表明,经CCL2因子(1000ng/ml)体外刺激后,人血小板内P38MAPK(T180/Y182)、HSP27(S78/S82)的磷酸化表达明显高于对照组,两组比较差异有统计学意义(P<0.01,图2),与芯片检测结果一致。
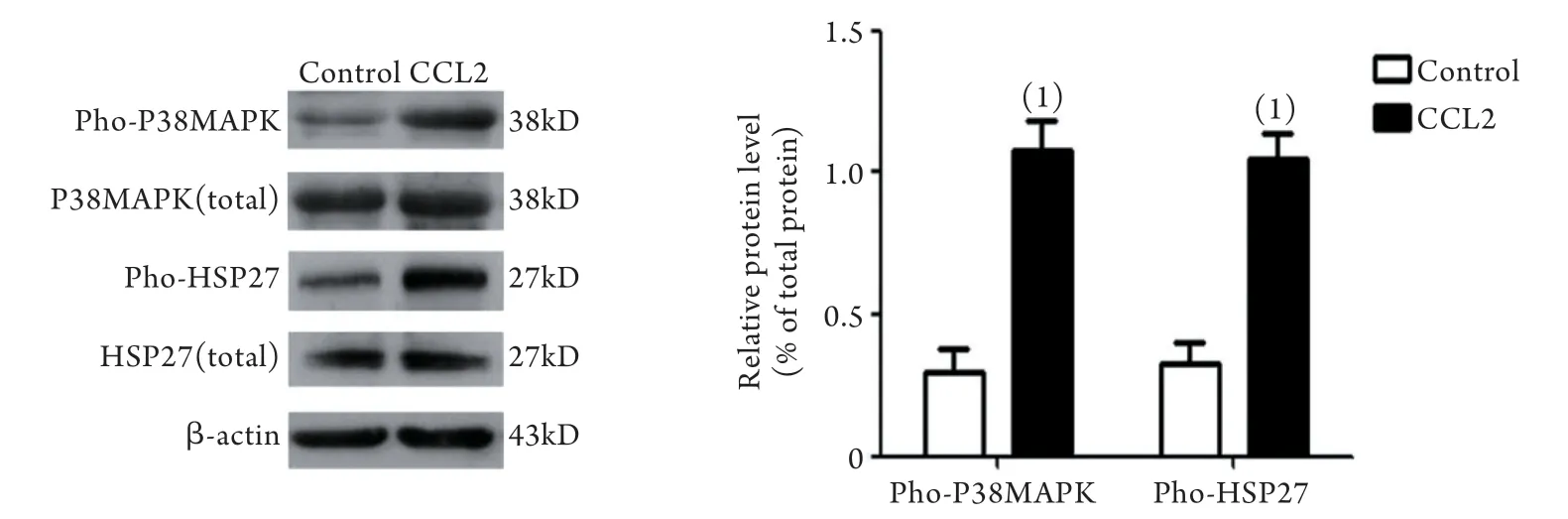
图2 Western blotting验证CCL2因子刺激对血小板激酶磷酸化的影响(n=5)Fig.2 Effect of CCL2 stimulation on the phosphorylation of platelet phosphokinases (Western blotting, n=5)
2.3 小鼠血小板内P38MAPK和HSP27的表达差异 Western blotting结果表明,与未经胶原刺激比较,经5μg/ml胶原刺激的野生型C57小鼠,其血小板内P38MAPK(T180/Y182)、HSP27(S78/S82)的磷酸化表达明显升高,差异有统计学意义(P<0.01);而经胶原刺激的CCL2–/–小鼠血小板内P38MAPK(T180/Y182)、HSP27(S78/S82)的磷酸化表达则明显低于经胶原刺激的野生型C57小鼠,差异有统计学意义(P<0.05,图3)。
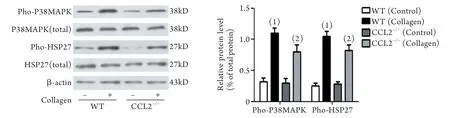
图3 胶原刺激对小鼠血小板P38MAPK和HSP27表达的影响Fig.3 Effect of collagen stimulation on the expressions of mouse' platelet P38MAPK and HSP27
3 讨 论
P38MAPK是目前已知的3个MAPKs家族成员之一[5]。有文献报道,MAPKs在调节多种基因表达及促进炎症和血管性疾病的发展中具有重要作用[6]。MAPKs在人血小板中有表达,可以加强磷脂酶A2的活性和促进血栓素A2(thromboxane A2,TXA2)的形成,而TXA2是血小板释放和聚集的强效诱导剂[7-8]。研究显示,P38MAPK在凝血酶诱导的血小板颗粒分泌过程中明显活化,预先应用P38MAPK的抑制剂SB 203580处理人血小板,可以明显降低血小板分泌PF4和CD40L[9]。CCL2诱导的P38MAPK活化可以被抗血小板药物西洛他唑抑制,降低AS早期单核细胞的浸润[10]。
本课题组前期研究发现,外源性应用CCL2因子刺激人血小板会导致NF-κB信号通路上关键激酶P65的磷酸化水平升高,该通路上的拮抗剂IκBα水平降低;应用CCR2拮抗剂RS201895或NF-κB信号通路抑制剂Bay11-7082预处理人血小板后,再应用CCL2刺激血小板,P65的磷酸化水平降低,IκBα水平升高,提示CCL2/CCR2可通过NF-κB信号通路影响血小板功能[11]。本研究应用蛋白芯片筛选并采用Western blotting验证,结果显示,人血小板在外源性CCL2因子的刺激下,P38MAPK(T180/Y182)和HSP27(S78/S82)的磷酸化表达均明显升高,提示CCL2可能通过P38MAPK信号通路调控血小板活化。
HSP27在热刺激、内毒素、氧自由基等应激状态下明显表达,具有多种调节功能,不仅能维持细胞骨架中肌动蛋白和微管的稳定[12-14],还参与蛋白翻译后的修饰,包括HSP27的磷酸化,是HSPs家族中最重要的一员[15]。在血小板未激活状态下,HSP27大部分处于非磷酸化的聚集形式,一旦血小板被激活,HSP27发生磷酸化并快速解离[16]。但目前还没有CCL2诱导后血小板内HSP27发生活化的相关报道。本研究结果显示,外源性CCL2刺激人血小板可促使血小板内HSP27的磷酸化表达增加。
Saklatvala等[17]报道,在胶原诱导血小板激活的过程中,P38MAPK被活化后可促使MAPK活化蛋白激酶2发生活化,进而加强HSP27的磷酸化表达。Alarayyed等[18]发现,在胶原诱导血小板活化并释放CD40L的过程中,在MAPKs家族成员P38MAPK或ERK1/2的催化作用下,HSP27通过调控血小板内骨架肌动蛋白而使其磷酸化表达明显增加。为了进一步证实CCL2参与对血小板内P38MAPK和HSP27的活化,本研究提取野生型C57小鼠和CCL2–/–小鼠血小板,并采用胶原刺激血小板,比较血小板内P38MAPK和HSP27磷酸化的表达情况。结果显示,CCL2–/–小鼠血小板内P38MAPK和HSP27的磷酸化表达均降低,表明胶原与CCL2对血小板的激活不是各自独立的,其在对P38MAPK和HSP27的活化过程中,加强了CCL2对P38MAPK-HSP27信号通路的活化,推测趋化因子CCL2可能通过P38MAPK-HSP27通路调控血小板的活化。

