右美托咪定防治芬太尼诱导的痛觉过敏的机制研究
刘晴晴,魏碧玉,任鹏,刘永哲,郭航,孙立,郭文治,马亚群,高明龙
芬太尼作为强效阿片类镇痛药,是目前复合全身麻醉的常用药物[1],但是长期暴露于阿片类药物中会出现疼痛敏感性增加、痛阈下降的现象,即阿片类药物诱导的痛觉过敏(opioid induced hyperalgesia,OIH)[2-3]。目前,OIH的形成机制还不明确,获广泛认可的有两种假设[4]:一种是系统的下行易化,包括谷氨酸转运体的下调、N-甲基-D-天冬氨酸(NMDA)受体的激活以及星形胶质细胞的活化;在神经性或者炎性疼痛中,业已证明脊髓背角的星形胶质细胞和小胶质细胞参与其中[5]。另一种是细胞水平的适应,包括脱敏、内化和异化等,比如诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的异化。Célérier等[6]发现iNOS在痛觉过敏中扮演着重要的角色,阿片类药物暴露引起的痛觉过敏在敲除iNOS基因的小鼠中明显下降;Tao等[7]也发现,在神经性或炎性疼痛模型中NDMA受体的过度兴奋似乎与脊髓iNOS-NO通路激活有关。
右美托咪定作为α2肾上腺素受体(alpha-2 adrenergic-receptor,α2-AR)激动剂参与了痛觉的调控[8-10],研究发现右美托咪定可以抑制星形胶质细胞[11]、小胶质细胞[12]的活化,从而减少炎性介质iNOS等的产生。虽然有研究表明右美托咪定可以降低痛觉过敏的发生率[13],但关于右美托咪定对OIH调控机制的报道尚少。本研究旨在观察提前给予右美托咪定对芬太尼诱导的痛觉过敏的影响,通过测定大鼠模型中脊髓后角区域α2A肾上腺素受体(alpha-2A adrenergic-receptor,α2A-AR)、iNOS、P物质、星形胶质细胞标志物胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)和小胶质细胞标志物离子钙接头蛋白1(ionized calcium binding adaptor molecule 1,Iba-1)的表达变化来探索其中可能的机制。
1 材料与方法
1.1 实验动物 130只雄性SPF级SD大鼠,2~3月龄,体重(260±20)g,由斯贝福(北京)实验动物有限公司提供[合格证号:SCXK(京)2016-0002]。实验室温度18~22℃,湿度40%~70%,昼夜比1:1,保持空气流通,动物自由饮水、进食。实验前在实验室内分笼饲养1周,每笼5只,使其充分适应环境。
1.2 实验仪器及材料 ZH-YLS-3E 电子压痛仪(北京众实迪创科技公司),YLS-6B智能热板仪(济南益延科技发展有限公司),ZS-3板式酶标仪(北京市新风机电技术公司),DG-300C电泳仪(北京鼎国昌盛生物技术有限责任公司),Multiskan MK3标准规格酶标仪(Thermo Scientific,美国)。枸橼酸芬太尼注射液(宜昌人福药业有限责任公司,批号1141101),盐酸右美托咪定注射液(江苏恒瑞医药股份有限公司,批号170718BP),β-actin(AC001-M,美国Santa Cruz公司),抗α2A-AR抗体(ab45871)、抗iNOS抗体(ab49999)、抗GFAP抗体(ab33922)、抗Iba-1抗体(ab178847,美国Abcam公司)。辣根酶标记的山羊抗兔IgG(SH-0031)和辣根酶标记的兔抗山羊IgG(IH-0071)购自北京鼎国昌盛生物技术有限责任公司,辣根酶标记的山羊抗小鼠IgG(GB23301,谷歌生物科技有限公司,中国)、辣根酶标记的山羊抗兔IgG(M21002,Abmart公司,中国)、0.5%聚乙二醇辛基苯基醚(Triton-X 100,ST795)购自碧云天公司,P物质试剂盒(BPE30328)购自上海浩本生物科技有限公司。
1.3 痛觉过敏模型的建立 参照文献[14]的方法,改良后使用芬太尼进行造模:先给予皮下注射生理盐水1ml×1次,最后给予芬太尼60μg/kg×4次,每次间隔15min,依据痛阈检测结果确定模型建立的效果。
1.4 实验分组 将大鼠随机分为5组(n=26):生理盐水组(NS组)、芬太尼组(即痛觉模型组,F组)、右美托咪定+芬太尼合剂组(DF组)。DF 组再根据给予的右美托咪定剂量(12.5、25、50μg/kg)分为3个亚组,即右美托咪定+芬太尼合剂1组(DF1组)、右美托咪定+芬太尼合剂2组(DF2组)、右美托咪定+芬太尼合剂3组(DF3组)。各组处理措施如下:NS组大鼠经皮下注射生理盐水1ml×5次;F组大鼠先经皮下注射生理盐水1ml×1次,再给予芬太尼60μg/kg×4次;DF各亚组(DF1、DF2、DF3组):先分别皮下注射特定剂量右美托咪定(12.5、25、50μg/kg)×1次,再给予芬太尼60μg/kg×4次。给药方法:所有药物均溶于等体积(1ml)的生理盐水中,每次给药间隔时间为15min,由专人负责给药。
1.5 行为学测试 每天10:00am~12:00am由专人进行行为学测试,给药前1周对大鼠进行电子压痛仪筒形固定器和智能热板仪适应,给药前30min(定义为d0时点)测定压尾机械阈值(tail flick threshold,TFT)、热痛缩爪潜伏期(paw withdrawal latency,PWL)并作为基线值,然后在给药后2、3、4h及1~5d每天固定的时间点进行行为学测试。
1.5.1 TFT测定 在大鼠尾部距根端10cm处做一标记,置于筒形固定器中,将尾端平放在压痛平台上,保持标记点在楔形压痛模块下方,待大鼠安静后开始测量,当大鼠出现逃避反应(如肢体明显的蜷缩或尾部甩动等)时记录压力值(g),重复测量2次,每次间隔15min,取2次平均值作为大鼠的TFT。为避免组织损伤,将实验终点的最大值设为600g。
1.5.2 PWL测定 将热板仪温度设定为(52.0±0.2)℃,到达设定温度后拿掉热板仪上的有机玻璃罩,一手捉鼠,一手拿其后足贴于热板,同时踏一下脚踏计时开关,当感觉大鼠有明显的抽动逃避动作时,再踏一下开关进行时间锁定,重复测试2次,取平均值作为该大鼠痛阈值,两次测试间隔不应小于15min。为防止大鼠后足烫伤,最大值设置为60s。
1.6 Western blotting检测α2A-AR和iNOS蛋白的表达参照Célèrier等[14]取材时间点,于给药后1d从每组随机取8只大鼠,10%水合氯醛(4ml/kg)腹腔注射麻醉后,剪开背部皮毛,分离脊柱旁的肌肉,根据解剖定位到脊髓的腰膨大区域离断脊柱,置于冰生理盐水中,从椎体侧面小心咬开脊椎,取出脊髓腰膨大区域,置于–80℃液氮保存。样本称重后提取蛋白,为避免细微操作影响实验结果,各组样本均于同一次实验取材。进行蛋白电泳、转膜、5%脱脂奶粉封闭,一抗和二抗孵育,一抗为抗α2A-AR抗体(1:1000)、抗iNOS抗体(1:1000)及内参β-actin(1:5000),二抗为辣根酶标记的山羊抗兔IgG(1:5000)、辣根酶标记的兔抗山羊IgG(1:4000)和辣根酶标记的山羊抗小鼠IgG(1:4000),孵育结束后显影曝光,使用Image J图像分析软件分析条带的灰度值。
1.7 ELISA法检测SP的表达 给药后1d每组随机选取4只大鼠,按Western blotting的取材方法获取大鼠脊髓腰膨大区域蛋白提取物,将稀释后的标准品50μl、待检样品40μl和抗SP抗体10μl按照试剂盒说明书分别加入试剂盒标准孔和样本孔,设立5个复孔,依次加入辣根过氧化物酶(HRP)标记的链霉亲和素,混匀后37℃温育1h,洗板后加入底物避光显色。采用Multiskan MK3标准规格酶标仪测量各孔在450nm波长下的光密度(OD值),使用CurveExpert 1.3软件计算SP的含量,结果以ng/L表示。
1.8 免疫荧光法检测GFAP和Iba-1蛋白表达 随机从每组中选取给药后1d的8只大鼠,使用10%水合氯醛(4ml/kg)麻醉后心脏灌注,迅速取出脊髓的腰膨大区域,依次置于4%多聚甲醛、20%蔗糖、30%蔗糖溶液中进行梯度脱水,然后进行冰冻切片(厚度10μm)。将切片放入抗原修复液(100℃,10min),PBS冲洗后加入打孔液体0.5%聚乙二醇辛基苯基醚(Triton-X 100)、10%山羊血清封闭1h,分别加入一抗[抗GFAP抗体(1:500)和抗Iba-1抗体(1:100)]。4℃孵育12h过夜,加入二抗辣根酶标记山羊抗兔IgG(1:5000),最后使用DAPI染核15min、甘油封片固定,整个过程保持避光。荧光显微镜下观察并拍照,使用Photoshop软件进行计数,计算出阳性细胞数。
1.9 统计学处理 采用SPSS 23.0统计软件进行数据分析。计量资料符合正态分布时以表示,采用重复测量的方差分析研究时间对痛阈的影响,其他各组间计量资料的比较采用正态性和方差齐性检验后选择单因素方差分析(One-way ANOVA)或Kruskal-Wallis秩和检验,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 行为学检测结果 由重复测量的方差分析结果可见,组别(FTFT=33.040,PTFT<0.0001;FPWL=15.842,PPWL<0.0001)和时间点(FTFT=397.203,PTFT<0.0001;FPWL=191.931,PPWL<0.0001)都存在统计学差异,并且存在交叉效应(F=34.283,P<0.0001;FTFT=16.580,PTFT<0.0001)。由组内比较结果可见,NS组在各个时间点无统计学差异(PTFT=0.807;PPWL=0.946)。由图1可见,F组和DF组的TFT和PWL在2~4h时点都高于基线值,而在给药后1~3d,F组和DF1组的TFT和PWL下降并低于基线值,于第4天恢复至基线水平;DF2组和DF3组在1~5d维持在基线值水平。
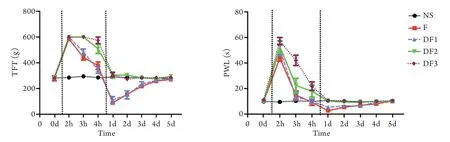
图1 各组各时间点压尾机械阈值(TFT)和热痛缩减爪潜伏期(PWL)比较Fig.1 Comparison of the tail flick threshold (TFT) and the paw withdrawal latency (PWL) of each group at each time point
组间比较可见,在d0时各组基础痛阈值无统计学差异(PTFT=0.871;PPWL=0.746),TFT在2、3、4h以及1~3d时各组间存在统计学差异(P<0.01),而在4d和5d时点无统计学差异(P4d=0.540;P5d=0.271);PWL在2、3、4h,以及1~3d时组间存在统计学差异(P<0.01),而在4d和5d时无统计学差异(P4d=0.170;P5d=0.960,表1、2)。
表1 右美托咪定对芬太尼诱导的痛觉过敏大鼠TFT的影响(±s,n=6)Tab.1 Effects of dexmedetomidine on tail flick threshold of fentanyl-induced hyperalgesia in rats (±s, n=6)
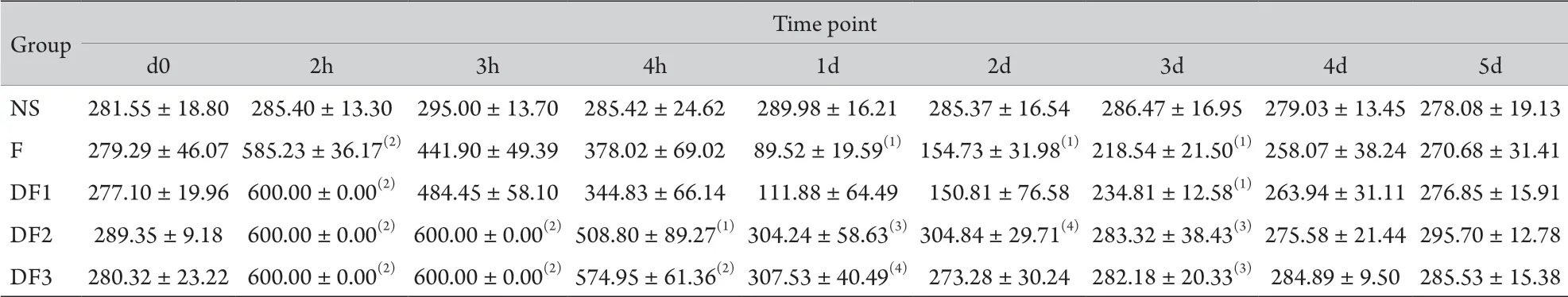
表1 右美托咪定对芬太尼诱导的痛觉过敏大鼠TFT的影响(±s,n=6)Tab.1 Effects of dexmedetomidine on tail flick threshold of fentanyl-induced hyperalgesia in rats (±s, n=6)
NS.Saline group; F.Fentanyl group; DF1.Dexmedetomidine and fentanyl first group; DF2.Dexmedetomidine and fentanyl second group; DF3.Dexmedetomidine and fentanyl third group.(1)P<0.05, (2)P<0.01 compared with group NS; (3)P<0.05, (4)P<0.01 compared with group F
Group Time point d0 2h 3h 4h 1d 2d 3d 4d 5d NS 281.55±18.80 285.40±13.30 295.00±13.70 285.42±24.62 289.98±16.21 285.37±16.54 286.47±16.95 279.03±13.45278.08±19.13 F 279.29±46.07585.23±36.17(2)441.90±49.39 378.02±69.02 89.52±19.59(1)154.73±31.98(1)218.54±21.50(1)258.07±38.24270.68±31.41 DF1 277.10±19.96 600.00±0.00(2)484.45±58.10 344.83±66.14 111.88±64.49 150.81±76.58 234.81±12.58(1)263.94±31.11276.85±15.91 DF2 289.35±9.18 600.00±0.00(2)600.00±0.00(2)508.80±89.27(1)304.24±58.63(3)304.84±29.71(4)283.32±38.43(3)275.58±21.44295.70±12.78 DF3 280.32±23.22 600.00±0.00(2)600.00±0.00(2)574.95±61.36(2)307.53±40.49(4)273.28±30.24 282.18±20.33(3)284.89±9.50 285.53±15.38
表2 右美托咪定对芬太尼诱导的痛觉过敏大鼠PWL的影响(±s,n=6)Tab.2 Effects of dexmedetomidine on paw withdrawal latency of fentanyl-induced hyperalgesia in rats (±s, n=6)

表2 右美托咪定对芬太尼诱导的痛觉过敏大鼠PWL的影响(±s,n=6)Tab.2 Effects of dexmedetomidine on paw withdrawal latency of fentanyl-induced hyperalgesia in rats (±s, n=6)
NS.Saline group; F.Fentanyl group; DF1.Dexmedetomidine and fentanyl first group; DF2.Dexmedetomidine and fentanyl second group; DF3.Dexmedetomidine and fentanyl third group.(1)P<0.05, (2)P<0.01 compared with group NS; (3)P<0.05, (4)P<0.01 compared with group F
Group Time point d0 2h 3h 4h 1d 2d 3d 4d 5d NS 9.81±1.15 9.55±1.61 10.36±1.88 10.05±2.11 10.63±1.21 10.18±1.04 9.86±1.18 9.84±0.84 10.14±0.52 F 10.21±2.44 43.91±6.08 14.93±7.83 9.38±6.08 2.62±0.61(2) 5.47±2.91(1)6.86±1.35(2)8.08±1.33 10.32±1.39 DF1 10.30±1.56 50.39±10.97(1)13.59±6.60 10.01±4.21 5.47±1.42 6.48±0.88 6.41±1.17(2)9.53±0.93 10.05±1.10 DF2 10.06±2.07 52.79±11.16(1)22.40±13.77 17.97±11.25 10.3±1.91(4)9.42±1.49 9.45±2.34(4)9.93±1.87 10.20±1.54 DF3 11.27±2.32 57.12±7.05(2) 42.07±9.97(2)21.85±8.40(3)10.6±2.90(4) 10.43±2.27 9.08±0.96(3)10.07±2.10 10.54±1.14
2.2 α2A-AR和iNOS蛋白表达情况 各组间α2A-AR和iNOS蛋白表达差异有统计学意义(Fα2A-AR=16.725,Pα2A-AR<0.001;FiNOS=12.469,PiNOS<0.001)。LSD-t法进一步两两比较显示,与NS组对比,F组和DF1组α2A-AR蛋白表达明显下降(P<0.05),同时iNOS蛋白表达明显上调(P<0.01);与F组相比,DF2组和DF3组α2A-AR蛋白表达明显增加(P<0.01),同时iNOS蛋白表达明显下降(P<0.01,图2)。

图2 右美托咪啶给药后1d各组α2A-AR和iNOS蛋白表达情况Fig.2 The expressions of α2A-AR and iNOS on the first day after administration of dexmedetomidine in the 5 groups
2.3 SP的表达情况 各组间SP表达水平差异有统计学意义(F=21.365,P<0.001)。LSD-t检验结果显示,与NS组比较,F组的SP表达明显增加(P<0.05),而DF组SP表达均明显下降(P<0.01);与F组比较,DF组SP表达明显下降(P<0.01,图3)。
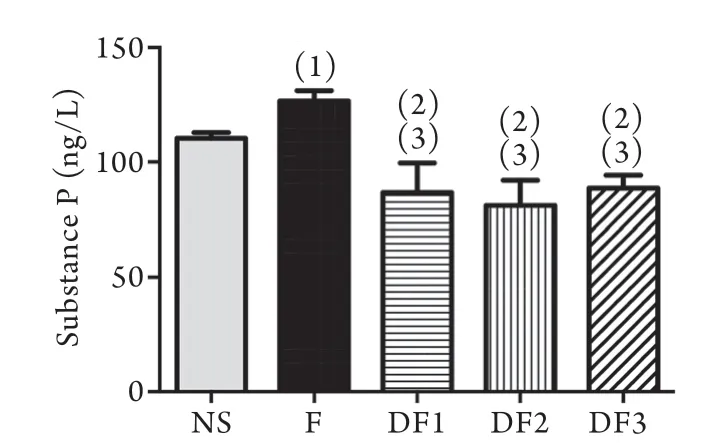
图3 右美托咪啶给药后1d各组SP表达情况Fig.3 The expressions of substance P on the first day after administration of dexmedetomidine in the 5 groups
2.4 GFAP和Iba-1的表达情况 在给药后1d,与NS组比较,F组星形胶质细胞标记物GFAP的表达明显增加(P<0.01,图5),而与F组比较,DF组的GFAP表达明显下降(P<0.01,图4)。小胶质细胞标记物Iba-1的变化趋势与GFAP相同(图5)。

图4 右美托咪啶给药后1d大鼠脊髓背角GFAP的免疫荧光表达情况Fig.4 The immunofluorescence intensity of GFAP in the spinal dorsal horn of the rats on the first day after administration
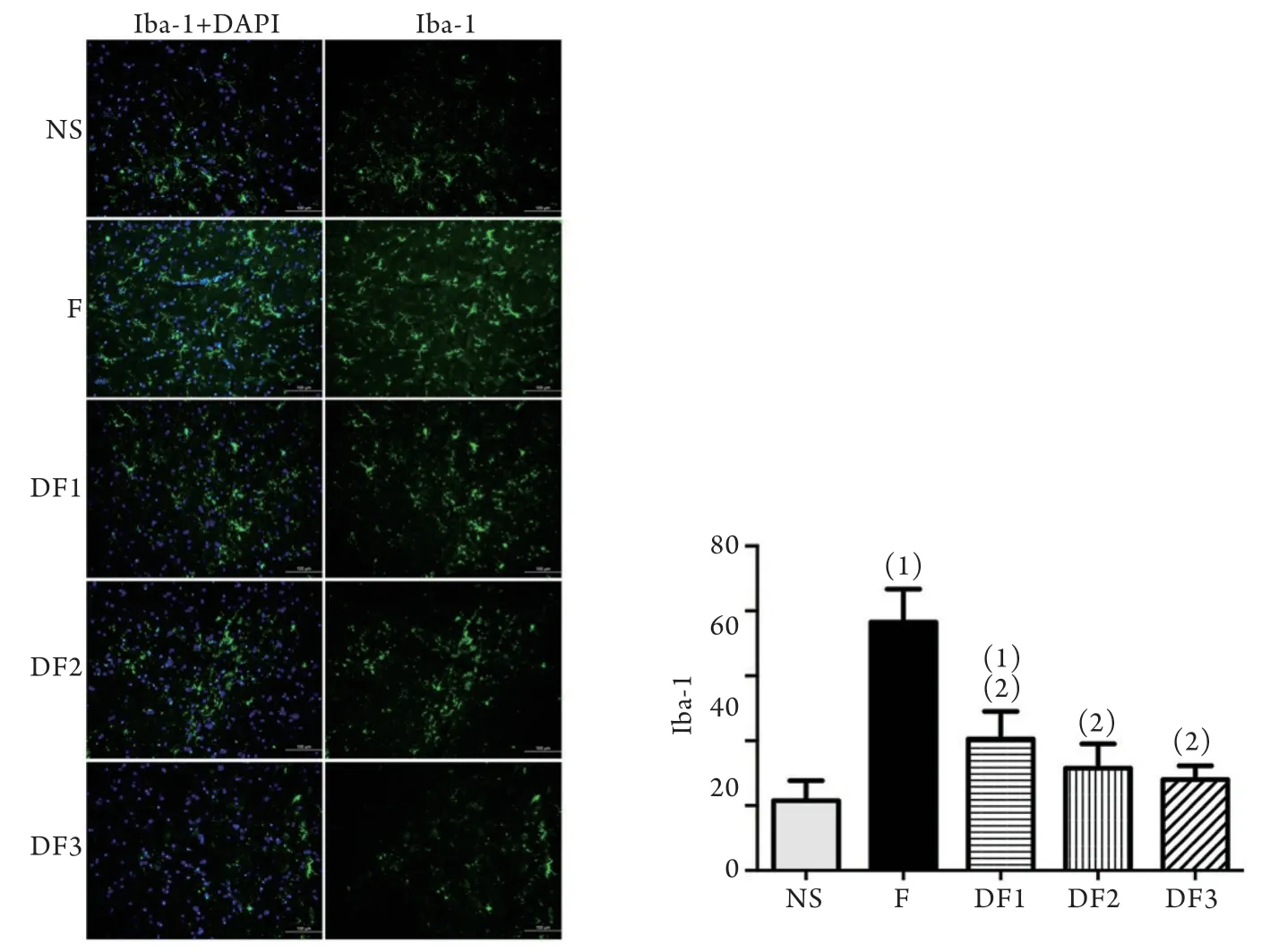
图5 右美托咪定给药后1d大鼠脊髓背角Iba-1的免疫荧光表达情况Fig.5 The immunof luorescence intensity of Iba-1in the spinal dorsal horn of the rats on the first day after administration of dexmedetomidine
3 讨 论
围术期最常见的OIH是由于麻醉过程中患者长时间暴露于瑞芬太尼引起的,其发生机制可能与应用时间长和突然戒断密切相关。但是,由于瑞芬太尼具有严重的呼吸抑制性,限制了其在动物模型中的应用,因此本研究根据Célèrier等[14]和Chang等[15]的研究,选择芬太尼用于大鼠痛觉过敏模型的建立。本研究发现,与应用生理盐水(NS组)的大鼠比较,芬太尼(F组)对大鼠的镇痛效应在给药后2~4h出现高峰,而给药后1~3d出现的低峰区域则显示芬太尼诱发了痛觉过敏效应;而本研究发现右美托咪定与芬太尼合用的两组,即DF2和DF3组在2~4h时间段的镇痛效果要优于芬太尼单用组,本研究结论也验证了Chan等[16]的结论,即右美托咪定可以增强阿片类药物的镇痛效果。而且,在给药后1~5d DF2和DF3两组的痛阈水平与NS组类似,并未发生痛觉过敏,可见右美托咪定在一定剂量下可以防治芬太尼诱发的痛觉过敏。
痛觉调控的机制极其复杂,右美托咪定防治芬太尼诱发的痛觉过敏机制可能是通过发挥其镇痛作用从而抵消痛觉过敏。本研究通过芬太尼诱导建立大鼠痛觉过敏模型,设置不同的给药条件,发现在芬太尼用药前给予一定剂量的右美托咪定可使α2A-AR蛋白表达水平呈剂量依赖性地增加,同时下调iNOS、SP、星形胶质细胞和小胶质细胞标志物的表达。据报道,α2-AR参与痛觉敏化的调控[17-18],而右美托咪定可对包括α2A-AR亚型在内的α2-AR发挥激动作用。星形胶质细胞是中枢神经系统的神经胶质细胞之一,广泛参与神经系统的分化和免疫反应调节[19]。作为中枢神经系统的常驻巨噬细胞,小胶质细胞在神经炎症中发挥着重要作用[20]。星形胶质细胞和小胶质细胞过度激活后可产生过量的炎性介质iNOS,而SP作为一种伤害性神经递质,在脊髓浅层背角的含量随着机械诱发疼痛的减轻而下降[21],提示右美托咪定防治芬太尼诱发的痛觉过敏机制可能与α2A-AR激活,以及抑制星形胶质细胞和小胶质细胞的活性,减少iNOS、SP的表达有关。
综上所述,本研究发现右美托咪定可通过激活α2A-AR抑制星形胶质细胞和小胶质细胞的活化,减少炎症介质释放,使iNOS表达下降,从而使P物质表达下降,对痛觉过敏起到了预防作用。本研究为临床防治OIH提供了新的思路,但右美托咪定防治OIH机制比较复杂,仍有待更多的研究予以进一步阐释。

