红细胞分布宽度及平均血小板体积对自身免疫性肝炎肝硬化的预测与诊断价值
曾婷婷,谭立明,田永建,吴洋,余建林,段新旺,余乐
自身免疫性肝炎(autoimmune hepatitis,AIH)是一种慢性肝脏坏死性炎症,以血清转氨酶、γ-球蛋白和自身抗体水平升高,肝脏大量淋巴细胞浸润及肝脏纤维化为主要特征,具体病因及发病机制至今未明[1]。AIH发病率较低且好发于女性。目前,我国AIH发病情况尚无完善的流行病学调查资料[2-3]。据报道,环境因素、遗传因素、免疫稳态失衡等多种因素的共同作用可能参与了AIH的发生及发展[4-5]。AIH通常起病隐袭,肝脏长期的慢性炎症损伤可致患者肝脏硬化并最终进展为肝功能失代偿[6],严重威胁患者生命。肝脏活检(liver biopsy,LB)仍然是临床诊断肝硬化的“金标准”[7],但它是一种有创性检查,患者常难以接受,限制了其临床应用。大量研究正试图通过常规检查结果建立无创和便捷的病情监测指标作为LB的替代,以减少对患者造成的伤害,准确反映慢性肝病进程。近年来,谷草转氨酶-谷丙转氨酶比值(aspartate aminotransferase to alanine aminotransferase ratio,AAR)、谷草转氨酶-血小板比值指数(aspartate aminotransferase to platelet ratio index,APRI)、基于4因子的纤维化指数(fibrosis index based on the four factors,FIB-4)及γ-谷酰胺转肽酶-血小板比值(gammaglutamyltranspeptidase to platelet ratio,GPR)等一些基于血清或全血检测的指标已被证实在多种肝脏疾病肝脏纤维化预测中有一定的价值[8-9]。
AIH是一种典型的肝脏慢性炎症,肝脏长期炎症是慢性肝病患者发生肝硬化的重要原因[10]。炎症相关指标是否能准确反映AIH患者肝脏硬化状态,目前鲜有报道。已有研究表明,外周血红细胞分布宽度(red blood cell distribution width,RDW)、平均血小板体积(mean platelet volume,MPV)、中性粒细胞-淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)、淋巴细胞-单核细胞比值(lymphocyte to monocyte ratio,LMR)以及血小板-淋巴细胞比值(platelet to lymphocyte ratio,PLR)等是指示全身炎症状态的良好指标,与多种全身性疾病的预后及转归密切相关[11-12]。本研究回顾性分析111例AIH患者RDW、MPV、血小板分布宽度(platelet distribution width,PDW)、NLR、LMR及PLR等炎症相关指标水平,探索上述指标在评价AIH肝硬化中的价值。
1 资料与方法
1.1 一般资料 纳入2012年1月-2017年12月在南昌大学第二附属医院确诊的111例AIH患者[男26例,女85例,年龄(58.1±12.6)岁],其中AIH肝硬化组患者45例[男11例,女34例,年龄(58.6±10.1)岁],AIH慢性肝炎组患者66例[男15例,女51例,年龄(57.7±14.1)岁]。
1.2 纳入及排除标准 纳入标准:临床诊断明确(AIH及肝硬化诊断符合相关指南[2],并经2名风湿免疫科医生确认),有翔实完整的临床、影像及实验室检查资料;采血前1个月内未出现感染性、炎症相关性疾病和血液系统疾病。排除标准:合并AIH以外其他肝脏疾病,如病毒性肝炎、非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD),肝癌(hepatocellular carcinoma,HCC)等;合并严重的心血管系统、血液系统、免疫系统、消化系统或内分泌系统异常;有长期吸烟和酗酒史;妊娠及哺乳期妇女。所有受试对象均已签署知情同意书,自愿参与。
1.3 资料收集及指标检测 患者的病史及一般信息通过南昌大学第二附属医院病例系统查询。采集患者空腹促凝血3ml,分离血清,使用AU5800全自动生化仪(贝克曼库尔特,美国)及配套试剂测定总蛋白(total protein,TP)、白蛋白(albumin,ALB)、谷草转氨酶(aspartate aminotransferase,AST)及谷丙转氨酶(alanine aminotransferase,ALT)水平;枸橼酸钠及EDTA抗凝全血各2ml,分别采用CA7000血凝检测仪、XN20 A1全自动模块式血液体液分析仪(希森美康,日本)及配套试剂检测患者外周血凝血酶原时间(prothrombin time,PT)及国际标准化比值(international normalized ratio,INR)、白细胞(white blood cell,WBC)、血小板(platelet,PLT)、中性粒细胞(neutrophil,N)、淋巴细胞(lymphocyte,L)、单核细胞(monocyte,M)、RDW、MPV、PDW并计算NLR、LMR及PLR等炎症相关指标。所有指标检测操作严格按照仪器使用说明及南昌大学第二附属医院标准化操作程序(standard operation procedure,SOP)文件进行。所有标本各指标重复检测2次,求平均值。标本均在患者知情条件下采集,并得到南昌大学第二附属医院伦理委员会批准。
1.4 统计学处理 采用SPSS 22.0软件进行统计分析。采用K-S检验和Levene检验分别对计量资料的正态性和方差齐性进行分析。正态分布资料以表示,非正态分布资料以M(Q1~Q3)表示。正态分布且方差齐的计量资料组间比较采用独立样本t检验,否则采用Mann-WhitneyU检验。计数资料组间比较采用χ2检验。炎症相关指标(RDW、MPV、PDW、NLR、LMR及PLR)与AIH肝硬化状态的相关性通过二元logistic回归分析评估。绘制受试者工作特征(receiver operator characteristic,ROC)曲线,通过比较曲线下面积(area under the curve,AUC)比较不同指标对AIH肝硬化诊断的价值。P<0.05为差异有统计学意义。
2 结 果
2.1 人口学特征及实验室检查结果 本研究共纳入111例AIH患者,其人口学特征、肝功能、凝血及血常规检查结果如表1所示。AIH患者存在不同程度的肝脏功能异常,血清ALB低于正常参考范围下限,血清酶学及凝血指标均升高。

表1 AIH患者人口学特征及相关指标水平(n=111)Tab.1 Demographics and clinical characteristics of AIH patients (n=111)
2.2 两组患者实验室检查结果比较 AIH肝硬化组与AIH慢性肝炎组人口学特征、肝功能检查结果及基于血常规检测的炎症相关指标对比如表2所示,两组年龄(P=0.702)和性别(P=0.834)组间差异无统计学意义;肝功能相关指标两组间差异有统计学意义(P<0.05);AIH肝硬化组RDW、MPV及NLR等系统性炎症指标明显高于AIH慢性肝炎组(P<0.05)。
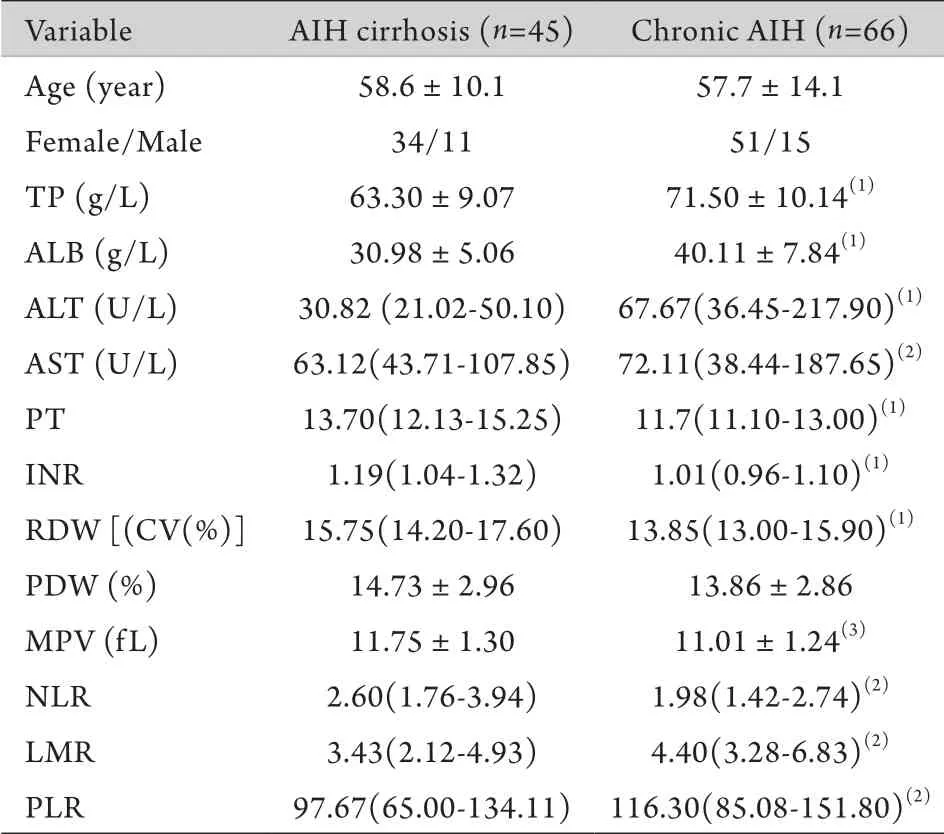
表2 AIH慢性肝炎与AIH肝硬化患者相关指标比较Tab.2 Comparison of clinical characteristics between AIH cirrhosis group and chronic AIH group
2.3 炎症相关指标与AIH肝硬化的关系 单变量logistics回归分析显示,RDW、MPV及NLR与AIH肝硬化相关(P<0.05),OR(95%CI)分别为1.392(1.165~1.664)、1.584(1.153~2.175)和1.272(1.023~1.581)。经多变量调整后RDW(OR=1.349,95%CI 1.128~1.614,P=0.010)及MPV(OR=1.465,95%CI 1.044~2.056,P=0.027)被证实是AIH患者出现肝硬化的独立危险因素(表3)。

表3 AIH肝硬化危险因素的单变量及多变量logistic回归分析Tab.3 Univariate and multivariate logistic regression of risk factors for AIH cirrhosis
2.4 炎症相关指标的诊断价值 ROC曲线分析显示,RDW及MPV诊断AIH肝硬化的AUC分别为0.736(0.644~0.827)和0.675(0.572~0.778),RDW对AIH肝硬化的鉴别能力稍高于MPV,对肝硬化的诊断价值较低(图1)。
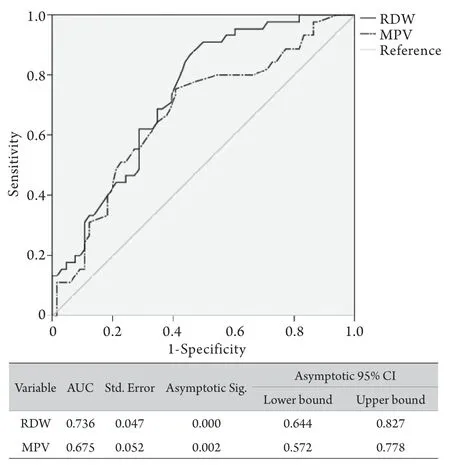
图1 AIH肝硬化患者RDW和MPV诊断的ROC曲线Fig 1 ROC curves of RDW and MPV for AIH cirrhosis diagnosis
3 讨 论
AIH的疾病特点、疾病进程及发病人群均具有明显的异质性。由于大多数AIH患者缺乏特异性疾病表现,其临床诊断和治疗仍然面临巨大的挑战[2]。AIH通常隐匿起病且呈慢性进程,临床表现相对较轻的患者在疾病进程中无法得到足够的治疗。当出现明显的疾病表现时,通常已经发生严重肝脏损伤甚至肝硬化。因此,找到能够准确反映疾病进展的方法尤为重要。LB是目前诊断肝硬化的“金标准”[6],但是患者接受度低、并发症风险高、多种禁忌证及较大的采样误差等限制了其作为监测慢性肝病患者病程的方法在临床的应用[13]。近年来,一些基于血常规检测及肝功能检测结果建立的无创性指标已被证实在病毒性肝炎、NAFLD乃至HCC等多种疾病进展评估及预后判断中具有一定价值,越来越受到研究者关注[8-9,14-15]。
肝脏是人体重要的蛋白合成器官,多种参与重要生命活动的物质都由肝脏合成。当肝功能受到不同病因损伤时,肝脏合成功能下降导致患者出现相应症状,如各类蛋白质及酶类合成不足将导致患者出现倦怠、消瘦、厌食等全身症状,凝血酶合成减少造成患者出现严重的凝血障碍及出血倾向,随着肝脏进一步受损,症状将逐步加重[16]。本研究中血清检测发现AIH患者均存在不同程度的肝功能指标异常,血清ALB水平为(34.41±8.17)g/L,说明AIH患者存在肝脏合成功能异常。
长期慢性炎症导致受损肝细胞不断再生是肝硬化的重要成因[10]。近年来,RDW、MPV、NLR、LMR及PLR等基于血常规检查构建的简易指标已被大量文献报道可用于指征系统性炎症状态,对病毒性肝炎和HCC等多种肝脏疾病病情判断和预后评估有重要临床意义[14-15],同时在反映病毒性肝炎肝硬化中具有一定价值。Coskun等[17]对144例慢性丙肝患者回顾性分析NLR及血小板形态参数等指标预测肝硬化的能力,结果显示严重肝脏纤维化的患者血小板压积(plateletcrit,PCT)水平明显降低,而NLR与慢性丙肝肝硬化无关联。此外,He等[18]研究证实RDW和1/PLR是估计病情严重程度的指标,两者均与慢性丙肝肝硬化相关,诊断肝硬化的AUC分别为0.791±0.045和0.713±0.055,且二元logistics回归证实RDW为肝硬化发生的独立危险因素(OR=1.494,95%CI 1.036~2.155,P=0.032)。本研究回顾性分析了AIH患者RDW、MPV、PDW、NLR、LMR及PLR等基于血常规的简易指标水平,评价了这些指标与AIH肝硬化的关系。结果显示,除了PDW,其他5项指标在AIH肝硬化组患者中均明显高于AIH慢性肝炎组(表2),与AIH患者存在全身炎症状态相符。肝病患者通常合并造血系统异常,其中以血小板减少症多见[19]。本研究中AIH患者平均血小板计数为146.00×109/L,AIH合并肝硬化患者血小板计数仅为88.00×109/L,下降程度较AIH慢性肝炎患者更为明显(数据未列出)。急慢性炎症状态下血小板可被激活,除外血小板计数的多种血小板相关指标都被证明与机体炎症存在关联[20]。除此之外,Purnak等[21]研究证实高MPV水平与慢性丙肝患者严重肝脏纤维化相关,结合其他指标检测可提示慢性丙肝患者的肝纤维化程度。本研究中AIH肝硬化患者MPV水平明显高于AIH慢性肝炎组[(11.75±1.30)fLvs.(11.01±1.24)fL,P=0.003]。
RDW为红细胞形态相关参数,其水平升高与机体炎症及营养状态相关[22],并且近年来研究已证实RDW与病毒性及NALFD性肝硬化相关[18,23]。RDW与肝硬化关联的具体机制至今尚未阐明,可能与机体炎症状态及肝功能受损导致造血功能受到抑制,同时导致造血原料不足和血细胞成熟障碍,以致大量不成熟的小体积红细胞释放入血相关。本研究中,经二元logistic回归单变量分析及多变量调整,所有炎症相关指标中仅RDW和MPV被证实是AIH患者发生肝硬化的危险因素,与AIH肝硬化独立相关,OR(95%CI)分别为1.349(1.128~1.614)和1.465(1.044~2.056),与国内外研究报道基本一致。另外,经ROC曲线分析,RDW对AIH肝硬化的诊断能力较MPV高,二者的AUC分别为0.736和0.657。以上结果提示,临床工作中可通过常规监测RDW和MPV水平来预测AIH患者发展为肝硬化的风险,以减少LB对低硬化风险患者造成的不必要的伤害,而高RDW和MPV水平的患者则更需要强调LB检查,以早期确诊并尽早进行干预。
目前,国内外通过无创性指标预测AIH肝硬化发展的报道鲜见。本文回顾性分析了AIH患者无创性炎症相关指标水平并评价了各指标在AIH肝硬化中的价值,发现RDW和MPV是AIH发生肝硬化的独立危险因素,对AIH肝硬化诊断具有一定参考价值,可作为监测AIH患者病程进展的参考指标。由于相比其他肝脏疾病,AIH的发病率和确诊率较低,同时炎症性指标影响因素较多,本研究存在样本量小且未对AIH肝硬化患者进行肝纤维化分级等局限。因此,RDW及MPV检测对AIH肝硬化进程监测的价值仍需通过多中心、大样本研究进一步证实。

