中性粒细胞与淋巴细胞比值对宫颈癌患者同步放化疗疗效及预后判断的临床意义
王一然 黄 维 尹 蕾 刘 琳 周晓平 牛星鉴 杨 悦 安巍巍 姬宏飞
近年来,随着诊断和治疗水平的提高,宫颈癌的发病率和死亡率呈现下降趋势,但仍是全球范围内导致女性死亡的第二大恶性肿瘤,近三分之一的死亡是由于癌症的复发和进展[1]。临床上根据国际妇产科联盟(FIGO)制定的标准(依据肿瘤大小、阴道及宫旁受累、膀胱及直肠扩散、远端转移)确定宫颈癌分期和相应的治疗方案(手术、放疗、放化疗结合),FIGO分期中所体现的临床参数一定程度上可用来判断宫颈癌患者的预后情况[2],晚期宫颈癌患者预后明显较差[3]。然而FIGO分级在临床上同样存在其不确定性,尤其在晚期癌症患者中表现更为明显。因此亟需发现一些其他的预后判定指标,对现有的临床预后指征进行补充,以便更为准确全面地评估和监测宫颈癌患者的预后情况。
炎症在肿瘤的发生和发展中扮演重要角色,一些炎症指标还可以作为结直肠癌、肺癌、胃癌、肝癌患者的独立预后因素[4]。本课题组在Luminal型乳腺癌及弥漫大B细胞淋巴瘤里发现,治疗前淋巴细胞数与单核细胞数比值(Lymphocyte to monocyte ratio,LMR)可以作为患者预后的判断指标,LMR高的患者往往预后较好[5-6]。与其类似的,中性粒细胞数(ANC)和淋巴细胞数(ALC)同样也可反映机体自身的系统性免疫状态,研究表明在多种肿瘤中,患者治疗前ANC升高或ALC降低都可能是预后不良的指标[7]。中性粒细胞与淋巴细胞的比值(Neutrophils to lymphocytes ratio,NLR)反映了机体中性粒细胞与淋巴细胞的整体情况,能综合反映重症患者的免疫状态[8],进而提示患者的预后[9]。在妇科恶性肿瘤中,治疗前NLR与CA125联合指标可以作为诊断卵巢癌的标记,高NLR也预示了卵巢癌的不良预后[10]。目前NLR是否与宫颈癌患者预后密切相关,尚缺乏相关的临床研究。本研究旨在宫颈癌患者中探究NLR对宿主免疫状态的预测作用,确定其相应的最佳诊断值来评估宫颈癌患者的预后。
1 材料与方法
1.1 一般资料
选取2006年3月—2009年6月在哈尔滨医科大学附属肿瘤医院接受治疗的宫颈癌患者(ⅠB~ⅢB)247例,对患者的基本特征、化验结果、临床分期、病理报告和预后情况进行回顾性分析。排除标准:(1)无血常规资料;(2)有急慢性损伤、自身免疫性疾病、血液系统疾病;(3)合并有其他严重疾病;(4)未按医嘱进行正规治疗;(5)随访资料缺失或失访;(6)患有多发肿瘤或术前经过放化疗的病例。247例患者年龄28~82岁,中位年龄48岁,基本情况见表1。本研究经哈尔滨医科大学附属肿瘤医院伦理委员会审查通过,并经患者签署知情同意书。

表1 247例宫颈癌患者一般特征
1.2 治疗方法
247例患者均接受同步放化疗治疗。放疗(RT)方案为常规方案:体外10~15 MV光子全盆照射,总剂量50.4 Gy(每次1.8 Gy,每周5次),对于有髂淋巴结转移者利用四野箱式照射。体外放疗开始4~5周后开始高剂量率近距放射治疗,按照国际辐射单位与测量委员会(ICRU)建议的剂量,A点照射总剂量24 Gy(每次4 Gy,每周2次)。根据患者病理不同,同步化疗采用两种方案:TP方案(顺铂+紫杉醇;137例,55.5%)和PF方案(顺铂+5-FU;110例,44.5%)。
1.3 随访情况
患者在治疗出院后以门诊及电话方式进行随访。患者在前两年每三个月进行一次后续检查,3~5年每六个月进行一次,此后每一年进行一次。所有患者均接受哈尔滨医科大学附属肿瘤医院随访。根据随访记录获得无进展生存期(Progress free survival,PFS)和总生存期(Overall survival,OS)。PFS定义为确诊日期到观察到疾病进展或者死亡的时间,OS定义为确诊日期到死亡或末次回访的时间。
1.4 统计分析
利用SPSS 22.0软件分析患者各项特征、病理资料和化验结果等。用ROC方法评估NLR对宫颈癌患者预后的有效性,以约登指数(敏感性+特异性-1)最大确定最佳分界值,用χ2检验和Fisher精确检验分析比较各项参数与NLR水平的关系,建立Cox比例风险模型,分析预后影响因素,Kaplan-Meier法绘制OS和PFS生存曲线,Log-rank检验分析组间差异,P<0.05为差异具有统计意义。
2 结果
2.1 NLR预测宫颈癌患者放化疗后复发
ROC曲线结果显示,宫颈癌患者NLR的ROC曲线下面积(AUC)为0.591(95%CI:0.519~0.663),对宫颈癌复发有较好的诊断价值(P=0.014);ALC的AUC为0.561,ANC的AUC为0.551,均无诊断价值(P>0.05)(图1)。兼顾敏感性(0.732)及特异性(0.459),得出NLR水平的最佳分界值为2.08。

图1 宫颈癌患者治疗前外周静脉血NLR、ALC、ANC的ROC曲线Figure 1 ROCs for pre-treatment NLR,ALC and ANC in cervical carcinoma patients
2.2 NLR水平与临床指征的关系
将患者分为治疗前高NLR组(≥2.08,162例)和低NLR组(<2.08,85例)。与低NLR组患者相比,高NLR组患者的平均ALC水平低,平均ANC水平高,差异具有统计学意义(P<0.001)。
患者的年龄(P=0.563)、淋巴结转移情况(P=0.646)与NLR水平无关;FIGO分期(P<0.001)、分化程度(P=0.002)、组织学类型(P=0.003)与NLR水平有关,差异有统计学意义(表2)。
2.3 NLR分组和化疗方案情况与宫颈癌患者同步放化疗预后的关系
将247例宫颈癌患者分为低NLR组及高NLR组,用Kaplan-Meier方法绘制总生存曲线及无进展生存曲线,Log-rank检验显示差异有统计学意义(P<0.001),低NLR组患者的PFS和OS显著延长(图2)。

图2 宫颈癌患者治疗前NLR水平对生存的影响Figure 2 Kaplan-Meier curves for OS and PFS of patients according to optimal cutoff points of pre-treatment NLR
根据化疗方案将患者分为PF方案组(n=110)和TP方案组(n=137)。Kaplan-Meier法绘制无病生存曲线,结果表明采用PF方案化疗者,低NLR患者的OS和PFS 比高NLR患者显著延长(P<0.05)(图3)。TP方案化疗者治疗前NLR水平与生存无统计学差异(P>0.05)。表明宫颈癌患者治疗前NLR水平可以作为PF方案化疗患者预后的预测手段,对TP方案化疗患者预后的提示作用不明显。
2.4 宫颈癌患者临床病理和NLR等因素对患者生存的影响
为了探究临床病理和NLR等因素对宫颈癌患者同步放化疗预后的影响,以年龄、淋巴结转移、FIGO分期、肿瘤分化、组织学类型、治疗方案和NLR为自变量,进行多因素Cox回归分析,结果显示,NLR、FIGO分期是预后的潜在预测指标,而年龄、淋巴结转移情况、肿瘤分化程度、组织学类型和治疗方案与OS和PFS无关(P>0.05)(表3)。

表2 宫颈癌患者临床病理学指征与NLR分组的关系

图3 宫颈癌患者治疗前NLR水平对不同治疗方案下生存的影响Figure 3 Kaplan-Meier curves for OS and PFS in patients with different chemotherapy regimen according to optimal cutoff points of pre-treatment NLR
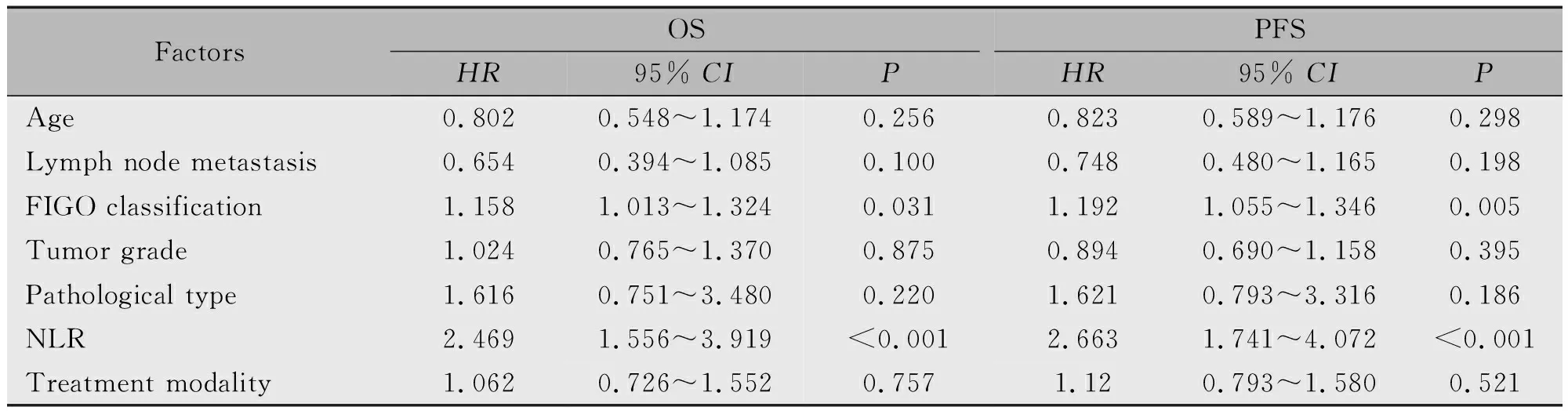
FactorsOSHR95% CIPPFSHR95% CIPAge0.8020.548~1.1740.2560.8230.589~1.1760.298Lymph node metastasis0.6540.394~1.0850.1000.7480.480~1.1650.198FIGO classification1.1581.013~1.3240.0311.1921.055~1.3460.005Tumor grade1.0240.765~1.3700.8750.8940.690~1.1580.395Pathological type1.6160.751~3.4800.2201.6210.793~3.3160.186NLR2.4691.556~3.919<0.0012.6631.741~4.072<0.001Treatment modality1.0620.726~1.5520.7571.120.793~1.5800.521
3 讨论
近年来,肿瘤患者治疗前炎症指标与预后的关系逐渐受到关注。许多研究表明,炎症指标不仅反映了机体的免疫状态,在某些癌症中还可作为独立预后因素。在Luminal型乳腺癌及弥漫大B细胞淋巴瘤中发现,治疗前LMR高的患者预后更好,然而在宫颈癌中我们发现患者预后与LMR水平相关性不显著。
有报道称,外周血高水平中性粒细胞数和低水平淋巴细胞数都可能对生存有负面影响[7,11]。虽然中性粒细胞和淋巴细胞都能作为炎症标记物进行研究,但是在我们的研究中发现,患者治疗前ANC和ALC与预后相关性不显著,说明单一计数结果并不稳定,因此能从整体反映炎症水平的NLR可能更具有临床诊断价值。
本研究将247例患者分为高NLR组和低NLR组(界值2.08),发现高NLR患者生存时间明显较长,且NLR水平与临床分期和病理类型显著相关。Lee等[12]分析了1 061例ⅠB~ⅣA期的患者病历资料,结果显示NLR(界值1.9)是一个较好的预测宫颈癌患者预后的指标,高NLR患者更容易复发和死亡。Mizunuma等[13]发现放疗患者中高NLR者总生存率更低。Wang等[14]发现治疗前NLR与接受根治性手术治疗和化疗患者的预后无关,但高NLR(>2.5)与FIGO分期、淋巴结转移和肿瘤大小相关。虽然各研究确定的NLR界值不统一,但高NLR提示预后不良已经成为共识,治疗前NLR水平可以作为一个较好的预后评价指标,进一步深入研究还可能为治疗方式的选择提供新思路。
此外,本研究发现PF方案化疗的患者NLR水平低对化疗药物更敏感,这与本课题组在乳腺癌患者中的研究结果相似[5-6]:高LMR使用CEF(环磷酰胺+表柔比星+5-FU)方案化疗的乳腺癌患者比使用TEC(环磷酰胺+表柔比星+紫杉醇)方案化疗的患者PFS明显延长。这些治疗方案的区别仅在于5-FU和紫杉醇这两种药物。CD8+T细胞可通过FAS/FASL途径杀伤肿瘤细胞[15]。细胞实验证实,5-FU处理的MCF-7乳腺癌细胞较紫杉醇处理的细胞FAS表达明显增高;5-FU的肿瘤杀伤作用随CD8+T细胞数量增多而增强,即5-FU的效能依赖免疫细胞的数量。因此,体内固有免疫水平高(LMR高或NLR低),有较多的CD8+T细胞等免疫细胞浸润到肿瘤周围,5-FU能够最大程度地杀伤肿瘤细胞,患者预后较好。本研究结果显示,NLR对PF方案化疗患者的预后风险评价更具有指导意义;若进一步研究还可能发现肿瘤患者治疗前的炎症水平对确定治疗方案的指导作用。
综上所述,宫颈癌患者术前NLR水平与肿瘤相关预后因素有关,NLR作为炎症标记物能帮助预测宫颈癌患者手术疗效和预后情况。NLR具有容易测量、可重复采集和价格低廉的特点,可以应用于临床作为评估宫颈癌预后的指标。

