TACC3和p53蛋白在原发性肝癌组织中的表达及其临床意义
贺 伟 母齐鸣 王 刚 万 波 廖 波 杨 娟
原发性肝癌是肝细胞或肝内胆管细胞发生的癌症,严重威胁人类健康[1]。我国每年新增原发性肝癌患者400万左右,占全球原发性肝癌总患者50%左右。由于肿瘤迅速生长,使肝包膜张力增加,多数病人以肝区疼痛(刺痛或胀痛、持续性钝痛)就诊[2-3]。我国70%的原发性肝癌由乙肝引起,其次为丙肝及饮酒,黄曲霉毒素是我国潮湿地区原发性肝癌发病的高危因素。原发性肝癌易扩散,手术效果不佳,且对放疗不敏感,三年生存率较低,因此探讨原发性肝癌的发病机制具有重要意义[4]。TACC3在多种外周组织包括心脏、大脑、脾脏、肾脏、胃等多种组织中正常表达,其配体对胚胎发育、免疫系统调控、血管生成和肿瘤转移等方面发挥着重要作用,作为非机动微管相关蛋白家族的重要成员,TACC3对于细胞有丝分裂的持续性和稳定性具有重要的调控作用[5-7]。p53是与人类肿瘤相关性最高的蛋白因子,其基因定位于17p13.1,p53蛋白主要分布于细胞核,能与DNA特异结合,其活性受磷酸化、乙酰化、甲基化、泛素化等翻译后修饰调控,p53基因突变后,p53蛋白空间构象发生改变,失去了对细胞生长、凋亡和DNA 修复的调控作用,对细胞的增殖失去控制,导致细胞癌变[8-9]。目前关于TACC3蛋白和p53蛋白与原发性肝癌关系的研究较少,因此本研究拟探讨TACC3和p53蛋白在原发性肝癌组织中的表达及其临床意义,为原发性肝癌的治疗提供理论及临床依据。
1 资料与方法
1.1 一般资料
选取2011年4月—2014年5月在中航工业三六三医院肝胆外科行手术治疗并经病理证实的原发性肝癌患者138例,所有患者行辅助检查:血常规、尿常规、血生化、肝脏病理组织检查,其中男113例,女25例,年龄为40~74岁,平均(57.5±17.8)岁,病程为9个月~4年;肝功能分级A 级82例、B级10例、C级31例、D级15例;单纯乙肝患者108例,单纯丙肝患者42例,乙肝丙肝共患者12例;AST(14.8~98.9)U/L,平均(57.5±43.8)U/L;ALT(0~104.9)U/L,平均(56.9±69.4)U/L;肝细胞癌74例、胆管细胞癌45例、混合细胞癌19例。病理分期采用TNM分期(AJCC癌症分期手册)。符合美国国家综合癌症网(National Comprehensive Cancer Network,NCCN)公布的2005版《Occult primary cancer clinical practice guidelines》中关于原发性肝癌的诊断标准[10]。手术切除标本后行病理检查以判定TNM分期、病理学分级、有无复发、浸润深度、有无淋巴血管间隙浸润、肿瘤最大径、有无淋巴结转移。同时取距原发性肝癌组织5 cm以上的组织为癌旁组。患者自愿提供癌旁组织及原发性肝癌组织标本,用作分析TACC3和p53蛋白的表达。
1.2 ELISA测定TACC3、p53蛋白水平
所有实验操作均为无菌操作,实验所有器具高压灭菌,37℃烘干。保存在-70℃冰箱中的癌旁组织、原发性肝癌组织取出解冻。称取0.5 g癌旁组织、原发性肝癌组织,加入少量液氮,在微波碾磨仪(5 000 r/s)中迅速将其碾碎至粉末状;将组织粉末转入1 mL Eppendorf管,加入0.8 mL PBS(pH7.4),充分振荡混匀,2 000 g,4℃,离心20 min。仔细收集上清液。获取癌旁组织、原发性肝癌组织匀浆后,采用ELISA法检测癌旁组织、原发性肝癌组织的TACC3、p53蛋白表达量。
1.3 TACC3、p53在癌旁组织、原发性肝癌组织的表达水平的测定
免疫组化法测定TACC3、p53在癌旁组织、原发性肝癌组织中的表达,制作常规5 μm的癌旁组织、原发性肝癌组织石蜡切片,3% 的H2O2液常温阻断内源性过氧化氢酶活性,微波修复抗原,PBS常规冲洗,1% 的TACC3、p53抗体工作液(稀释浓度1∶200),4℃过夜,加入二抗(IgG),室温30 min,加链霉素抗生物素蛋白-过氧化物,PBS冲洗,DAB显色,苏木素复染,(50%、60%、80%、90%、95%、100%)梯度酒精脱水,二甲苯透明,封片。随机选取5个高倍视野(×400)计数,无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分,同时计数;>50% 为(+++),26%~50% 为(++),6%~25% 为(+),阳性细胞≤5% 为(-),(-)及(+)归为不表达组或低表达组即为阴性,(++)及(+++)归为高表达组即为阳性。
1.4 随访
随访起始日期为肝癌术后第1天,随访截止日期为患者死亡日期或末次随访日期。随访方式为电话,随访内容为:手术效果、恢复情况、病情变化、生存质量、生存状态、死亡及死亡时间。
1.5 统计学方法
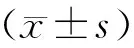
2 结果
2.1 癌旁组和原发性肝癌组中TACC3、p53蛋白水平的表达
原发性肝癌组TACC3蛋白表达水平高于癌旁组(347.90±7.99vs. 36.78±5.97),p53蛋白表达水平高于癌旁组(308.78±8.09vs. 43.08±9.77)(P<0.05)(表1)。

表1 癌旁组和原发性肝癌组中TACC3、p53蛋白水平的表达
2.2 癌旁组织和原发性肝癌组织中TACC3、p53表达率的比较
原发性肝癌组TACC3阳性率高于癌旁组(75.3%vs8.0%)、p53阳性率高于癌旁组(78.2%vs15.9%)(P<0.05)(图1,表2)。
2.3 原发性肝癌组TACC3、p53蛋白表达与临床病理特征的关系
原发性肝癌组TACC3、p53蛋白表达与年龄无关(P>0.05);与TNM分期、病理学分级、复发、浸润深度、淋巴血管间隙浸润、肿瘤最大径、淋巴结转移有关,且TNM分期越高、病理学分级越高、有复发、浸润深度越深、有淋巴血管间隙浸润、肿瘤最大径≥5 cm、有淋巴结转移,TACC3、p53蛋白阳性表达率越高(P<0.05)(表3)。
2.4 TACC3、p53蛋白表达水平与原发性肝癌患者预后的关系
经卡方及Log-rank检验,TACC3、p53阴性组3年生存率及生存期明显高于TACC3、p53阳性组(P<0.05)(图2,表4)。

图1 TACC3、p53在癌旁组、原发性肝癌组中的表达Figure 1 Expression of TACC3 and p53 protein in the paracancerous and primary liver cancer tissuesNote:A.TACC3 protein was expressed in the paracancerous group;B.TACC3 protein was expressed in the primary liver cancer group;C.p53 protein was expressed in the paracancerous group;and D.p53 protein was expressed in the primary liver cancer group.
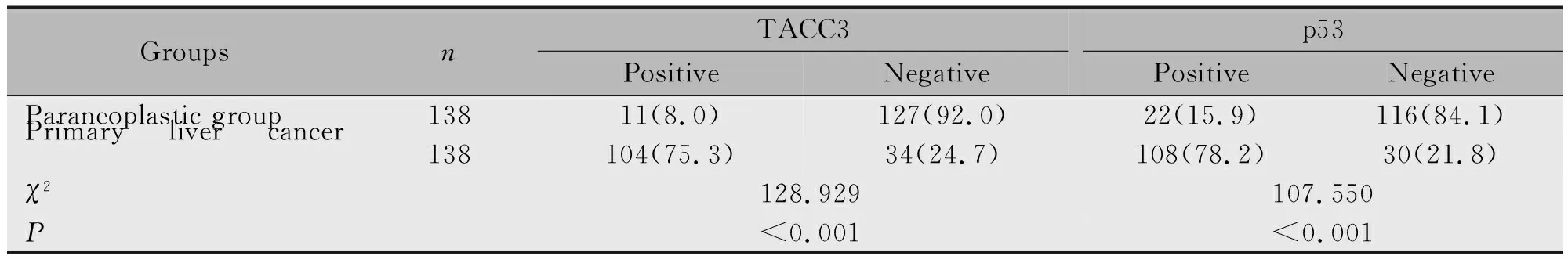
GroupsnTACC3PositiveNegativep53PositiveNegativeParaneoplastic group13811(8.0)127(92.0)22(15.9)116(84.1)Primary liver cancer group138104(75.3)34(24.7)108(78.2)30(21.8)χ2128.929107.550P<0.001<0.001

表4 不同TACC3、p53蛋白表达原发性肝癌患者预后比较

表3 原发性肝癌患者TACC3、p53蛋白表达与临床病理特征的关系

图2 TACC3、p53阳性/阴性患者生存曲线比较Figure 2 Comparison of survival curve of the positive and negative groups of TACC3 and p53
3 讨论
TACC3是原癌基因,其结构、功能的异常与遗传性及散发性肿瘤均相关。研究发现,TACC3在调节人体细胞的复制、遗传物质DNA损伤修复、细胞的正常生长方面有重要作用[11-12]。作为Aurora A的作用底物,TACC3过表达导致Aurora A活性增强,进而激活Akt/RAS/MEK/ERK信号通路,促进细胞恶性转化[13]。TACC3也是上皮-间质转化中的启动子,能被内皮细胞、成纤维细胞、免疫细胞膜上的受体激活,促进肿瘤进展。研究表明,若Wnt信号通路异常,则TACC3过表达,胞质内游离的β-catenin进入胞核,激活下游癌基因(p53、Ras等),促进癌细胞增殖[14]。本研究中,原发性肝癌组TACC3阳性率高于癌旁组,原发性肝癌组TACC3水平高于癌旁组,这与上述讨论中TACC3促进细胞恶性转化,促进癌细胞增殖一致。肿瘤细胞的侵袭,转移与基质金属蛋白酶MMP2、MMP9密切相关,TACC3能明显增强MMP2、MMP9的表达,提示TACC3高表达对肿瘤的远处转移能力有指示作用,此外TACC3可诱导肿瘤细胞分泌更多的白细胞介素-10、白细胞介素-8、血管内皮生长因子(VEGF)、转化生长因子β(TGF-β)等,而上述免疫抑制性细胞因子能诱导实体肿瘤的发展并加速肿瘤血管系统的生长速度[15]。本研究结果提示,TNM分期越高、病理学分期越高、有复发、浸润深度越深、有淋巴血管间隙浸润、肿瘤最大径≥5 cm、有淋巴结转移,TACC3蛋白阳性表达率越高,也说明TACC3高表达,能诱导实体肿瘤的发展并加速肿瘤血管系统的生长速度。本研究中TACC3阴性组3年生存率及生存期明显高于TACC3阳性组,这说明TACC3具有促进癌细胞分化与侵袭迁移能力的作用,TACC3高表达能明显降低原发性肝癌患者预后。
p53在Hedgehog 信号通路扮演着核心调节作用,配体(Shh)未与跨膜蛋白受体(Ptch)结合时,Ptch 抑制跨膜蛋白受体(Smo)的活化,Smo 被释放,其下游细胞因子p53被活化,促进p53移位到细胞核内,进而激活下游原癌基因[16-17]。本研究中,原发性肝癌组p53水平高于癌旁组,原发性肝癌组p53阳性率高于癌旁组,说明原发性肝癌组原癌基因激活,p53表达高度活化,这与上述结论一致。此外高度表达p53的乳腺癌细胞株增殖能力高于野生株。高表达p53蛋白的肿瘤细胞黏附内皮细胞的能力强,而肿瘤细胞与内皮细胞紧密结合,才能穿过细胞外基质层,建立转移灶[18]。p53基因突变一般发生于肿瘤的早期,p53基因突变后,处于高度活化状态,且不受EGFR信号通路的调控,即使使用EGFR拮抗剂阻断了上游信号转导,突变的p53的仍可发挥其促肿瘤增殖作用,EGFR拮抗剂对p53基因突变的恶性肿瘤患者不能发挥抗肿瘤作用[19]。本研究结果提示,TNM分期越高、病理学分级越高、有复发、浸润深度越深、有淋巴血管间隙浸润、肿瘤最大径≥5 cm、有淋巴结转移,p53蛋白阳性表达率越高,说明p53在肿瘤组织中表达增加。p53蛋白主要分布于细胞核,能与DNA特异结合,p53通过调节转录因子控制细胞周期,在G1期检查DNA损伤点,监视基因组的完整性。如有损伤,p53蛋白阻止复制;如果修复失败,p53蛋白则引发细胞调亡;p53突变或缺失后,细胞周期失调,基因异常表达,并出现染色体重排和某种特征的恶性表型[20]。本研究同时也发现p53阴性组3年生存率明显高于p53 阳性组,说明p53具有促进癌细胞分化与侵袭迁移能力的作用,p53低表达能明显提高原发性肝癌患者预后。
综上所述,原发性肝癌组织中TACC3、p53蛋白表达量增加,其与原发性肝癌的进展密切相关;TACC3、p53蛋白低表达能提高原发性肝癌患者预后。

