蛋白质精氨酸甲基转移酶5参与膀胱癌发生、发展的相关性研究
徐卫东, 顾 晓
(1. 扬州大学, 江苏 扬州, 225000; 2.南京鼓楼医院集团仪征医院, 江苏 仪征, 2214003. 扬州大学 临床医学院, 江苏 扬州, 225000)
膀胱癌是全球范围内泌尿生殖系统最常见的恶性肿瘤之一[1-4]。膀胱癌早期症状不明显,且早期的诊断技术特异性和灵敏性欠佳,患者诊断膀胱癌时多已是中晚期[5-8]。目前,膀胱癌的复发率和转移率还是较高,加强膀胱癌发病风险及其分子机制研究,对早期发现以及后期个体化治疗有着深远的意义[9-13]。蛋白质精氨酸甲基转移酶(PRMTs)在蛋白质的甲基化中起着十分重要的作用[14-16]。PRMTs在真菌、高等植物以及无脊椎和脊椎动物中都有着广泛的表达,能够将S-腺苷甲硫氨酸上的甲基转移到底物蛋白胍基上,从而影响RNA转录、RNA剪接、DNA修复、细胞周期、细胞增殖凋亡等多种细胞生物学过程[17-20]。现在已经发现的PRMTs家族成员有11个,根据催化精氨酸甲基化方式的不同,可将其主要分为以下3种类型[21]: ① Ⅰ型PRMT家族成员,包括PRMT 1~4、PRMT6、PRMT8, 其可以催化形成单甲基精氨酸(MMA)和非对称二甲基精氨酸(ADMA); ② Ⅱ型PRMT家族成员,包括PRMT5、PRMT9, 可以催化形成MMA 和对称性二甲基精氨酸(SDMA); ③ PRMT7是唯一的Ⅲ型PRMT, 只能催化形成MMA。PRMT5是一种非常重要的II型PRMT, 在所有研究的真核生物中都发现了它的存在,其作为一种表观遗传酶,能够对称性地甲基化组蛋白或者非组蛋白底物的精氨酸残基,影响靶基因的表达或者信号分子的翻译后修饰,调节多种细胞过程,发挥着不同生物学功能[17-18, 22-23]。大量研究[24-30]表明, PRMT5在多种肿瘤中显著高表达,如在乳腺癌、肺癌、淋巴瘤、恶性胶质瘤、卵巢癌、黑色素瘤、结直肠癌以及白血病等疾病中表达水平都较正常人群增高,发挥着癌基因作用。
大量证据表明PRMT5可能是临床肿瘤筛查的重要标志物。本研究检测PRMT5在膀胱尿路上皮癌中的表达情况,探讨其在膀胱尿路上皮癌发生、发展及预后中的意义。通过癌症基因组图谱(TCGA)公共数据集,在RNA水平研究PRMT5在膀胱癌及正常组织中的表达水平及其对预后生存的影响,在此基础上再通过组织芯片进行免疫组化实验,在蛋白水平验证上述结果,现将结果报告如下。
1 材料与方法
1.1 癌症和肿瘤基因图谱数据库
TCGA是美国政府2005年发起资助的癌症研究项目,是目前最大的癌症基因信息数据库,目前主要由美国国家癌症研究所(NCI)和国家人类基因组研究所(NHGRI)共同维护。TCGA通过大规模的高通量的基因组测序及生物信息学分析,系统地汇总并揭示疾病的遗传突变信息,了解癌细胞发生、发展的机制,为疾病的预防、诊断以及治疗提供了理论基础,最后勾画出新型“预防癌症的策略”。TCGA数据库中的每个样本包含多种基因组学信息,有基因表达谱数据、基因分型数据、全基因组DNA甲基化表达数据以及microRNA表达数据等。本研究下载了TCGA数据库中的349例膀胱癌患者的基因表达谱及相关的临床信息进行后续研究。
1.2 实验样本
1.2.1 样本收集: 收集2007-2011年南京医科大学第一附属医院以及江苏省中医院接受手术治疗的56例膀胱癌病例,在签署知情同意书后,采集其癌组织和癌旁组织。所有患者术前未接受化疗,有完整的临床资料及术后回访资料。所有标本均在手术切除后10 min内收集, 4%中性福尔马林固定,经石蜡包埋和组织切片进行免疫组织化学染色。所有病例是组织病理学确诊的膀胱癌患者。
1.2.2 流行病学调查: 对调查人员进行统一培训,并且设计好统一的调查表,然后采用面对面的方式调查研究对象。调查内容主要包括年龄、性别、吸烟史、饮酒史、临床分期、病理分级、肿瘤大小以及有无淋巴结转移等。自2014年3月对调查对象进行跟踪随访。所有结果使用EpiData 3.1进行双轨录入,并进行逻辑校对。
1.3 实验方法
1.3.1 组织芯片: 将HE染色切片进行病理诊断,并对病变组织的范围进行标记; 按照实验目的设计组织芯片阵列的组织类型和排列方式; 在组织数据库中选择合适的组织病例编号; 按照组织病例编号从组织库中取出组织蜡块和对应的HE染色切片; 用组织包埋机制备合适的空白受体蜡块; 用组织阵列仪按照阵列设计抽提病理蜡块组织芯,并有规律的排列在空白受体蜡块上; 组织阵列块在52 ℃恒温烤箱中加热融合,使组织芯与受体蜡块紧密相连; 用全自动组织切片机以20 μm/转的进刀速度对组织阵列块进行修整蜡块,直至80%的组织芯完全曝露; 用全自动组织切片机以4 μm/转的进刀速度对组织阵列块进行切片,切片附在防脱片处理的进口载玻片上; 阵列切片置于60 ℃恒温烤箱中,烤片16 h; 组织芯片按编号每隔10张抽取1张做HE染色; 病理医生对抽检组织芯片中每一个组织样本进行复诊质检,结果输入组织芯片数据库; 组织芯片实验白片保存在切片盒中,置于冰箱5 ℃冷藏室保存; 对使用过的病理组织蜡块进行封蜡,并将其和对应的HE染色切片归位放回蜡块柜和切片盒。作者制作1张组织芯片,共包含了56例膀胱癌组织(黑点)和10例癌旁组织(白点)。每个点代表一个组织样本,每组组织样本含有完整的临床病理资料。见图1。
1.3.2 免疫组化: 将制作好的组织芯片放入烘箱中,温度调至63 ℃, 烘蜡1 h。烘蜡过程中配置好试剂,即10倍浓缩PBS缓冲液和抗原修复液(pH值=5.96)。片子烘烤完成后,从烘箱内取出,放入全自动染色机中,进行脱蜡。脱蜡过程有3个步骤: 首先二甲苯2缸,每缸15 min; 然后无水乙醇2缸,每缸7 min; 90%酒精1缸, 5 min; 80%酒精1缸, 5 min; 70%酒精1缸, 5 min。从染色机中取出片子,用纯水冲洗3次, 1 min/次。冲洗过程中将柠檬酸修复液放在电磁炉上开始加热。柠檬酸高压修复: 柠檬酸修复液沸腾后,将片子放入高压锅中,盖上高压锅盖,待出气后开始计时(长出气)。计时2 min, 到时间后终止加热,将高压锅盖打开,将其放在水池中冷却30 min。配制内源性过氧化物酶阻断剂。将片子放入阻断剂中15 min。取出片子,用PBS缓冲液冲洗3次, 1 min/次。冰箱中取出PRMT5一抗,放入离心机以7 200转离心30 s; 在滴加一抗之前,用免疫组化笔画出所要滴加一抗的组织范围,保持湿盒水平放置,滴加动物非免疫血清,室温孵育10 min。取出一抗,按照稀释度1∶50用DAKO抗体稀释液稀释。保持湿盒水平放置,滴加一抗,放入冰箱4度过夜。第2天,从冰箱取出湿盒,保持湿盒水平放置,室内放置30~45 min, 让湿盒恢复到室温状态。将片子用PBS缓冲液冲洗3次, 1 min/次。滴加DAKO公司的EnVisionTM+/HRP兔工作液,孵育30 min。到时间后用PBS冲洗3次, 1 min/次。从冰箱里取出DAB试剂盒,按1 mL DAB稀释液+1滴DAB色原进行配制。在片子上滴加稀释后的DAB(滴加之前最好在湿盒下面铺好白色的纸张,以便于看清显色情况),显色5 min(按照实际情况,染色不再加深可即可停止显色),到时间后自来水冲洗5 min。片子浸泡在哈氏苏木素1 min, 到时间后在0.25%的盐酸酒精中浸没3~4 s, 用自来水冲洗2 min。将片子放入65 ℃烘箱或者通风橱自然晾干,直至片子没有水分,用中性树胶封片。
1.3.3 结果判定: 将使用膀胱癌组织芯片进行实验产生的所有PRMT5抗体的原始实验数据纳入本次统计分析。原始实验数据的判读方式: 判读PRMT5的胞浆、胞核染色的染色强度(0、+、、)和染色阳性率,癌组织和癌旁组织(上皮)分别判读。原始实验数据的标准化方案: ① 染色强度评分: 0分(阴性), 1分(+), 2分(), 3分()。② 染色阳性率评分: 0分(阴性), 1分(1%~25%), 2分(>25%~50%), 3分(>50%~75%), 4分(>75%~100%)。③ 总评分: 以"染色强度评分"和"染色阳性率评分"的乘积为总评分。④ 生存期分析分组: 总评分≤4为低表达组,总评分>4为高表达组。
1.4 统计学方法
配对t检验用于比较19对膀胱癌患者癌组织及癌旁组织中PRMT5基因表达差异。将PRMT5基因表达按中位数分成高、低表达组,采用Kaplan-Meier方法分析并绘制生存曲线,以及Log-rank方法比较膀胱癌患者PRMT5高、低表达组的生存情况。应用χ2检验比较PRMT5基因表达高、低组间的性别、TNM分期以及有无复发等临床特征差异。所有的统计检验均为双侧概率检验,P<0.05为差异有统计学意义。使用的统计学软件为SAS统计软件 (v.9.2; SAS Institute, Cary, NC)。
2 结 果
2.1 TCGA数据库结果
2.1.1 PRMT5在配对的膀胱癌癌组织与癌旁组织中的表达差异: 下载了TCGA数据库中的膀胱癌患者的基因表达谱,其中匹配的癌和癌旁组织一共有19对。通过配对t检验比较这19对膀胱癌患者癌组织及癌旁组织中PRMT5基因的表达水平,结果显示PRMT5在膀胱癌组织中的表达水平显著高于在癌旁组织中的表达水平(P=0.0001)。见图2。

2.1.2 PRMT5基因表达与膀胱癌患者生存的关联性: 本研究下载了TCGA数据库中349例膀胱癌患者的基因表达谱及预后信息,并探讨PRMT5表达水平与膀胱癌预后的关系。将PRMT5的表达量从低到高进行排序,取表达量中位数为标准,分为PRMT5低表达组和PRMT5高表达组。采用Kaplan-Meier方法分析并绘制生存曲线,接着通过Log-rank方法比较膀胱癌患者在PRMT5高低表达组中的生存情况。结果显示PRMT5高表达组的膀胱癌患者较低表达组膀胱癌患者的预后更差(Log-rankP=2.6×10-4)。见图3。

2.1.3 PRMT5基因表达与膀胱癌患者的临床特征的相关性:作者整理了349例膀胱癌患者的相关临床信息,包括年龄、临床分期、病理分级、肿瘤大小以及有无淋巴结转移等,探讨PRMT5表达水平与膀胱癌的关系。将PRMT5的表达量按中位数为标准,分为低表达组和高表达组。应用χ2检验比较PRMT5基因表达高、低组的性别、TNM分期以及有无复发等临床特征差异。结果显示PRMT5高表达更倾向于分布在浸润深度T3、T4(P=0.047), TNM分期T3、T4期(P=0.017)和新发肿瘤组中(P=0.007)。见表1。
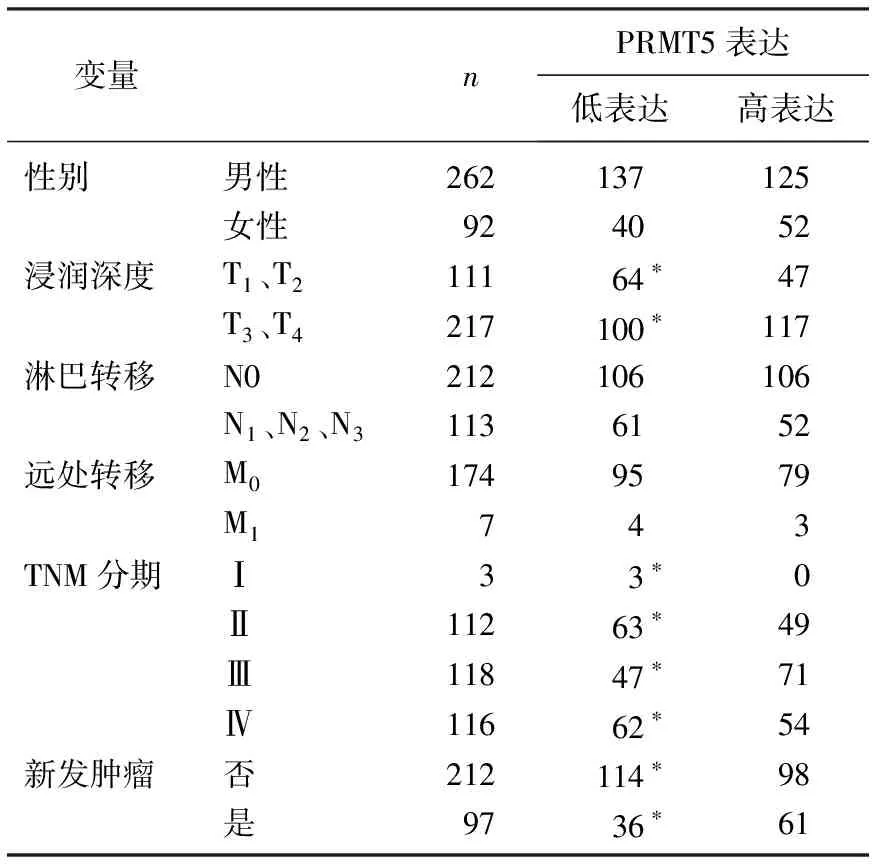
表1 膀胱癌患者PRMT5基因表达与临床特征的相关性
2.2 组织芯片结果
2.2.1 PRMT5在膀胱癌癌组织与癌旁组织中的染色结果: 采用组织芯片-免疫组化技术检测PRMT5在膀胱癌和癌旁组中的表达水平,46例膀胱癌组织和10例癌旁组织的检测结果见表2、3、4、5、6、7、8。结果包括PRMT5在每个样本胞浆和胞核中的染色强度和染色阳性率。
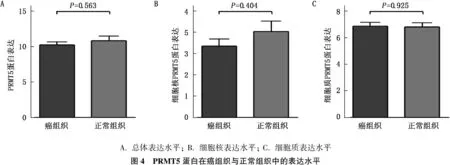
2.2.2 PRMT5在膀胱癌癌组织与癌旁组织中的表达: 按结果判定标准,将染色强度和染色阳性率转化为相应的评分,然后以“染色强度评分”和“染色阳性率评分”的乘积为总评分来定量表达PRMT5在膀胱癌和癌旁组织中的蛋白表达水平。应用成组t检验比较2组间PRMT5的表达水平,结果无显著差异(P=0.563)。接着分别观察PRMT5在2组细胞胞核和细胞质中的表达水平,结果也无显著差异(P=0.404、0.925)。见图4。
2.2.3 PRMT5蛋白表达与膀胱癌癌患者生存时间的关系: 将PRMT5蛋白表达量的总评分从低到高进行排序。总评分≤4为PRMT5低表达组,总评分>4为PRMT5高表达组。采用Kaplan-Meier方法分析并绘制生存曲线,接着通过Log-rank法比较膀胱癌患者在PRMT5高、低表达组中的生存情况。结果显示2组膀胱癌患者的生存时间无显著差异(Log-rankP=0.285)。分别在细胞核和细胞质中探讨PRMT5的表达水平与膀胱癌患者生存时间的关系,结果也无显著差异(Log-rankP=0.723、0.298)。见图5。
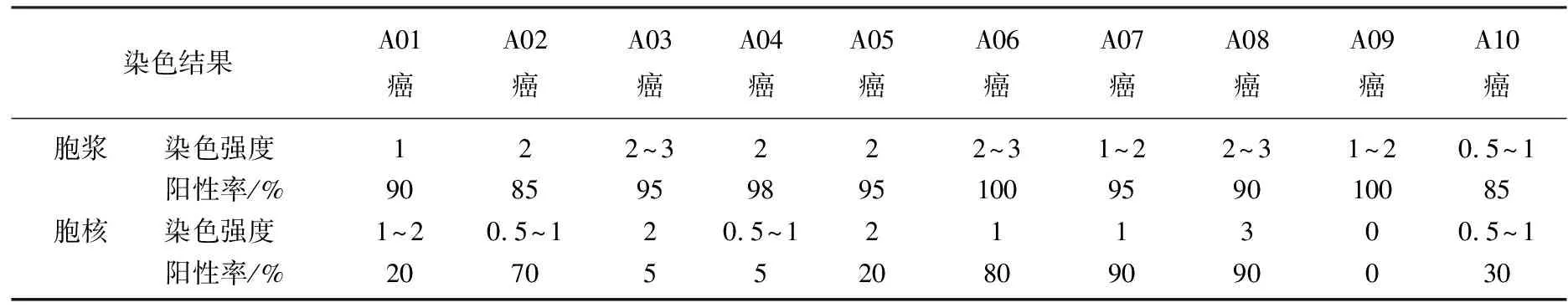
表2 A行PRMT5在膀胱癌癌组织与癌旁组织中的染色结果

表3 B行PRMT5在膀胱癌癌组织与癌旁组织中的染色结果

表4 C行PRMT5在膀胱癌癌组织与癌旁组织中的染色结果
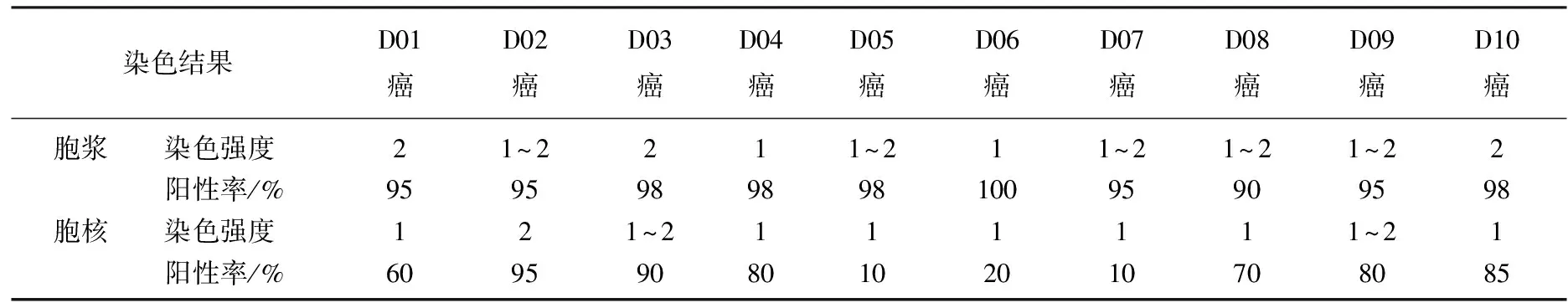
表5 D行PRMT5在膀胱癌癌组织与癌旁组织中的染色结果

表6 E行PRMT5在膀胱癌癌组织与癌旁组织中的染色结果

表7 F行PRMT5在膀胱癌癌组织与癌旁组织中的染色结果
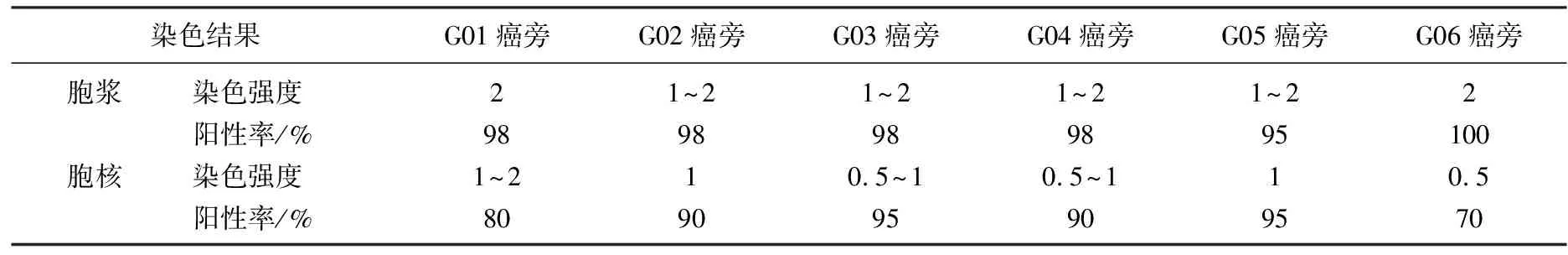
表8 G行PRMT5在膀胱癌癌组织与癌旁组织中的染色结果

2.2.4 不同临床病理参数与膀胱癌患者生存时间的关系: 结合膀胱癌组织的临床病理参数,将膀胱癌样本分为有淋巴结转移和无淋巴结转移,比较2组患者生存时间。结果显示,有淋巴结转移的膀胱癌患者预后更差(Log-rankP=0.031)。将膀胱癌样本按病理分期分为Ⅰ、Ⅱ期和Ⅲ、Ⅳ期。结果显示位于Ⅲ、Ⅳ期的膀胱癌患者预后更差(Log-rankP=0.015)。见图6。

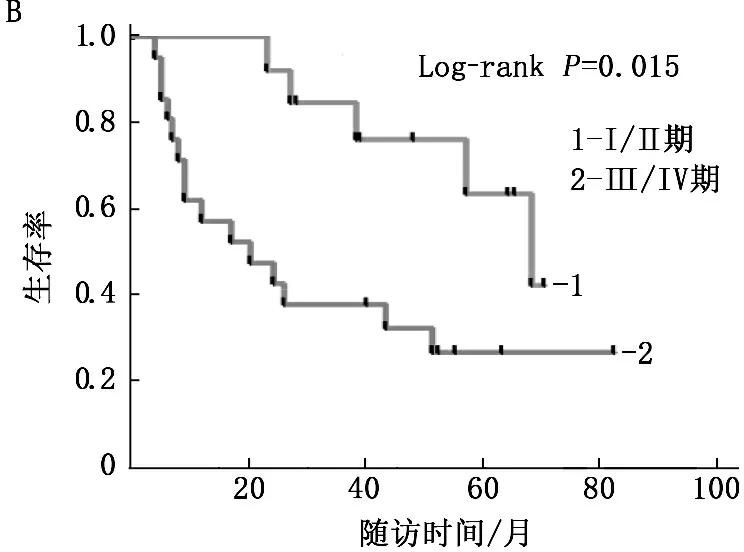
A. 有、无淋巴转移; B. 不同病理分期
3 讨 论
Jeon JY等[31]发现PRMT5在肝细胞癌和结肠癌细胞中的过表达有助于其获得侵袭性等特征,因此有希望为这些疾病提供新的治疗靶点。PRMT5作为一种表观遗传酶,能够对称性地甲基化组蛋白或者非组蛋白底物的精氨酸残基,影响靶基因的表达或者信号分子的翻译后修饰,进而调节多种细胞过程,发挥着不同生物学功能。
本研究利用TCGA数据集,证实PRMT5在膀胱癌中显著高表达,且其表达水平与肿瘤浸润深度、分化程度等显著相关,即恶性程度越高的患者, PRMT5的表达越高。本研究显示PRMT5表达和预后生存具有显著的相关性, PRMT5高表达患者预后差,提示PRMT5基因在膀胱癌中有可能作为临床预后指标。Dai Shimizu团队同样发现PRMT5可能作为肝细胞癌的致癌基因, PRMT5 mRNA水平有希望成为一种预后标志物,也可能成为肝细胞癌分子治疗的潜在靶点[32]。本研究采用组织芯片-免疫组化技术检测PRMT5在膀胱癌和癌旁组中的表达水平,结果未发现PRMT5在2组间存在表达的差异。接着通过Log-rank方法比较膀胱癌患者在PRMT5高低表达组中的生存情况,结果显示2组膀胱癌患者生存时间无显著差异。但是结合膀胱癌组织的临床病理参数,显示有淋巴结转移的膀胱癌患者预后更差,位于Ⅲ、Ⅳ期的膀胱癌患者预后更差。
本研究中还存在着一些不足: 首先,本研究通过TCGA数据库来探讨PRMT5 mRNA在膀胱癌癌组织与癌旁组织中的表达以及与膀胱癌患者生存的关联性,并没有在自己样本中进一步验证; 其次,本研究采用组织芯片-免疫组化技术检测PRMT5表达水平,探讨生存预后关系,但结果都无显著差异,这可能与样本数量有限,或者前期在挑选样本时存在选择偏倚以及一些随访中断等问题有关。
大量证据表明PRMT5可能是临床肿瘤筛查的重要标志物,被认为是药物治疗的一个十分有价值的靶标。本研究结果进一步说明了PRMT5异常表达与膀胱癌的临床参数及预后都存在着密切关系,为进一步研究PRMT5在膀胱癌发生、发展中的作用机制以及开发特异性PRMT5抑制剂提供了新线索和新思路。

