不同形态胃黏膜损伤中再生基因4和Musashi-1的表达研究
李 松 朱 捷 郭 威
(齐齐哈尔医学院附属第一医院消化内科,齐齐哈尔161041)
胃癌(Gastric cancer,GC)是常见的肿瘤疾病,预后效果差并且死亡率高。据统计数据表明,全球胃癌的发病率近年来呈下降趋势,但在癌症发病率中仍居第5位、死亡率居第3位[1]。我国每年新发胃癌病例占全球新发数的42%,居消化道癌症首位,死亡率居第2~3位[2]。随着现代医疗技术进步,各种分子靶向药物的开展使用,胃癌的预后有所提高[3]。经治疗后早期胃癌有90%患者生存期超过5年[4],而进展期患者仅约25%生存期超过5年[5]。胃癌的发病机制目前仍未研究清楚,多数学者比较认可Correa提出的模式:慢性胃炎-慢性萎缩性胃炎(Atrophic gastritis,AG)-胃黏膜肠上皮化生-不典型增生-胃癌[6]。这说明胃癌的发生可能是多步骤、多基因改变积累的结果,研究抑癌基因的异常表达对分析胃癌的发病过程具有重要作用。本研究观察胃黏膜形态学,检测在肠上皮化生情况下Musashi-1(Msi-1)和再生基因(Reg4)的表达。目前关于研究Msi-1、Reg4与肠上皮化生的关系研究甚少,所以本实验具有一定创新性。
1 材料与方法
1.1材料
1.1.1研究对象 收集2016年8月至2017年10月在齐齐哈尔医学院附属第一医院消化内科内镜中心胃镜检查出的胃窦活检标本218例。年龄为22~73岁,平均(44.3±0.6)岁。经病理证实,共取得肠化隆起灶(Superficial elevated mucosa lesins group of atrophic gastritis with intestinal metaplasia,EIM)48例,肠化凹陷灶(Superficial depressed mucosa lesins group of atrophic gastritis with intestinal metaplasia,DIM)48例,非萎缩性胃炎(Non atrophic gastritis,NAG) 45例,AG 39例,胃窦癌38例。其中对同一患者取EIM和DIM标本20例。胃癌患者均未进行放化疗,其他胃炎患者均未使用黏膜保护剂、抑酸剂等药物治疗,进行胃镜检查前患者签署知情同意书,且获得我院伦理委员会审批。
我们在典型的肠上皮化生病灶中分别进行EIM和DIM黏膜标本取样。EIM和DIM形状均不规则,成点状、片状;分布上来看,在DIM周围常分布有EIM;采用肉眼及窄带成像技术观察发现EIM、DIM分别高于和低于周围黏膜,且EIM、DIM的黏膜上皮均完整无脱落[2],如图1。
1.1.2设备和试剂 浓缩型兔抗人 Reg4 多克隆抗体、浓缩型鼠抗人Musashi-1抗体购于英国Abcam 公司;通用型免疫组化试剂盒PV-9000、DAB显色试剂盒PV-8000、反转录和 PCR 试剂盒均购于北京中杉金桥公司;快速尿素酶检测卡购自深圳市赛尔生物技术有限公司;光学显微镜(日本Olympus公司),胃镜主机(日本Olympus CV-260SL),PCR仪(美国Bio-Rad公司),PCR引物均由北京博大泰克生物基因技术有限责任公司合成。
1.2方法
1.2.1免疫组化检测Reg4、Msi-1蛋白表达 按照试剂盒说明进行免疫组化SP 法。以 PBS 代替一抗作阴性对照,以Reg4、Msi-1抗体的阳性片作为阳性对照。由2位病理医师对所有切片进行读片。对于Reg4、Msi-1染色,我们将细胞核内出现的黄至棕褐色的染色信号判定为阳性染色。每张切片随机取5个高倍镜视野,计算阳性细胞所占比例(阳性表达率),≥10%为阳性反应,<10%为阴性反应。以0~3分对阳性表达率进行评分,当阳性表达率≤10%计0分,10%<阳性表达率≤50%计1分,50%<阳性表达率≤75%计2分,阳性表达率>75%计3分;染色强度为0~3分,未着色计0分,淡黄色计1分,棕黄色计2分,棕褐色计3分;最终的评分为两个指标的乘积。其中3分以上为高表达。
1.2.2PCR检测Reg4、Msi-1 mRNA水平 按照Trizol试剂盒操作说明对所有样本进行总RNA提取,并测定浓度,利用逆转录试剂盒进行反转录 cDNA合成,反应条件如下:94℃预变性5 min,94℃变性 30 s,60℃退火60 s,循环 35 次,最后 72℃延伸5 min,Reg4 mRNA复性温度57℃ 30 s,Msi-1 mRNA复性温度 55℃ 30 s。内参为β-actin,上游引物序列为5′-CAGAACATGGCTGGAGAGAA-3′,下游引物序列为 5′-ATGGAAAGAAGTGGGCAGGC-3′;Reg4上游引物序列为 5′-CTACACGAGCTGAGCTGGAG-3′,下游引物序列为 5′-GGGATTGTAAAGACCGCTAG-3′; Msi-1的上游引物序列为 5-AAAGTGCACCATAACCGAG-3′,下游引物序列为5′-CCCTGCCAATTTACCGTTC-3′。电泳结果测定采用软件进行半定量分析,将目的基因和内参的灰度值之比进行统计分析。
1.2.3肠化组织的病理学检查 以2000年全国慢性胃炎研讨会上制定的标准为依据对肠化组织病理分类,按照病变程度可以分为轻度、中度、重度,评判标准如下:重度是在每一显微内镜视野内,表面上皮和腺体总面积的肠化部分占2/3以上,中度为占1/3~2/3,轻度为占1/3 以下[7]。由2位胃肠病理医师对所有肠化生玻片进行阅读、分度。
1.2.4幽门螺旋杆菌(Helicobacter pylori,Hp)感染检测 采用快速尿素酶法进行Hp检测,用活检钳夹取一块胃窦组织,撕开胶纸暴露出琼脂胶,按照说明进行操作。2 min后,Hp阳性为试剂变成红色。如果未变色,30 min后再观察,颜色若变红也认为是Hp阳性,仍未变色则为阴性。

2 结果
2.1Reg4 和Msi-1在不同病变胃黏膜中蛋白表达情况 免疫组化结果显示, Msi-1在NAG、AG、DIM中的阳性率低于胃癌(P<0.05);Reg4在EIM、DIM中的阳性率高于胃癌(P<0.05)。Reg4在EIM和DIM中表达同阳和同阴分别有17例和2例;而Msi-1在EIM和DIM中表达同阳和同阴分别有10例和13例。Reg4和Msi-1因子在EIM中的阳性表达率均高于DIM(P<0.05),详见表1、2、3及图1、2。

图1 普通内镜下肠上皮化生(A)和窄带成像技术(B)观察肠化隆起灶和肠化凹陷灶图像(×80)Fig.1 Observation of image of EIM and DIM by intestinal metaplasia under common endoscopy(A) and Narrow band imaging (B) (×80)Note: 1.EIM;2.DIM.
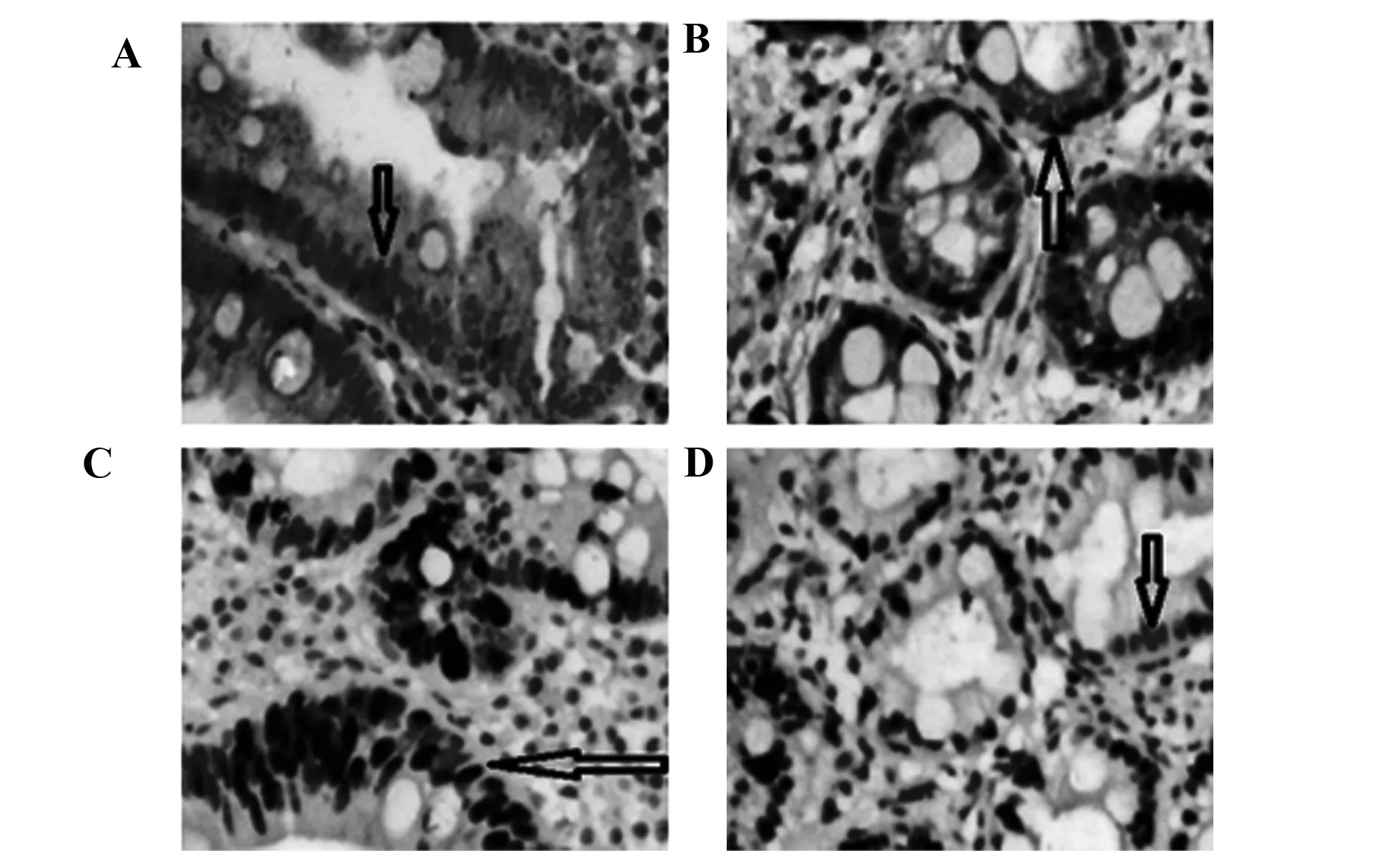
图2 免疫组化法检测Reg4和Msi-1蛋白在肠化隆起灶(A、C)和肠化凹陷灶(B、D)中的表达情况(×400)Fig.2 Immunohistochemical to detect expression of Reg4 and Msi-1 protein in EIM (A,C) and DIM (B,D)(×400)
表1 Reg4和Msi-1蛋白在不同类型胃黏膜组织中的表达情况[n(%)]
Tab.1 Expression of Reg4 and Msi-1 protein in different types of gastric mucosa[n(%)]

GroupsMsi-1 positiveReg4 positiveNAG6(13.3)5(11.1)AG8(20.5)10(25.6)GC27(71.1)13(34.2)
表2 Reg4在EIM和DIM中的表达情况[n(%)]
Tab.2 Expression of Reg4 in EIM and DIM[n(%)]
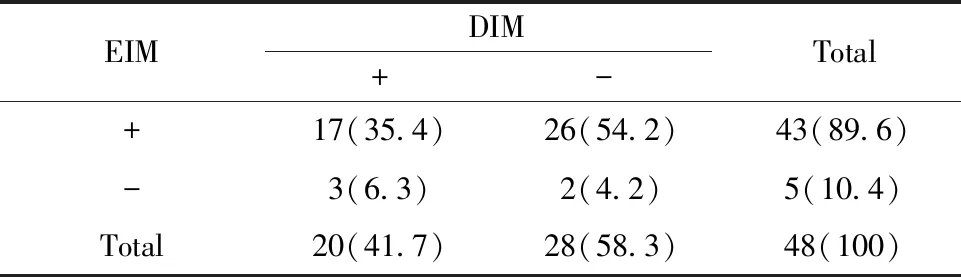
EIMDIM+-Total+17(35.4)26(54.2)43(89.6)-3(6.3)2(4.2)5(10.4)Total20(41.7)28(58.3)48(100)
表3 Msi-1在EIM和DIM中的表达情况[n(%)]
Tab.3 Expression of Msi-1 in EIM and DIM[n(%)]
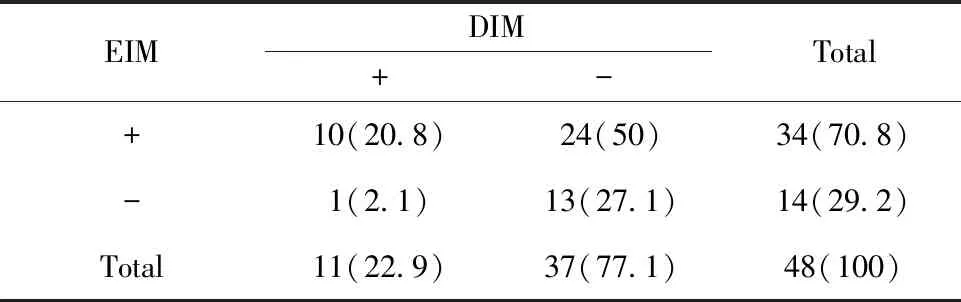
EIMDIM+-Total+10(20.8)24(50)34(70.8)-1(2.1)13(27.1)14(29.2)Total11(22.9)37(77.1)48(100)
2.2Reg4和Msi-1在不同类型病变胃黏膜中mRNA的表达情况 PCR 检测结果显示,在NAG、AG、EIM、DIM和GC组中,Reg4 mRNA相对表达分别为0.35±0.03、0.46±0.03、0.94±0.02、0.72±0.03、0.49±0.05,Msi-1相对表达分别为0.51±0.02、0.64±0.03、1.07±0.04、0.80±0.03和1.12±0.04。Reg4 和Msi-1在EIM中的 mRNA 表达水平比DIM高(分别为t=1.53,P<0.05以及t=1.88,P<0.05,图3),与免疫组化结果一致。

图3 Reg4和Msi-1的mRNA在不同类型胃黏膜中的表达Fig.3 Expression of mRNA in Reg4 and Msi-1 in different types of gastric mucosaNote: A.Reg4 mRNA expression;B.Msi-1 mRNA expression (1.NAG;2.AG;3.EIM;4.DIM;5.gastric cancer).*.P<0.05 vs DIM group.
表4 两种病灶中肠化生程度[n(%)]
Tab.4 Degree of intestinal metaplasia in EIM and DIM[n(%)]

Intestinal metaplasiaEIMDZMLight15(31.2)20(41.7)Medium19(39.6)18(37.5)Heavy14(29.2)10(20.8)Total48(100)48(100)
2.3EIM和DIM中肠化生程度 肠上皮化生在EIM和DIM中的分布情况结果显示,两者差异无统计学意义(χ2=4.512,P=0.118)。
2.4Hp在不同病变胃黏膜中的感染率 Hp在NAG、AG、EIM、DIM和GC组中的阳性率分别为 33.3%(15例)、41.0%(16例)、52.1%(25例)、50.0%(24 例)和 36.8%(14例),Hp在EIM和DIM中的阳性率差异无统计学意义(P>0.05)。
3 讨论
目前多数学者已逐步接受胃炎转化为胃癌的观点,并在动物实验中得到了验证[8],研究报道尾型同源框转录因子2(Caudal type homeobox 2,CDX2)转基因小鼠胃黏膜发生肠上皮化生,这提示小鼠肠化生上皮细胞生可能会转变为胃癌细胞[9],但其发病机制仍未研究清楚。有研究认为人类的胃癌疾病可能是胃上皮分化能力缺失,致使干细胞增殖分化形成肠上皮化生,在多种致癌因素下发展为胃癌[10],不过胃癌和肠上皮化生的关系还未能明确,有待进一步研究。在胃镜下观察肠上皮化生可以发现病变灶部位有浅表隆起、凹陷、不平等特性,从分子生物学上研究这些病变部位是否有所差异的报道较少。Msi-1作为胃肠道干细胞的表面标记物,同时在胃炎、肠化生、胃癌组织中也被检测出,且随着胃黏膜病变程度的加重而表达增加,这说明胃肠道干细胞突变可能是胃炎、肠化生和胃癌中的干细胞来源[11]。而文献报道Reg4能够促进细胞增殖以及抑制其凋亡,从本实验结果也能看出Reg4与肠上皮化生密切相关,属于肠化因子之一[12]。那么突变的胃肠干细胞在胃肠化生组织中增殖情况如何,Reg4与Msi-1在不同形态EIM、DIM中是否有联系,尚未见文献报道。
越来越多的研究者逐渐关注Reg4与癌症之间的关系,其作用、机制已经成为研究热点[13]。Oue等[14]对4种原发性胃癌采用基因序列分析法进行研究,在癌症的浸润、形成及转移过程中筛选出一批相关基因。Reg4在这些相关基因中是胃癌的特异性基因。文献报道,经RT-PCR分析超过一半的胃癌患者过表达Reg4 mRNA[10]。Reg4在其他正常组织中表达水平也远低于癌组织[15]。cDNA微阵列分析显示,腹腔肿瘤的来源无论是原发灶还是转移灶,都可以将Reg4视为胃癌腹膜转移的标志物分子[16,17]。CDX2可能调控管内乳头状黏液性肿瘤的“肠”通路分化与Reg4的表达[18]。在胃癌中,Reg4能通过性别决定区Y框蛋白9(Sex determining region Y box protein 9,SOX9)和CDX2参与肠分化产生作用,同时对抗凋亡信号分子、激活表皮生长因子受体(Epidermal growth factor receptor,EGFR),参与肿瘤生长[19]。本实验免疫组化结果显示,Reg4在EIM中的阳性率要高于DIM,差异有统计学意义(P<0.05),但胃癌中Reg4 的蛋白阳性表达率要低于EIM和DIM,其Reg4的mRNA 表达与免疫组化情况基本一致。从上述情况可以看出 Reg4 是较敏感因子,作用类似生长因子,但还需SOX9、CDX2等其他因子配合才能起到作用,说明其特异性不高,对于筛查早期胃癌还需考察其他因子。实验中我们从Reg4蛋白表达情况可以推测,EIM的增殖活性比DIM高。
Msi-1最早发现于果蝇中,与感觉器官细胞分化有关,属于神经特异性表达的 RNA 结合蛋白。Msi-1能选择性在小鼠神经干细胞中表达,同时在细胞的不对称分裂过程中发挥重要作用,近年来许多研究发现在人和鼠胃肠道干细胞中均有Msi-1表达,提示可以将Msi-1作为胃肠道干细胞的表面标记物[20,21]。转录后,Msi-1对细胞的非对称分裂进行调控、维护干细胞分化及在干细胞状态维持中起着重要作用[22]。目前已将Msi-1视为胃肠道干细胞分子标记之一。近年来,Msi-1在许多肿瘤领域均有报道,但在肠上皮化生方面的报道较少,同时Msi-1在胃炎、肠化生和胃癌中阳性率逐渐增高,这对肿瘤的转移及预后都产生影响。本研究结果显示,Msi-1在NAG、AG、DIM、EIM和GC组中的阳性率分别为13.3%、20.5%、22.9%、70.8% 和 71.1%,与既往研究基本相符[23];本实验免疫组化和RT-PCR结果显示,Msi-1在EIM中的阳性表达率和mRNA表达水平要高于DIM,差异均有统计学意义(P<0.05),可以推测EIM的增殖活性比DIM,和Reg4推测结果一致。增殖活性的差异可能会使EIM演变成异型增生或胃癌的可能性比DIM更大。
本研究结果还显示,EIM和DIM的肠上皮化生程度比较,肠上皮化生程度差异无统计学意义(P>0.05)。另外,本实验中Hp在不同病变胃黏膜中的感染率结果显示,肠化生的Hp阳性率较高,EIM和DIM阳性率分别为52.1%和50.0%,其中分别包括12例和8例重度肠化生。有研究表明,发生Hp感染与肠上皮化生细胞凋亡失调有关,这种情况下可能提高胃癌发生机率[24]。因此推测Hp对肠化生凋亡减少有促进作用,所以根除Hp能减轻肠化生程度,防止其发生。
综上所述,Reg4和Msi-1因子在EIM和DIM中的蛋白和mRNA表达水平差异有统计学意义。Reg4和Msi-1蛋白和mRNA表达越高,说明突变干细胞增殖活性越高,进一步发展为癌症的可能性也就越大,在以后的胃镜检查中,要对高危人群的EIM足够重视,这可能是癌变前的高危信号。

