基于网络药理学的荆芥挥发油主要成分抗炎机制研究
袁 岸,刘 淇,饶志粒,曹海娟,刘小波,吕红君,曾 南
(成都中医药大学药学院 中药材标准化教育部重点实验室省部共建西南特色中药资源国家重点实验室培育基地,四川 成都 611137)
荆芥为唇形科植物荆芥(SchizonepetatenuifoliaBriq.)的干燥地上部分,性微温、味辛,归肺、肝经。其具有解表散风,透疹消疮之功效,用于感冒、头痛、麻疹、风疹等病症的治疗,历史悠久,功效显著。临床上荆芥常配伍其它解表药共奏发汗解表功效,为发散药中药性最平和之品。“辛”是解表药的共同药性特点,挥发油是辛味药药性的主要物质基础,荆芥挥发油(essential oil fromSchizonepetatenuifoliaBriq.,EOST)是荆芥的主要有效物质基础之一,近年来,本课题组围绕“荆芥挥发油是荆芥发挥解表功效的重要物质基础”的思路开展相关研究。抗炎是解表药的主要药理作用之一,课题组对EOST抗炎作用的研究较为深入,发现其通过影响花生四烯酸(arachidonic acid,AA)代谢、Toll 样受体信号(TLR)通路、氧化反应以及NLRP3炎症小体调控以发挥作用[1],然而这样多成分组合的作用机制研究仍较为复杂,挥发油发挥药理作用的机制研究较少,需进一步深入研究并完善。
单成分的研究难以全面解释中药多组分-多靶点-多途径的作用机制,是目前中药现代化研究所面临的重要困难。近年来,整体研究中药作用机制方法的提出与结合,如网络药理学、系统药理学及组学,推进了中药及复方的深入研究。网络药理学于2008 年由 Hopkins[2]提出,是基于系统生物学和多向药理学的研究方法,通过构建药物与基因、靶标和疾病等之间的相互作用网络,来探讨药物的作用机制。因中药对机体的作用是一个复杂的生物学网络,该方法与中医药“整体性”特点一致[3]。目前,网络药理学已被应用于中药复方的配伍规律、复方优化、新药开发、中药活性成分筛选和药物-症候研究等方面。其为复杂的中药研究提供了重要的方法,将网络生物学和药物信息学的研究手段用于中药物质基础和作用机制研究,分析中药成分-靶点-疾病关系,进一步阐释中药的科学内涵。本研究采用网络药理学方法,建立EOST主要成分-靶点网络图预测其发挥抗炎作用的活性成分和作用靶点,通过基因本体(gene ontology,GO)和KEGG(Kyoto Encyclopedia of Genes and Genomes)通路分析其作用特点,蛋白质相互作用分析关键靶点,分子对接验证成分与炎症靶点结合情况以得到抗炎有效成分,并结合已有文献报道来验证预测结果,为进一步机制研究提供科学依据。
1 材料与方法
1.1 构建小分子化合物结构数据库EOST中化学成分主要为单萜类、倍半萜类,还含有醛、酮、醌、酚、醇、酯、羧酸、烯烃及烷烃类等化合物,分析近年文献,整理得到108个化学成分。依据课题组前期GC-MS检测的EOST主要化学成分组,提取含量0.1%以上的17个成分[1],见表1。以这17个成分为研究对象,组成发挥药理作用的主要部分。通过中药系统药理数据库和分析平台(TCMSP,http://lsp.nwu.edu.cn/tcmsp.php )、PubChem数据库检索17个分子结构,构建其小分子结构数据库,以.sdf 格式保存。根据Lipinski类药五原则,小分子药物应满足:①氢键供体数目≤5;②相对分子质量≤500;③脂水分配系数logP≤5;④氢键受体数目≤10;⑤可旋转键数目不超过10。通过SwissADME在线平台(http://www.swissadme.ch/ )分析类药性,这17个成分均符合类药五原则。

Tab 1 Main constituents in EOST[1]
1.2 确定药物靶点从TCMSP中检索化合物靶点,在此基础上,结合Swiss Target Prediction在线平台对未检索到的化学成分进行靶点预测,该平台通过输入成分与数据库中已知成分相似度预测其靶点,选取预测结果中参数Probability≥0.7的靶点,做进一步分析。然后从UniProtKB(http://www.uniprot.org)中提取基因名称。
1.3 目标基因GO富集分析GO分析是为了研究所涉及靶点基因参与的细胞组分(cellular component ,CC,描述基因产物在细胞中的位置,如内质网、核或蛋白酶等),生物过程(biological process,BP,具有多步骤的有序生物过程,如细胞生长分化、维持、凋亡及信号传导等)和分子功能(molecular function,MF,单基因产物的功能,如结合活性或催化活性等)。目前,大多数网络药理学研究以研究的某几个靶点为中心进行GO分析,但中药多成分-多靶点-多途径的特点造成其发挥作用的复杂性,一些看似不相关的靶点或途径同样可能影响到所研究的靶点。尤其是炎症,与很多疾病有重要联系,在GO分析中有必要将全部靶点基因也纳入研究范围。因此采用主要成分对应所有靶点基因进行整体分析,使用DAVID 6.8(https://david-d.ncifcrf.gov/)在线功能注释工具进行GO富集分析。以错误发现率FDR≤0.05为标准筛选。从DAVID获得该部分靶点所涉及的GAD数据库疾病。
1.4 网络构建与分析为了解EOST主要化学成分的分子机制,使用Cytoscape 3.7.1构建化合物-靶点网络。通过Cytoscape软件中的ClueGo对靶点进行KEGG 通路分析,选择富集得到的KEGG通路的P<0.05,可视化得到KEGG通路网络图。为研究靶标蛋白之间的联系,运用STRING对上述靶点研究得到蛋白相互作用(protein-protein interaction,PPI)数据结果,将该部分数据输入Cytoscape可视化获得PPI图,该图能直观分析关键蛋白。
1.5 分子对接验证关键靶标蛋白考虑到已有成分数据库的局限性,需要通过网络中所获得的炎症靶点进行分子对接,进一步确定各成分对靶点的作用。根据成分-靶点网络和蛋白PPI数据分析,以Homo sapiens为基源从Uniprot和RCSB PDB(该靶点在Uniprot结构中列出,并在PDB数据库中匹配值最高者纳入)筛选网络中与炎症相关的各靶点蛋白,提取对应的PDB ID。SystemsDock在线对接网站基于docK-IN评分预测配体和受体结合力,每次可对接5个小分子,所选择的靶标蛋白尽量选择确定活性位点的蛋白,其中有Native legend可以作为统一参考,保证同样的蛋白对接不同批次的小分子能得到相对可比较的得分。将“1.1”建库所得活性成分分别输入SystemsDock在线对接工具进行分子对接,与炎症相关靶点肿瘤坏死因子-α(TNF,PDB ID:3IT8)、白介素-6(IL-6,PDB ID:4NI7)、白介素-1β(IL-1β,PDB ID:2NVH)、白介素-10(IL-10,PDB ID:2ILK)、前列腺素内过氧化物合酶2(PTGS2,PDB ID:5F19)、前列腺素内过氧化物合酶1(PTGS1,PDB ID:5WBE)、毒蕈碱型胆碱受体M1(CHRM1,PDB ID:5CXV)、烟碱型胆碱受体α7(CHRNA7,PDB ID:5AFM)初步验证可能的作用靶点。根据得分和连接位点分析化学成分与各靶点相互作用情况。
1.6 整理相关文献资料在前述网络构建-KEGG、GO、PPI分析-分子对接验证基础上,查询国内外文献关于EOST及得分较高的主要成分抗炎作用研究,对本研究补充已有文献资料。
2 结果
2.1 EOST化学成分-作用靶点网络构建分析网络的拓扑结构性质,本研究中17个主要成分,其中除2-环己烯-1-酮、8,9-去氢百里香酚、辣薄荷酮和1-辛烯-3-醇乙酸酯这4个成分没有对应潜在靶点。整个网络中有13个成分,45个靶蛋白,共58个节点,节点之间形成116条边。如Fig 1,PTGS2、PTGS1、CHRM1、CHRM2、CHRM3、GABRA1、GABRA2、GABRA6、SLC6A2、ADRA1B、ADRA2A、NCOA2等为主要的靶点。靶点中有20个靶点(44.44%)对应两个以上小分子。该网络体现了EOST多成分-多靶点-多途径调节疾病的特点。
2.2 蛋白间相互作用关系通过STRING平台进行蛋白间相互作用(PPI)分析, PPI网络能更好分析EOST主要成分的作用机制。输入Cytoscape软件可视化得到Fig 2,颜色越深表示节点蛋白的节点程度越大,重要性越大。在PPI网络中获得总共111个相互关系以及36个相关目标。如Fig 2所示,IL-6、TNF、IL-1β、SLC6A4、PTGS2、ADRB2、ADRA1B、CHRM2、CHRM1等均显示突出作用。其中IL-6、TNF、IL-1β、IL-10、PTGS2均是炎症通路的重要靶点,CHRM1、CHRNA7、BCHE均是胆碱能抗炎通路的重要靶点,因此也可能是EOST发挥抗炎作用的靶点之一。

Fig 1 Components-target network of EOST

Fig 2 Target protein-protein interactions (PPI)
2.3 EOST 的KEGG通路分析按P<0.05富集到29条通路,可视化得到Fig 3。形状越大表明所占比例越大,其重要性也越大。Fig 3表明EOST与炎症的关系主要与NF-κB通路(涉及靶点为TNF、IL-1β、PTGS2、BCL2)、IL-17信号通路(涉及靶点为IL-1β、 IL-6、PTGS2、TNF)有关,同时也与炎症性肠病(inflammatory bowel disease),小细胞肺癌(small cell lung cancer),利什曼病(leishmaniasis),百日咳(pertussis),军团菌病(legionellosis)等炎症或呼吸道相关疾病有重要联系,提示其对这类疾病可能有一定治疗作用。近年来,随着神经-体液调节关系的研究发现,胆碱能抗炎通路同样调节机体炎症反应,而且更迅速。挥发油类成分易透过血脑屏障,可作用于脑部受体发挥作用。由Fig 3可知EOST对神经调节通路有一定作用:神经活性配体-受体相互作用(neuroactive ligand-receptor interaction),胆碱能(cholinergic synapse),尼古丁(nicotine addiction),吗啡(morphine addiction),γ-氨基丁酸(GABAergic synapse)。
2.4 GO富集分析EOST主要成分涉及的基因功能为14个(FDR≤0.05),见表2。以CC结果最多,表明其作用部位可能在突触、GABA-A受体复合物、质膜、细胞连接、氯离子通道复合体等,BP涉及药物反应、γ-氨基丁酸通路、糖皮质激素反应、胆碱能突触传递等,MF涉及胞外配体门控离子通道活性、GABA-A受体活性、药物结合等。根据DAVID分析得GAD疾病信息,提取前20相关疾病信息见表3,表明这些靶点可能与酒精滥用、2型糖尿病、精神疾病、感染、炎症、贪食症、高胆固醇血症、帕金森病、阿尔兹海默病等有关,提示EOST可能对上述部分疾病有一定治疗作用,可为EOST的临床应用拓展提供参考。

Fig 3 KEGG pathway analysis of EOST

Tab 2 List of GO enrichment results

Tab 3 Related diseases analyzed by DAVID database
2.5 成分-抗炎靶标分子对接EOST主要成分与8个重要炎症靶点分子对接结果见表4,得分越高表示其分子与受体结合更好。从各成分总分来看,8,9-去氢百里香酚、苯甲醛、石竹烯、葎草烯、D-吉玛烯、胡薄荷酮的得分较高,在炎症作用中可能发挥重要作用,为抗炎的主要成分。从各靶点总分来看,CHRNA7、PTGS2和PTGS1是这些成分共同发挥功效的重要靶点,对IL-6、TNF、IL-1β、IL-10、CHRM1结合分数均较高。另外,薄荷酮、1-辛烯-3-醇、1-辛烯-3-醇乙酸酯在对接中分数均较低,表明其与炎症相关靶点结合较低,可能抗炎作用较弱。
3 讨论
前期实验研究发现,EOST的抗炎作用机制具有多靶点-多途径特点,作用于AA代谢、TLR信号转导及氧化反应,此结果与Fig 3所得结果有一定对应,即与NF-κB通路相关,与PTGS2、PTGS1、IL-1β、IL-6、TNF靶点关系密切。EOST抑制AA代谢产物,减少致炎细胞因子的释放及抗氧化作用:降低气囊滑膜炎大鼠气囊灌洗液及胸膜炎大鼠胸腔渗出液中PLA2和TNF的活性,降低 MDA、PGE水平,抑制致炎细胞因子 IL-1、TNF-α的生成[4];降低胸膜炎大鼠胸腔白细胞中5-HETE、LTB4的水平,降低5-LO 活性[5];降低哮喘小鼠肺组织中 PGE2、LTB4 水平及 MDA、NO 含量。本研究发现,EOST各成分作用于环氧酶途径中的PTGS2(又称COX2)和PTGS1(又称COX1),证实其作用于上述两个靶点抑制AA途径以达到抗炎效果的研究结果。另一方面,EOST抑制TLR信号转导:下调急性肺损伤大鼠的TLR2、TLR4 mRNA表达,降低肺组织MyD88、TRAF-6、IRAK-1、IKK-α、IκB-α表达水平,降低NF-κB p65磷酸化水平[6];降低肺炎小鼠肺组织TRAF-6、IRAK-1、IKK-α、IκB-α表达水平,并抑制IL-1β、TNF-α的生成[7]。在KEGG通路分析中表明,EOST调节NF-κB通路,影响炎症因子IL-6、TNF、IL-1β的调节,证实其抑制TLR信号转导通路发挥抗炎作用的研究结果。IL-17通路可通过激活NF-κB和MAPK诱导下游基因[8],TRAF-6、IL-1β、IL-6、PTGS2、TNF为IL-17通路的重要媒介,上述研究中EOST可降低其表达,提示EOST对IL-17通路的影响,亦为实验研究提供参考。
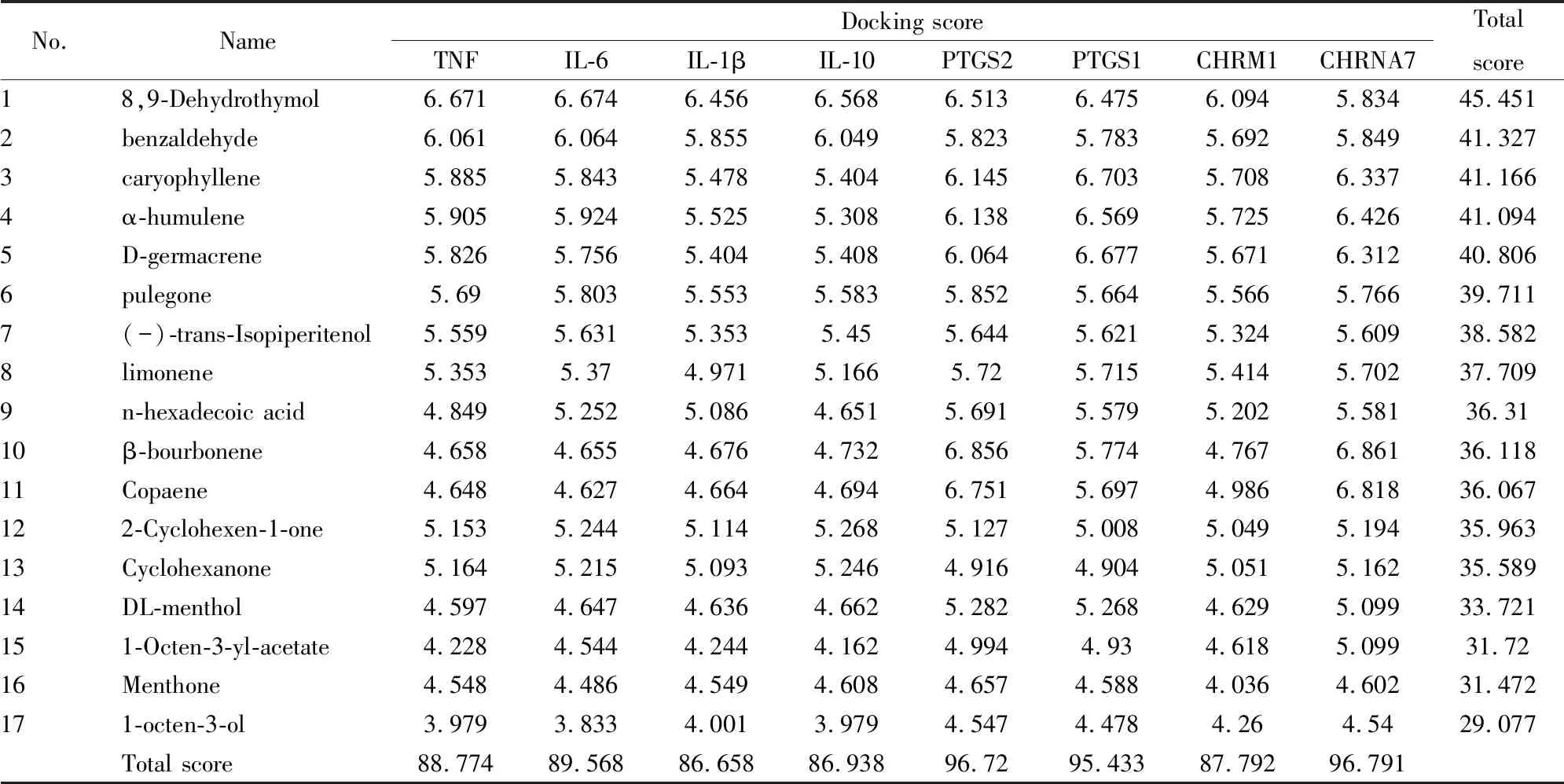
Tab 4 Docking results of main constituents with target protein
此外,EOST抗炎机制与NLRP3相关:EOST和胡薄荷酮能明显抑制THP-1细胞上清中IL-1β的高分泌,下调ATP或Nigericin诱导的THP-1细胞NLRP3、caspase-1、IL-1α、IL-1β、IL-6 mRNA表达[1]。体内实验同样表明,EOST明显降低LPS中毒小鼠血清 IL-1β、IL-5、TNF-α、MCP-1、MIP-1β、M-CSF、IFN-γ、IL-18、GM-CSF 水平,胡薄荷酮能明显降低血清 IL-18、IL-1β、IL-5、MIP-1β、M-CSF 水平。两者明显减少模型小鼠肺组织嗜中性粒细胞数目、肺急性炎性细胞浸润、肺组织中NO水平,下调肺组织NLRP3、iNOS、p65、IL-1β、STAT1 mRNA表达。EOST亦能抑制IFN-β、IFN-α mRNA表达,下调肺组织Cathepsin B、p20蛋白表达,提高COP1蛋白表达水平,抑制 P2X7R、NLRP3 蛋白表达,胡薄荷酮能抑制 pro-IL-1β蛋白表达,因此,EOST和胡薄荷酮的抗炎作用与抑制NLRP3炎症小体的激活有关[9-10]。胡薄荷酮作为EOST含量高且有明显抗炎作用的成分,是EOST物质基础研究的重点,其在靶点预测和分子对接中表现出对TNF、IL-6、IL-1β、IL-10、PTGS2、PTGS1、CHRM1、CHRNA7等炎症靶点有一定作用,与已有的实验研究中对TNF、IL-6、IL-1β的作用吻合;胡薄荷酮降低急性肺损伤大鼠肺组织中NF-κB和MyD88表达[11],证实其抑制NF-κB通路的作用。此外,其对AA通路的PTGS2、PTGS1及胆碱能抗炎通路CHRM1、CHRNA7等的作用尚未见报道,为其机制研究提供了方向。
在分子对接中,本研究发现,8,9-去氢百里香酚、苯甲醛、石竹烯、葎草烯、D-吉玛烯、胡薄荷酮获得很好的对接得分,结合文献报道[12],胡薄荷酮的抗炎作用已得到证实;石竹烯改善关节炎大鼠的全身炎症和氧化状态,通过AA和组胺途径抑制细胞因子释放[13];葎草烯通过减少炎症介质、黏附分子表达和转录因子激活来介导抗炎作用[14]。但8,9-去氢百里香酚、苯甲醛、D-吉玛烯虽在分子对接中获得很好的得分,但并无报道其抗炎效果,因此,这些重要成分的抗炎作用有待下一步实验研究以证实。而含量最高的薄荷酮,无论是数据库预测,还是分子对接中均未表现明显的抗炎作用,少量文献报道其具有抗炎作用,即抑制LPS诱导的促炎细胞因子IL-1β和TNF-α释放,以及NF-κB的核移位、IκB和βTrCP[15],因此,对于高含量成分的抗炎作用仍需进一步研究验证。
值得注意的是,对于上述主要成分对应的重要靶点CHRNA7,即α7烟碱型乙酰胆碱受体,是胆碱能抗炎通路的重要环节,与炎症、精神类疾病、阿尔兹海默病等有重要联系。由此,推测EOST可能作用于胆碱能抗炎通路发挥抗炎作用,这与挥发油易透过血脑屏障的特点密切相关,可为EOST抗炎机制研究和临床应用提供方向。
综上,本研究通过网络药理学研究EOST 17个主要成分的作用机制,建立了成分-靶点网络,PTGS2、PTGS1、CHRM1、CHRM2、CHRM3、GABRA1、GABRA2、GABRA6、SLC6A2、ADRA1B、ADRA2A、NCOA2等为主要靶点,受EOST的调节。PPI分析发现IL-6、TNF、IL-1β、SLC6A4、PTGS2、ADRB2、ADRA1B、CHRM2、CHRM1等均显示出突出作用,其中IL-6、TNF、IL-1β、IL-10、PTGS2、PTGS1、CHRNA7、CHRM1可能是EOST发挥抗炎作用的重要靶点。对应得到的酒精滥用、2型糖尿病、精神疾病、炎症性肠病、小细胞肺癌、利什曼病、百日咳等疾病,一定程度上扩大荆芥临床常应用于感冒、头痛、麻疹、风疹、疮疡初起等病症范围,为EOST的临床应用拓展提供参考。

