敲减microRNA-27a通过Wnt/β-catenin信号通路抑制肾细胞癌增殖和转移
刘扬帆,蔡 政,魏光敏,王文廉,孙 星,盛 晶,刘 越,屈中玉
(1.郑州大学附属南阳市中心医院肿瘤一科,河南 南阳 473009;2.云南省中医医院肿瘤科,云南 昆明 650021)
肾细胞癌(renal cell carcinoma,RCC)占所有人类恶性肿瘤的2%~3%,是最致命的泌尿系统恶性肿瘤之一[1]。临床上,肾癌切除术虽是肾细胞癌的常用治疗方式,但患者预后并不理想。目前,miRNAs已被证明在多种肿瘤细胞的增殖、侵袭以及迁移过程中起调节作用[2]。作为众多miRNAs的一员,miR-27a位于19号染色体上,是现在抗癌药物研发的靶点之一。已有研究报道,miR-27a在乳腺癌[3]、肝癌[4]等多种人类肿瘤发生中发挥着启动子的作用。然而miR-27a在RCC中的研究却少见报道。据报道[5],miR-27a可以通过Wnt/β-catenin通路调控结直肠癌的进展。且已有文献表明[6],激活Wnt/β-catenin通路能促进RCC细胞增殖、迁移与侵袭。因此,本研究首先检测miR-27a在RCC组织以及RCC细胞中表达情况,并进一步观察敲减miR-27a对RCC细胞增殖、转移以及Wnt/β-catenin通路的影响。
1 材料与方法
1.1 材料
1.1.1试剂 胎牛血清(FBS, #SV30087.03)以及DEME培养基(#SH30021.01B)购买自美国Hyclone公司;抗生素(#15140122)购买自美国Gibco公司;细胞转染试剂Lipofectamine 2000(#11668030)购买自美国Invitrogen公司;miR-27a inhibitor以及miR-NC购买自上海GenePharma公司;Taq PCR Master Mix试剂盒(#201445)购买自德国Qiagen公司;PVDF膜(#ISEQ00010)购自美国Millipore公司;抗β-catenin抗体(#GTX61089)购买自美国Genetex公司;RNAiso试剂(#9108Q)购买自日本TAKARA公司;CCK-8试剂盒(#CK04)购买自日本Dojindo公司;实验中其它试剂均购自美国Sigma公司。
1.1.2仪器 小型垂直蛋白电泳仪、小型垂直电转仪、GelDoc XR Biorad型凝胶成像系统和CFX96型荧光定量PCR 体系(Bio-Rad公司,美国);ELx800型酶标仪(Bio-Tek公司,美国);CX43型显微镜和BX63型荧光显微镜(Olympus公司,日本)。
1.2细胞培养与处理 正常肾小管上皮细胞(HK2)以及RCC细胞系Caki-1、786-O和ACHN购自ATCC。上述细胞均接种在含有10%FBS、1×105U·L-1青霉素和100 mg·L-1链霉素的DMEM培养基中,置于37 ℃、5%CO2的细胞培养箱中培养。
1.3 临床样本获取收集48例RCC患者的癌组织和癌旁组织,其中Ⅰ、Ⅱ、Ⅲ和Ⅳ期各12例。经病理检验,癌旁组织为正常肾脏组织。所有样本采集自在我郑州大学附属南阳市中心医院进行肾癌部分切除术或肾癌根治性切除术RCC患者,所有患者在实施手术前进行分期诊断。所有患者均知情同意,本研究通过郑州大学附属南阳市中心医院伦理委员会批准。
1.4 转染根据制造商说明书,通过Lipofectamine 2000将miR-27a-inhibitor以及miR-NC转染至786-O和ACHN细胞。转染48 h后,收集细胞用于后续实验。
1.5 细胞增殖实验收集已转染miR-27a inhibitor和miR-NC的786-O和ACHN细胞分别接种在96孔板上,每孔接种5 000个细胞,37 ℃分别培养1~4天。培养时间达到终点时,每孔加入10 μL CCK-8溶液,在培养箱内孵育2 h,随后用酶标仪测定在450 nm处的吸光度。
1.6 集落形成实验收集已转染miR-27a inhibitor和miR-NC的786-O和ACHN细胞分别接种在96孔板上,每孔接种100个细胞,37 ℃下培养10 d。 10 d后PBS洗涤并用甲醇固定,结晶紫染色后,采用显微镜下观察。
1.7 Transwell细胞实验侵袭实验:收集已转染miR-27a inhibitor和miR-NC的786-O和ACHN细胞分别转移至在无血清培养基中培养12 h。然后分别取100 μL细胞(密度5×104细胞·mL-1)加入1 ∶8稀释Matrigel 包被的Transwell上室面,将600 μL含有10%FBS的培养基置于下室。37 ℃培养24 h后,擦除上室上表面未穿膜的细胞,然后用4%多聚甲醛固定Transwell上室下表面的细胞,随后用0.1%结晶紫染色,显微镜随机选择8个视野计数。迁移实验:除不选用Matrigel 包被的Transwell板外,其他同侵袭实验。
1.8 细胞划痕实验收集已转染miR-27a inhibitor和miR-NC的786-O和ACHN细胞分别接种6孔板上,当细胞达到单细胞分子层融合时,使用无菌吸管尖端在细胞单层上制造人工划痕。分别在划痕后0 h和24 h后,用显微镜观察,通过Image J计算愈合面积百分比。
1.9 LiCl处理取已转染miR-27a inhibitor的ACHN细胞,分别加入10 mmol·L-1LiCl(Wnt/β-catenin信号激动剂)或等体积的溶媒DMSO,分别培养至指定时间后,采用CCK-8法检测细胞增殖(方法同1.5)和Transwell检测细胞侵袭与迁移(方法同1.7)。
1.10 RT-qPCR用RNAiso试剂从组织和细胞中提取总RNA。RNA通过逆转录试剂盒逆转录成cDNA。然后根据Taq PCR Master Mix试剂盒说明书步骤,将cDNA与引物一起在iQTMSYBR Green Supermix PCR体系中进行RT-qPCR。RT-qPCR反应条件为:94 ℃预变性5 min,然后94 ℃变性40 s, 60 ℃退火1 min,72 ℃延伸10 min,进行40个循环。引物序列为:miR-27a F: 5′-TTCACAGTGGCTAAG-3′,miR-27a R: 5′-GTGCAGGGTCCGAGGT-3′;U6 F: 5′- CTCGCTTCGGCAGCACA-3′,U6 R: 5′-AACGCTTCACGAATTTGCGT-3′。以U6作为内部参照,采用2-ΔΔCt法计算miR-27相对表达水平。
1.11 免疫荧光取HK2细胞、ACHN细胞或者已转染miR-27a inhibitor 的ACHN细胞,用4%多聚甲醛固定15 min并用0.3%Triton X-100室温处理20 min。随后加入一抗(β-catenin,1 ∶300)4 ℃下孵育过夜,d2用PBST洗涤三次后,加入荧光二抗孵育50 min,并用DAPI后避光孵育5 min复染。荧光显微镜下观察并拍照,随机选取10个视野,用Image J软件分析荧光值。
1.12 蛋白质免疫印迹RIPA裂解液裂解细胞或组织后取全蛋白。利用BCA试剂盒将蛋白样品统一定量,取相同体积蛋白样品通过SDS-PAGE凝胶电泳分离总蛋白。电泳结束后,将蛋白质转移至甲醇预活化的PVDF膜。转模结束后加入5%脱脂牛奶室温下封闭1 h并以1 ∶1 000的稀释比例孵育一抗(β-catenin)并 4 ℃过夜。d 2,TBST洗涤后室温孵育HRP标记的二抗1 h,以TBST洗涤后化学发光显影,Quantity One 软件分析条带的灰度值。

2 结果
2.1 miR-27a在各期RCC患者癌组织以及RCC细胞中的表达情况首先通过RT-qPCR检测RCC癌组织以及癌旁正常肾组织中miR-27a的表达情况。结果(Fig 1A)显示:与癌旁正常组织相比,RCC癌组织中miR-27a表达明显升高(P<0.01)。进一步对RCC患者进行分期,检测Ⅰ-Ⅳ期RCC患者癌组织中miR-27a的表达情况,结果(Fig 1B)显示,miR-27a表达量随RCC分期进展依次升高。采用RCC细胞系进一步验证miR-27a的表达情况,结果(Fig 1C)显示,相对于HK2细胞,Caki-1、786-O和ACHN细胞中miR-27a表达明显升高(P<0.01)。提示,miR-27a在RCC癌组织和RCC细胞中高表达。
2.2 敲减miR-27a对RCC细胞集落形成能力以及增殖的影响将miR-27a inhibitor转染至786-O和ACHN细胞中,观察细胞集落形成能力和增殖。集落形成实验结果(Fig 2A,2B)显示,相比于miR-NC组,转染miR-27a-inhibitor可降低786-O和ACHN集落数(P<0.01)。CCK-8法结果(Fig 2C,2D)显示,相比于miR-NC组,转染miR-27a-inhibitor可降低786-O以及ACHN细胞在450 nm处OD值(P<0.001)。提示,敲减miR-27a可抑制RCC细胞集落形成与增殖能力。

Fig 1 Expression of miR-27a in cancer tissues of RCC patients with different clinical stages and RCC cells

Fig 2 Knockdown of miR-27a on colony formation and proliferation in 786-O and ACHN n=3)
2.3 敲减miR-27a对RCC细胞迁移的影响将miR-27a inhibitor转染至786-O以及ACHN细胞中,通过细胞划痕实验检测细胞愈合迁移能力。结果显示,相比于miR-NC组,转染miR-27a inhibitor可明显降低786-O细胞(Fig 3A)和ACHN细胞(Fig 3B)的划痕愈合百分比(P<0.01)。
2.4 敲减miR-27a对RCC细胞侵袭和迁移能力的影响将miR-27a inhibitor转染至786-O和ACHN细胞,通过Transwell法检测细胞侵袭及迁移能力。结果显示,与miR-NC组相比,转染miR-27a inhibitor可明显降低786-O细胞(Fig 4A)和ACHN细胞(Fig 4B)的细胞侵袭与迁移能力(P<0.01)。
2.5 Wnt/β-catenin信号通路参与miR-27a inhibitor抑制的RCC细胞增殖、侵袭和迁移Western blot结果(Fig 5A)显示,相比于HK2细胞,ACHN细胞中β-catenin表达量明显升高(P<0.01)。将miR-27a inhibitor转染至ACHN细胞中,免疫荧光结果(Fig 5B)显示,相比于miR-NC组,转染miR-27a inhibitor的ACHN细胞β-catenin相对荧光密度明显降低(P<0.01),说明β-catenin表达量明显降低。为证明敲减miR-27a通过Wnt/β-catenin信号通路调节RCC细胞增殖、侵袭及迁移,本研究进一步采用LiCl处理已转染miR-27a inhibitor的ACHN细胞,实验结果显示,LiCl组细胞增殖(Fig 5C)、迁移(Fig 5D)、侵袭(Fig 5E)及能力明显高于未经LiCl处理的细胞(P<0.01)。
3 讨论
近年来,肾癌的发病率呈逐年增加趋势[7]。但目前对肾癌的治疗,特别是转移后的RCC的特异性治疗方面仍然有限。因此,对RCC转移的机制的研究仍然是当今医学科研工作者的重大的科研任务。

Fig 3 Knockdown of miR-27a on migration in 786-O and ACHN cells detected by cell wound healing n=3)

Fig 4 Knockdown of miR-27a on invasion and migration in 786-O and ACHN cells detected by Transwell n=3)
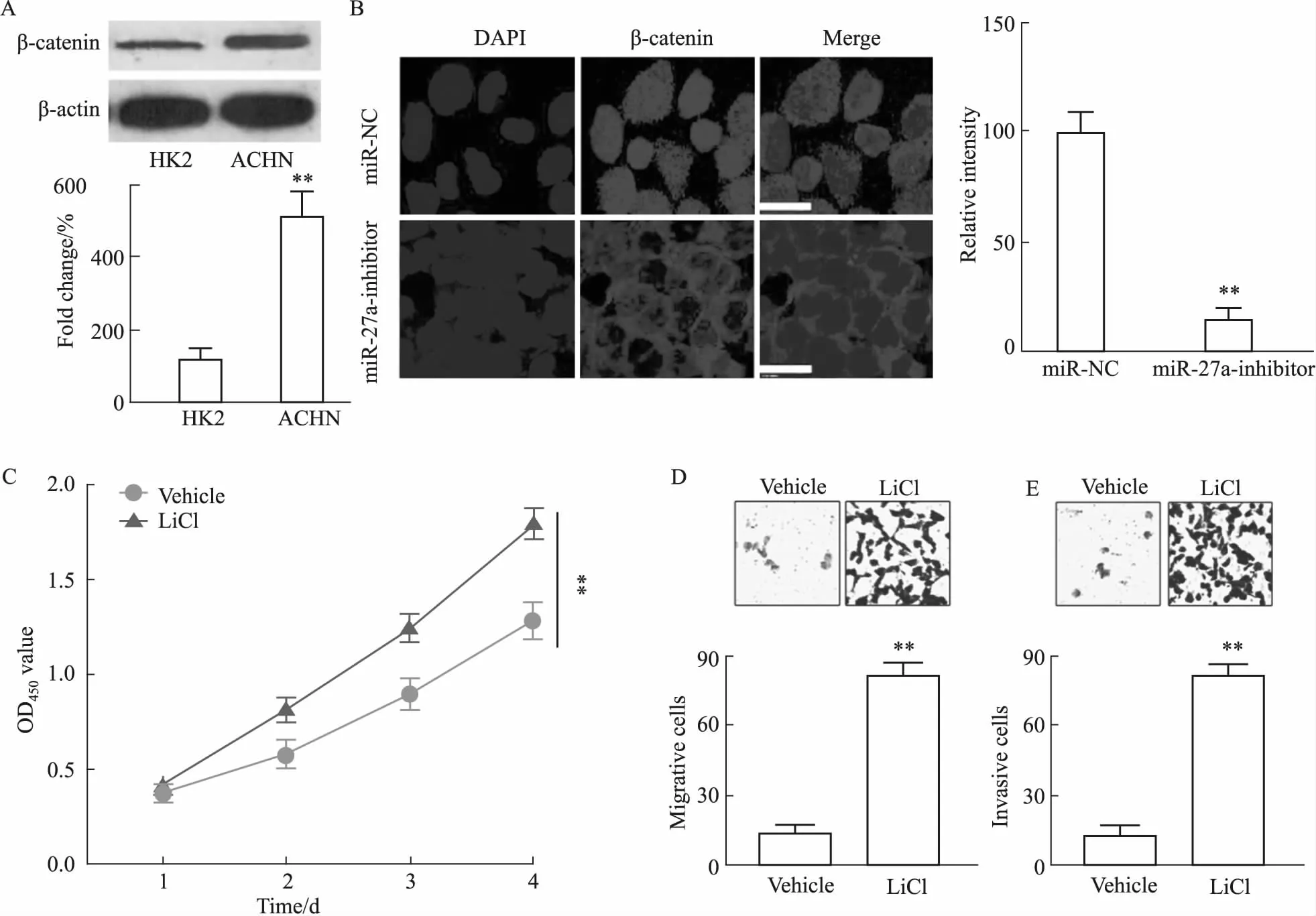
Fig 5 Wnt/β-catenin signaling pathway involved in proliferation, invasion and migration of ACHN cells inhibited by miR-27a inhibitor n=3)
鉴于许多miRNAs在肿瘤中作为肿瘤抑制因子或癌基因发挥作用的声誉越来越高,因此,在RCC患者中检测miRNAs可能为肾癌的诊断与治疗提供一个有价值生物标识物。如:miR-378a-5p[8]、miR-1294[9]和miR-31-5p[10]等可以作为RCC的抑制因子,而miR-19[11]、miR-23a-3p[12]和miR-223-3p[13]等在RCC中发挥癌基因作用。作为miRNAs的一员,已有报道[3-4],miR-27a在乳腺癌、肝癌等肿瘤的发促癌基因作用。然而,miR-27a在RCC中的研究尚少。 因此,我们采用RT-qPCR方法检测了48名RCC患者癌组织及癌旁组织中miR-27a的表达,发现癌组织中miR-27a表达明显高于癌旁正常组织,且,miR-27a表达量随分期进展而增加。本研究在RCC细胞系(Caki-1、786-O和ACHN)进一步确认了miR-27a的高表达。这些结果提示miR-27a可能在肾癌的进展中起到促进作用。随后,本研究将miR-27a inhibitor转染至RCC细胞系786-O和ACHN中,发现敲减miR-27a可以抑制细胞增殖、集落形成、迁移与侵袭。为寻找敲减miR-27a抑制RCC细胞增殖与转移的机制,本研究选择了与RCC发生与进展相关的Wnt/β-catenin 信号通路。Wnt/β-catenin 通路激活后使 β-catenin 蛋白在胞质内累积,可导致肿瘤发生[14]。且已有文献[6]表明,激活Wnt/β-catenin通路能促进RCC细胞增殖、迁移与侵袭。本研究结果表明,敲减miR-27a可降低ACHN细胞中β-catenin的表达,而通过LiCl激活Wnt/ β-catenin 信号通路能促进已转染miR-27a inhibitor的ACHN细胞的增殖、迁移与侵袭。这一结果表明,敲减miR-27a通过Wnt/β-catenin 信号通路抑制RCC细胞增殖和转移。然而miR-27a通过何种途径作用于β-catenin还需要进一步研究。
综上,本研究证明了miR-27a在RCC癌组织及RCC细胞中高表达,而敲减miR-27a可以通过Wnt/ β-catenin 信号通路抑制RCC细胞增殖和转移。本研究为RCC的治疗提高了新的研究靶点。

