一种植物根系根结染色方法的改进
冯加平,赵文超,李元慧,梁晶晶,张 旋,王绍辉,*,赵福宽
(北京农学院 a.植物科学技术学院/农业应用新技术北京市重点实验室;b.生物科学与工程学院,北京102206)
根结线虫(Root-knot nematodes RKNs)是一种植物寄生性线虫,也是危害最为严重的一种植物病原性线虫。其中,因种类多,分布广,能够感染3 000多种作物,如:蔬菜类、豆科类、油料作物类及果树类等。在根结线虫属(Meloidodynidae)中,南方根结线虫(Meloidogyneincognita)是农业生产中最常见的病原线虫。据统计,全球农业栽培作物90%以上的损失全部由根结线虫病引起,每年造成作物经济损失约为$1 180亿[1, 2]。番茄作为中国种植面积最广泛的一种栽培蔬菜之一,严重受根结线虫的侵害。南方根结线虫二龄幼虫(J2)主要侵染植株的营养根,也可侵染侧根和须根,侵染植株根尖部位后,找到合适的取食位点使周围5~7个宿主细胞发生畸变,诱导形成多核、肥大的巨细胞,巨细胞迅速膨胀,线虫附近的根组织细胞变厚,导致根部向外凸出并形成根结[3-5]。根结形成后,根尖部位继续生长,可二次受到RKN侵染,从而在根系上形成大大小小的根结,使根系呈念珠状。RKN侵染严重的植株根部呈现瘤状,根部水和营养物运输的能力丧失,植株发育受阻,植株整体长势衰退[6]。前期研究结果表明,根结的数量和大小与感染线虫的数量有关[7],根结数量一定程度上反映出植物对RKNs的敏感性。
由于根结数量庞大,根结体积大小不均,易与根毛的突起相混淆,因此,对根结进行染色目的在于与其他根系组织相区分。据研究报道,在线虫侵染植物根尖初始阶段,用酸性品红、冰醋酸和蒸馏水配制的染液采用煮沸的方式对入侵根尖部位的J2s及根结进行染色[8, 9],整个过程消耗时间较长,而且染料中冰醋酸刺激性气味较大。
本研究旨在将方法A进行优化后,快速、准确地区分根结与根系其他组织,提高试验效率,同时进一步证实方法I对拟南芥(Arabidopsisthaliana)和烟草(NicotianatabacumL.)植株根结染色的适用性。
1 材料与方法
1.1 植物材料
番茄野生型CM (该株系原始种子由中国科学院遗传与发育生物学研究所(北京)李传友研究员惠赠)、拟南芥和烟草。
根结线虫为南方根结线虫(Meloidogyneincognita),由农业应用新技术北京市重点实验室自繁。
1.2 材料的种植与管理
番茄(基质栽培):番茄种子在55 ℃温水中浸泡4~6 h,用3%的次氯酸钠溶液浸泡20 ~30 min,不断搅荡,无菌水冲洗3~5次,将种子整齐摆放预先铺有双层湿润滤纸(滤纸湿润无流动水)的培养皿上,做好标记。黑暗处理,催芽2~3 d。待大部分种子“露白”时立即播种于穴盘中,人工气候室中培养。气候室白天温度26~28 ℃,16 h光照相对湿度70%~80%,夜间16~18 ℃,8 h黑暗。根据番茄幼苗的生长状况,适时浇水和营养液,及时通风[10]。
拟南芥与烟草(基质栽培):将预先置于4 ℃冰箱中保存3~4 d烟草种子和预先用70%乙醇浸泡5 min,清水冲洗3~5次后,用牙签蘸取拟南芥与云烟种子插播于穴盘,在植物气候箱培养。28 d后,将烟草幼苗移栽直径为6 cm营养钵中,转移人工气候室中培养。气候室白天温度22 ℃,16 h光照,湿度70%~80%,夜间16~18 ℃,8 h黑暗。根据幼苗生长状况,适时浇灌水或营养液,及时通风[11, 12]。
1.3 南方根结线虫接种
将试验苗盆表面基质喷洒湿润,围绕植株根部1.5 cm处打4个孔,用移液枪将预先计数的南方根结线虫二龄幼虫(J2)悬浮液均匀注入4个孔内,每植株接种量500头/株。接种完毕后,用基质将孔覆盖住即可[13]。
1.4 染液配制及染色方法
方法A染液配制:称量3.5 g酸性品红溶于250 mL冰醋酸中,再加入750 mL的蒸馏水混匀即可(可根据植株根系大小、多少适当配制染色)。方法I染液配制:称量3.5 g酸性品红溶于1 000 mL的蒸馏水中,混匀即可(可根据植株根系大小、多少适当配制染色)。将2种染液进行稀释,使其染色液终浓度分别为0.5 g/L和2.5 g/L。
方法A:将洗净的植株根系置于1.5%的次氯酸钠溶液中浸泡5 min后,用清水冲洗30 s以便去除根系表面残留的次氯酸钠,后蒸馏水中浸泡15 min。将根系转入盛有酸性品红的100 mL的烧杯中,煮沸1 ~ 5 min (时间根据根结上色的情况而定, 以大部分的根结被染成红色为准, 若长时间不易上色, 可再向烧杯中添加少量酸性品红溶液),冷却后用自来水冲洗根系表面的残留的品红,然后转移到盛有100 mL酸性甘油(甘油中加几滴5 mol/L HCl)的烧杯中加热褪色0.5 ~ 1 h,根褪色即可见红色根结,根毛呈淡黄色,可进行根结数统计,并保存于甘油中。
方法I:将洗净的根系置于1.5%的次氯酸钠溶液中浸泡5 min后,用清水冲洗30 s后放入预先有蒸馏水的烧杯中浸泡15 min,除去根系表面残留的次氯酸钠溶液。晾干并将根系转入200 mL的烧杯中,加入浓度为3.5 g/L酸性品红溶液(以酸性品红溶液没过根系为准),室温放置染色45 ~ 60 min(染色时间可随根结大小调整,以绝大部分的根结被染成红色为准)后,流水冲洗表面的品红溶液,放置于预先有蒸馏水的烧杯中褪色2~5 min,便可见根结被染成红色,其他根系为淡黄色,即可进行根结数统计,并保存于甘油中。
所有数据均采用Excel进行记录,用SPSS 13.0多重比较法进行数据的单因素方差(ANOVA, Duncan检验)进行差异显著性分析,同时采用Graphpad Prism6进行图表制作,用Photoshop软件图片处理。
2 结果与分析
2.1 番茄、拟南芥与烟草根系根结染色比较
因较小根结与根毛突起人肉眼不易区分,造成的人为统计误差较大。结果显示番茄和云烟根系根结染色前后统计数量差异显著(图1-A)。而将根结染色后,根结呈深红色,根毛浅粉红色,则便于正确区分根结(图1-E~G)。植物由于根结构的不同,烟草和拟南芥植物根系接种后RKN对其根结染色,结果与番茄类似(图1-F, G)。结果表明,在确保数据的准确性前提下根结染色后较易于观察根结。
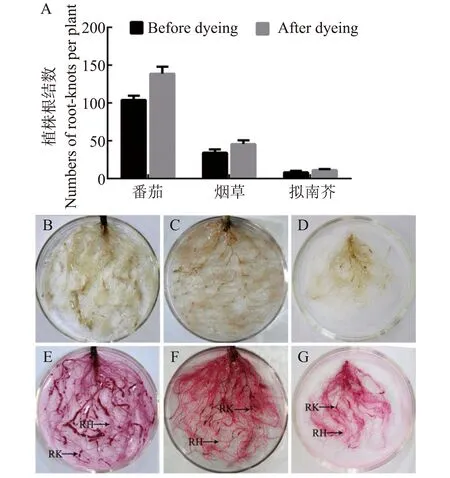
A.不同植株根系根结数目统计;B、E.染色前后的番茄根系根结;C、F.染色前后的烟草根系根结;D、G.染色前后的拟南芥根系根结;■染色前,染色后;RH: 根毛;RK: 根结图1 不同植株根系根结数目统计及根结染色前后对比图 Note:A:Number of root-knots of different plants;B、E:Tomato roots before and after staining;C、F:Tobacco roots before and after staining;D、G:Arabidopsis roots before and after staining;■ Before dyeing, After dyeing;RK:Root-knot;RH:Root HairFig.1 Number of root-knots of different plants and morphology of root-knot before and after staining
2.2 番茄植株根系根结不同染色方法效果比较
从图2 中可以看出,与未染色根结相比,染色根结易于人肉眼观察及区分;根系根结用方法A在煮沸的方式下染色(图2-B)与方法I不经过煮沸方式染色(图2-C)相比,染色效果无差异。
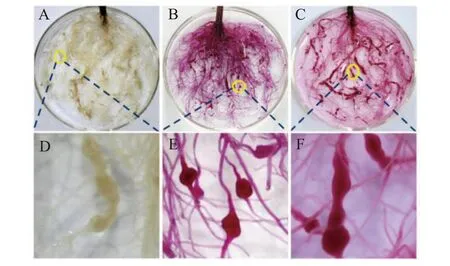
A、未染色根结;B、方法A染色根结;C、方法I染色根结;D、未染色根结放大图;E、方法A染色根结放大图;F、方法I染色根结放大图图2 不同染色方法根系根结染色比较 Note:A and D.Unstained root-knots;B and E.Root-knots stained with Method A (with boiling);C and F.Root-knots stained with Method IFig.2 Comparison of root-knot staining under different dyeing solutions
2.3 筛选最佳的染液浓度和染色时间
结果(图3、4和图5)表明,采用方法A和方法I对根结染色,随着染液浓度的增加,被染色根结所占总根结数的百分比增高,且染液浓度在3.5 g/L条件下被染色根结所占百分比达到90 %以上,且两种方法之间无明显差异(图3);在3.5 g/L染液浓度下,方法A和方法I根结染色效果较好且无差异(图4-C,I);而方法I 在染液浓度为3.5 g/L时,根结染色时间最长仅需45 min,便可将较大根结着色(图5-C)。
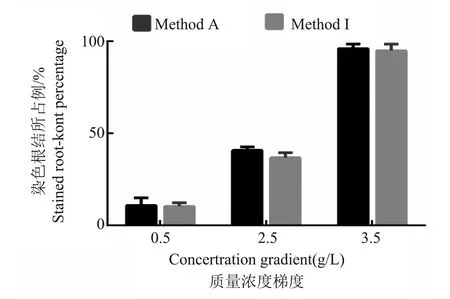
图3 两种染色方法不同染液浓度染色根结所占百分比比较Fig.3 Comparison of the percentage of root-knots stained with different dyeing concentration
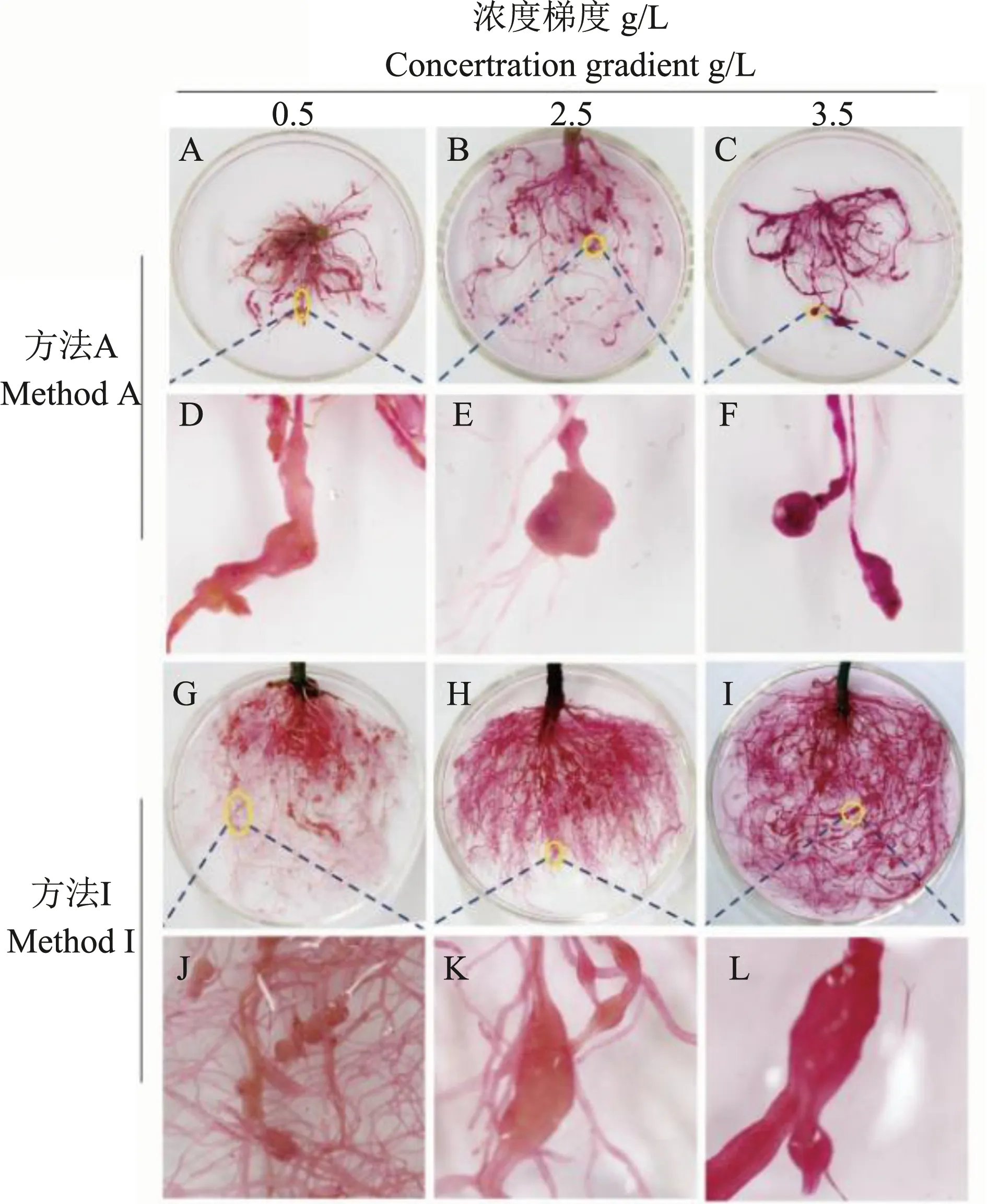
A-F.不同浓度下方法A染色效果图;G-L.不同浓度下方法I染色效果图图4 不同浓度下及不同染色方式根结染色效果图 Note:A -F,Method A with different dye concentrations;G-L,Method I withdifferent dye concentrationsFig.4 Dyeing effects of root-knot staining at different concentrations of different dyes
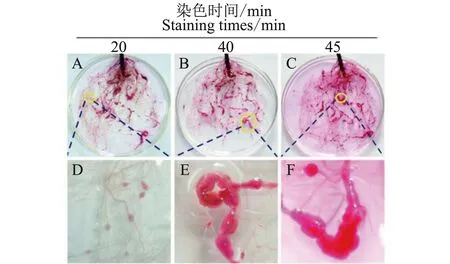
A-C.染色时间分别为20、40、45 min 的根结染色;D-E.对应染色根结的放大图图5 不同染色时间根系根结染色对比图 Note:A-C.Root-knots were stained and photographed after 20, 40 and 45 min;D-F.partially enlarged viewFig.5 Comparison diagram of root-knots staining with different staining time
2.4 根结脱色时间比较
由结果(图6)显示,不同的脱色剂对根系根结脱色处理5 min,方法I根结脱色效果较好,根结呈红色,根系其他组织成淡黄色,区分明显(图6-C);而方法A使用酸性甘油为脱色剂脱色7 d 便能区分根结与其他根系组织,且与方法I脱色效果相似(图6-B)。
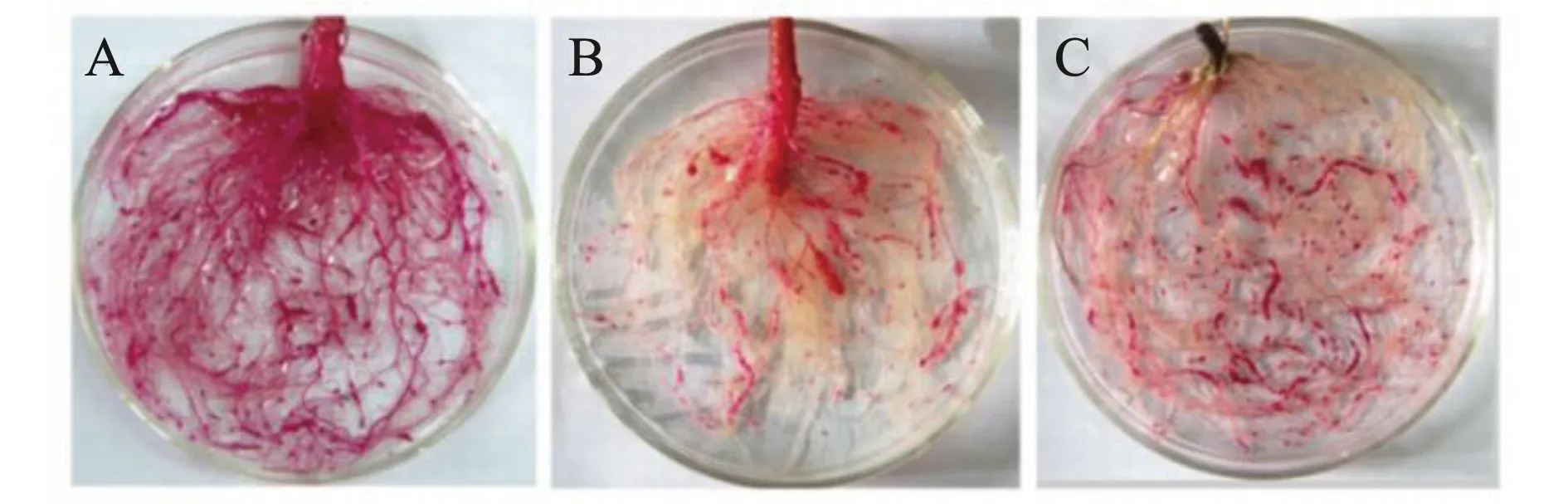
A.方法A脱色5 min;B.方法A脱色7 d;C.方法I脱色5 min图6 染色根结不同脱色时间比较 Note:A.Decolorize for 5 min using Method A;B.Decolorize for 7 d using Method A;C.Decolorize for 5 min using Method IFig.6 Comparison of different decolorization time of root-knots
2.5 方法I在不同植株中的染色验证
由结果(图7)显示:采用方法I中所确定的最适宜的染液浓度3.5 g/L染色烟草(图7-A)和拟南芥(图7-B)根结,因根系结构不同,烟草、拟南芥根系根结染色时间相对缩短。用蒸馏水直接脱色,脱色效果较好,则进一步说明方法A进行改良后,同样适用于其他植株中。
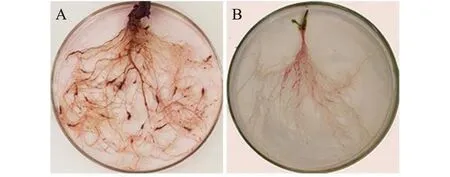
图7 烟草、拟南芥根结脱色比较Fig.7 Decolorization of root-knots of tobacco and Arabidopsis
2.6 染色方法流程比较
流程图(图8)看出,不同的方法对根结染色,方法I与方法A相比,染液成分与脱色液相差较大,试验操作步骤简化, 试验所用时间从7 d左右缩短至1 h,大大提高了试验效率,且根结在甘油中可长期保存。
3 讨 论
本研究对酸性品红染色的染色液及脱色液配方做出了重要改良,染液中去除了冰醋酸,脱色液中直接用蒸馏水代替了酸性甘油,但同时强调为使染剂能够沉积于根系组织中,将根系保存于甘油中[14]。方法I未采用煮沸方式进行根结染色,整个根结染色(45 min)与脱色(2~5 min)所需时间相比方法A (7 d)大大缩短,但根结染色效果两者并无明显差别。此外,本研究中确定了改良后的染液及脱色液的最适的浓度、染色时间和褪色时间。方法I整个试验过程可在1 h内完成,同时不影响染色效果(图8-B)。此外,我们还测定了方法I在不同模式植物中的适用性。因此,方法I优化了染液成分、简化了操作步骤,建立了一种快速、高效、安全、可靠的植物根结染色方法。值得注意的是,由于不同植物的根结构、根体积和根结大小不同,随着根结的数量和大小的增加,染色和脱色的时间也应相应延长。
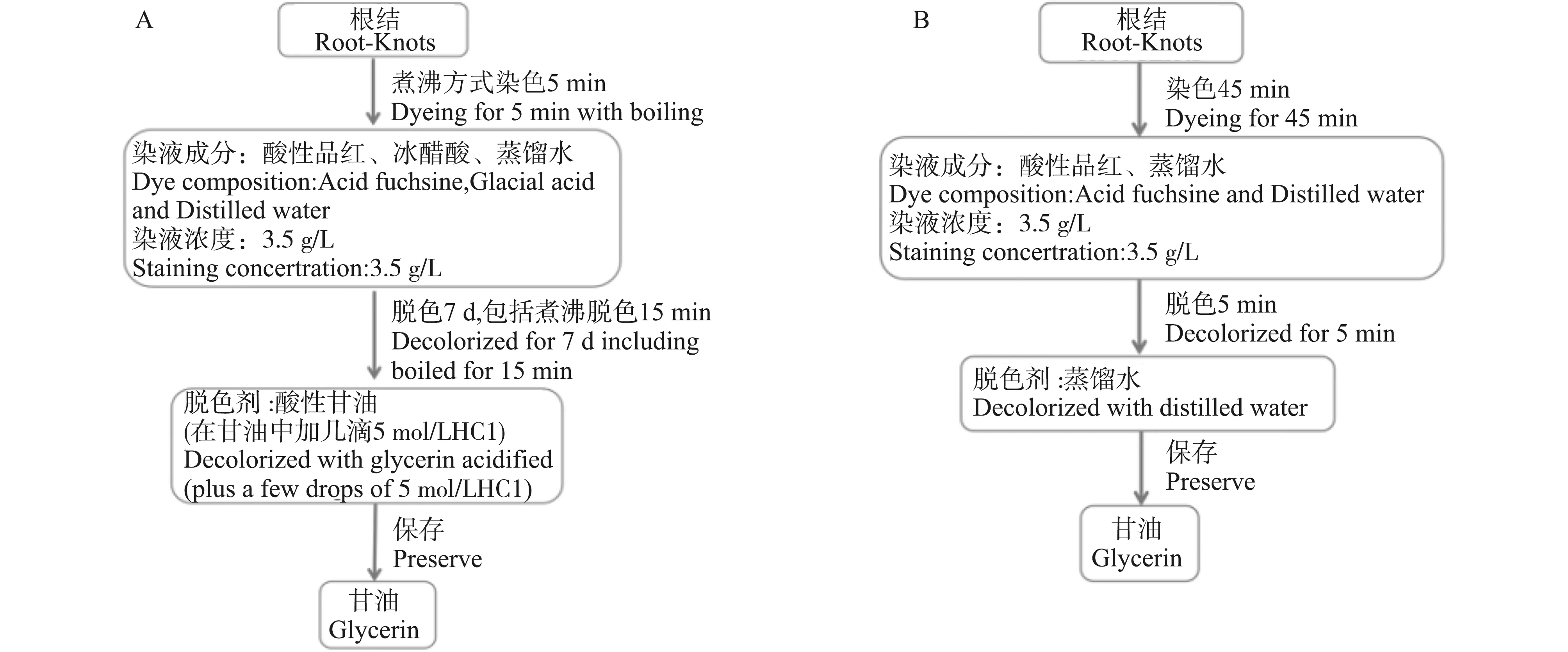
图8 两种方法染色过程流程图Fig.8 The staining processes with Method A (A) and Method I (B)
优化后的染液成分无挥发性物质,配制后可长期保存使用,方法A染液需现配现用(因冰醋酸具有挥发性)。从染料的性质来看,酸性品红(C20H17N3Na2O9S3)是一种生物染料,也是一种化学性质稳定的钠盐,对环境的危害较小。我们用不同浓度的染液对几种植物的根结染色,筛选出最适宜的染液浓度取决于植株根结数和根系结构。同时,在脱色过程中,针对植株不同根结大小、数量需要适当调整根结脱色时间,避免过度脱色,否则很难区分根结和根毛。综上所述,方法I是一种安全、高效、简便的根结染色方法,可快速判别出不同植物品种对南方根结线虫的抗性差异。

