miR-375靶向OTX1对宫颈癌HeLa细胞增殖、侵袭、迁移的影响
田姗 江海 刘慧 曹霞 张丹 牟尚东 李曾
宫颈癌是一种恶性肿瘤,其发病率和病死率呈升高趋势,已成为继乳腺癌之后威胁女性生命健康的第二大恶性癌症[1,2]。手术、化疗、放疗是宫颈癌的常用治疗方法,但其对机体伤害较大,且肿瘤易复发、患者不良反应较重[3],因此寻找治疗宫颈癌的有效手段、提高患者生活质量已成临床研究的热点。有研究发现,miRNA参与多种肿瘤细胞的增殖、凋亡、侵袭、迁移等生理过程,并影响肿瘤发生发展[4]。miR-375是一种肿瘤抑制因子,可参与宫颈癌等多种肿瘤的生物学过程[5]。人同源盒基因1(human homeobox gene 1,OTX1)也参与多种肿瘤的增殖、迁移等恶性生物学过程[6],但miR-375靶向调控OTX1表达参与宫颈癌HeLa细胞增殖、侵袭、迁移过程,笔者还未见报导。本研究探讨miR-375靶向调控OTX1表达参与宫颈癌HeLa细胞增殖、侵袭、迁移过程,以期为临床宫颈癌治疗提供新思路。
1 材料与方法
1.1 细胞 宫颈癌HeLa细胞株(厂家:北京索莱宝科技有限公司,货号:SCC-112011-1)。
1.2 主要试剂与仪器 实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)试剂盒(货号14966005)均购自于美国ThermoFisher公司;反转录试剂盒(货号K1622)购自于美国Fermentas公司;Trizol轴提取试剂盒(货号46301)购自于美国Sigma公司;荧光素酶活性试剂盒(货号E2920)购自于美国promega公司;荧光素酶报告载体由上汉恒生物公司提供;miR-375激动剂(miR-375 mimic)由英国Cohesion Biosciences公司提供(货号:CMH0171);miR-375抑制剂(miR-375 inhibitor)由江苏百奥迈科生物技术有限公司提供(货号:hsa-miR-375);LipoGene 2000 Star Transfection Reagent转染试剂盒(货号: L7002)由苏州宇恒生物科技有限公司提供;鼠抗人单克隆细胞增殖核抗原(nuclcar-associated antigen,Ki-67)抗体(货号sc-23900)、鼠抗人单克隆金属蛋白酶组织抑制物-2(tissue inhibitor of metalloproteinase-2,TIMP-2)抗体(货号sc-21735)均购于美国Santa Cruz公司;兔抗人多克隆基质金属蛋白酶2(Matrix metalloproteinases-2,MMP-2)抗体(货号ab97779)、兔抗人多克隆人同源盒基因1(Orthodenticlehomeobox 1,OTX1)抗体(货号ab25985)均购于美国abcam公司。酶标仪(型号SpectraMax iD3)购自于上海美谷分子仪器有限公司;电泳仪(型号1658001)购自于美国Bio-Rad公司;实时荧光定量PCR仪(型号ABI9700)购自于美国ABI公司。
1.3 方法
1.3.1 细胞复苏与培养:人宫颈癌HeLa细胞株常规复苏后,接种于RPMI-1640完全培养基(含1%双抗,10% FBS),置于37℃,0.5%的CO2孵育箱中培养,2~3 d换液,待细胞融合至80%时,用含EDTA的0.25%胰蛋白酶消化,1 500 r/min离心3 min,收集细胞沉淀,制备细胞悬液,细胞计数并接种后,收集对数生长期细胞进行后续实验。
1.3.2 转染及分组:取对数生长期HeLa细胞,常规消化离心后,调整细胞密度为4×105/ml接种于6孔板,每孔2 ml,细胞分5组,空白对照组(Control组)、miR-375 激动剂阴性对照组(mNC)组、miR-375激动剂组(miR-375 mimic组),miR-375抑制剂剂组(miR-375 inhibitor组),miR-375抑制剂阴性对照组(iNC组);Control组细胞不做任何处理,使其自然生长,mNC和miR-375 mimic组分别转染miR-375 mimic NC和miR-375 mimic,iNC组和miR-375 inhibitor组分别转染miR-375 inhibitor NC和miR-375 inhibitor;转染方法按LipofectamineTM2000试剂盒说明书进行,5组细胞转染48 h后,收集细胞以备后续实验。
1.3.3 MTT检测细胞增殖:取对数期HeLa细胞,调整细胞密度为2×104/ml,按200 μl/孔铺于96孔板,每组8个复孔,按照1.3.2中5组细胞处理方法,4组细胞均在24 h、48 h、72 h时,加入20 μl MTT试剂,继续培养4 h后,吸出培养基,每孔加150 μl DMSO震荡溶解后,用酶标仪测定波长为490 nm处5组细胞的吸光度值(OD值),并计算5组细胞的增殖率,细胞增率=实验组OD/空白组OD×100%。
1.3.4 Transwell检测HeLa细胞侵袭:收集1.3.2项下各组细胞,常规消化离心,以无血清培养基调整细胞密度为2.5×105/ml,取200 μl加入Matrigel处理后的Transwell上室中,24孔板下室加入完全培养基500 μl,培养24 h后,弃培养基,擦拭Matrigel和上室残留细胞,4%多聚甲醛室温固定30 min,0.2%结晶紫染色10 min,PBS清洗,风干后在倒置显微镜下随机选取5个视野观察并记录穿膜细胞数。侵袭率=实验组穿膜细胞平均数/空白组穿膜细胞平均数×100%。
1.3.5 细胞划痕检测宫颈癌HeLa细胞迁移:将1.3.2项下4组细胞,调整密度为2.5×105个/ml,每孔2 ml 接种于6孔板,第2天用300 μl无菌枪头于6孔板底部垂直制造细胞划痕,确保每个孔内划痕宽度一致,PBS清洗3次继续培养24 h后取样拍照,细胞迁移率=(0 h划痕区域宽度-拍照时间划痕区域宽度)/0 h划痕宽度×100%。
1.3.6 qRT-PCR检测宫颈癌HeLa细胞中miR-375、OTX1 mRNA相对表达水平:取1.3.2项下5组细胞,使用Trizol提取各组细胞总RNA,按照反转录试剂盒说明书对RNA合成cDNA,按照实时荧光定量PCR试剂盒说明书配制反应体系,反应条件95℃预变性15 min、95℃变性10 s、56℃退火20 s、72℃延伸50 s,40个循环,以U6、GAPDH为对照,采用2-ΔΔCt法分析miR-375、OTX1 mRNA相对表达水平。见表1。

表1 qRT-PCR引物序列
1.3.7 Western Blot检测OTX1、Ki-67、MMP-2、TIMP-2蛋白表达:取1.3.2项下5组细胞,置于冰水浴并加入含PMSF的RIPA裂解液,提取蛋白,BCA法蛋白定量,按照4∶1在蛋白中加5×的SDS-PAGE蛋白上样缓冲液,沸水浴加热3~5 min,置于-20℃保存。按照SDS-PAGE凝胶配方表制备10%分离胶和5%浓缩胶,以每泳道30 μg蛋白上样,蛋白凝胶电泳,根据蛋白marker切胶,转膜,对抗体OTX1、Ki67、MMP-2、TIMP-2均按照1∶500的比例稀释后4℃孵育过夜,TBST清洗,加入辣根过氧化物酶(HRP)标记的二抗,室温孵育并放摇床2 h,TBST清洗,参考ECL发光液说明书对条带孵育、曝光、显影。以Image J软件分析5组细胞蛋白相对表达水平。
1.3.8 双荧光素报告基因检测miR-375与OTX1的靶向关系:合成含OTX1的3’非翻译区(3’UTR)的miR-375识别序列,克隆至pmiRGlo载体,得到pmiRGlo-OTX1-3’UTR-WT。另外对miR-375识别区OTX1碱基进行突变连接至pmiRGlo载体,得到得到pmiRGlo-OTX1-3’UTR-MUT,分别将pmiRGlo-OTX1-3’UTR-WT、pmiRGlo-OTX1-3’UTR-MUT质粒与miR-375 NC、miR-375 mimics共转染,分为miR-375NC+OTX1-3’UTR-WT组、miR-375 mimics+OTX1-3’UTR-WT组、miR-375NC+OTX1-3’UTR-MUT组、miR-375 mimics+OTX1-3’UTR-MUT组,24 h后按照双荧光素酶报告基因检测试剂盒说明书添加萤火虫和海参荧光素酶试剂上机检测。每孔的数值以萤火虫荧光活性/海参荧光活性显示,试验重复3次。
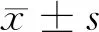
2 结果
2.1 5组HeLa细胞增殖率比较 与Control组、mNC组及iNC组相比,miR-375 inhibitor组细胞24、48、72 h增殖率均升高(P<0.05),miR-375 mimic组细胞增殖率降低(P<0.05);与miR-375 inhibitor组相比,miR-375 mimic组细胞增殖率降低(P<0.05)。见表1。

表1 5组细胞增殖率比较
2.2 5组HeLa细胞侵袭率比较 与Control组、mNC组及iNC组相比,miR-375 inhibitor组细胞侵袭率升高(P<0.05),miR-375 mimic组细胞侵袭率显著降低(P<0.05);与miR-375 inhibitor组相比,miR-375 mimic组细胞中侵袭率降低(P<0.05);Control组、mNC组及iNC组间相比,差异无统计学意义(P>0.05)。见表2,图1。

空白对照组mNC组iNC组miR-375 inhibitor组miR-375 mimic组
表2 对宫颈癌HeLa细胞侵袭能力比较
2.3 5组宫颈癌HeLa细胞迁移率比较 与Control组、mNC组、iNC组相比,miR-375 inhibitor组细胞迁移率升高(P<0.05),miR-375 mimic组细胞迁移率降低(P<0.05);miR-375 inhibitor组相比,miR-375mimic组细胞迁移率显著降低(P<0.05),Control组、mNC组及iNC组各组间相比(P>0.05)。见图2,表3。

Control组mNC组iNC组miR-375 inhibitor组miR-375 mimic组
表3 5组宫颈癌HeLa细胞迁移能力比较
2.4 5组HeLa细胞中miR-375、OTX1 mRNA相对表达水平比较 与Control组、mNC组、iNC组相比,miR-375 inhibitor组miR-375表达降低(P<0.05),OTX1 mRNA表达水平升高(P<0.05),miR-375 mimic组miR-375表达升高(P<0.05),OTX1 mRNA表达水平降低(P<0.05)。与miR-375 inhibitor组相比,miR-375 mimic组miR-375表达升高(P<0.05),OTX1 mRNA表达水平降低(P<0.05)。Control组、mNC组及iNC组各组间相比(P>0.05)。见表4。

表4 5组细胞中miR-375、OTX1 mRNA相对表达水平比较
2.5 5组HeLa细胞OTX1、MMP-2、Ki67、TIMP-2蛋白相对表达水平的影响 与Control组、mNC组、iNC组相比,miR-375 inhibitor组细胞OTX1、MMP-2、Ki67蛋白表达水升高(P<0.05),TIMP-2蛋白表达水平降低(P<0.05),miR-375 mimic组细胞OTX1、MMP-2、Ki67蛋白表达水平均降低(P<0.05),TIMP-2蛋白表达水升高(P<0.05);与miR-375 inhibitor组相比,miR-375mimic组细胞OTX1、MMP-2、Ki67蛋白表达水平升高(P<0.05),TIMP-2蛋白表达水平降低(P<0.05);Control组、mNC组及 iNC组各组间相比,差异无统计学意义(P>0.05)。见表5,图3。

表5 5组宫颈癌HeLa细胞OTX1、MMP-2、Ki67、TIMP-2相对表达水平比较

图3 5组HeLa细胞中OTX1、MMP-2、Ki67、TIMP-2 蛋白表达免疫印迹情况
2.6 miR-375与OTX1的靶标关系 TarBase v.8数据库预测OTX1 3’-UTR与miR-375 mRNA的3’UTR区存在结合位点。与miR-375 NC+WT-OTX1 3’-UTR组比较,miR-375 mimic+WT-OTX1 3’-UTR组荧光素酶相对活性显著降低(P<0.05);miR-375 NC+MUT-OTX1 3’-UTR组、miR-375 mimic+MUT-OTX1 3’-UTR组荧光素酶相对活性差异无统计学意义(P>0.05)。见图4,表6。

图4 TarBase v.8数据库预测miR-375与OTX1基因存在结合位点图

表6 双荧光素酶报告实验验证miR-375与OTX1靶向关系
3 讨论
肿瘤细胞的增殖、侵袭、迁移等恶性生物学行为,严重影响患者的生存和预后,而探究肿瘤恶性生物学过程的分子机制,寻找有效的抑制肿瘤产生与恶化的方法、提高癌症患者生存率一直是临床研究的重点和难点[7,8]。
miR-375可多种癌细胞中表达,并影响癌细胞的增殖、侵袭和凋亡过程[9,10]。Mao等[11]发现在结肠癌组织及细胞中miR-375表达较低,而上调miR-375表达可抑制结直肠癌细胞增殖;Xie等[12]发现miR-375在肝癌组织表达水平明显低于正常组织,且与肝癌转移密切相关;Li等[13]研究发现miR-375参与胶质母细胞瘤细胞增殖、迁移和侵袭过程。OTX1与胚胎发育有关[14],但近年来研究发现OTX1也参与多种肿瘤的恶性生物学的过程,Yang等[6]发现OTX1高表达,可促进乳腺癌细胞的增殖;Qin等[15]研究发现OTX1是胃癌细胞生长和转移的关键调控因子,而敲除OTX1基因可抑制胃癌细胞增殖;Li等[16]研究发现降低OTX1蛋白表达可抑制影响肝癌细胞增殖和迁移。本研究用miR-375 激动剂和抑制剂处理子宫内膜癌HeLa细胞后发现,与Control组、mNC组、iNC组相比,miR-375 inhibitor组miR-375表达增高、OTX1 mRNA及蛋白表达降低,而细胞增殖、侵袭、迁移也相对增高,反之miR-375 mimic组miR-375表达降低、OTX1 mRNA及蛋白表达升高,而细胞增殖、侵袭、迁移却明显降低,提示miR-375低表达,OTX1高表达可促进HeLa细胞增殖、侵袭、迁移。而双荧光素酶报告实验发现,miR-375与OTX1存在结合位点,WT-miR-375 mimic+OTX1 3’-UTR组的荧光素酶相对活性低于WT-miR-375 NC+OTX1 3’-UTR组,表明miR-375过表达可靶向抑制OTX1表达,抑制肿瘤的增殖、侵袭、迁移。
Ki67与细胞增殖密切相关,是细胞增殖的标志物[17];St lhammar等[18]发现乳腺癌病理级别越高,Ki67蛋白表达越高,其肿瘤有丝分裂及增殖活性越高。MMP-2可促进细胞迁移、侵袭,而TIMP-2可抑制MMP-2分泌,抑制肿瘤细胞迁移、侵袭[19],Chien等[20]发现在三阴性乳腺癌细胞中,抑制TIMP-2表达,MMP-2及MMP-9表达增高,癌细胞侵袭及迁移活性明显增强。本研究发现,与Control组、mNC组、iNC组相比,miR-375 inhibitor组Ki67、MMP-2蛋白表达增高、TIMP-2蛋白表达降低进一步表明miR-375高表达可靶向抑制OTX1表达,抑制增殖、侵袭、迁徙相关分子表达,降低HeLa细胞增殖、侵袭、迁移活性。
综上所述,miR-375可能通过靶向抑制OTX1表达,降低宫颈癌增殖、迁移、侵袭活性,可能为临床治疗宫颈癌提供新靶点、新思路。然而癌细胞增殖、侵袭、迁移等恶性生物学发生发展过程中,分子生物学机制较为复杂,miR-375靶向调控OTX1表达,抑制宫颈癌增殖、侵袭、迁徙过程的具体分子机制,还有待进一步研究。

