Ⅰ~Ⅱ期胰腺导管腺癌的临床病理特征及预后分析
曹经琳 窦剑 高庆军 赵鑫 崔自强 姜翀弋 王巍
近年来,我国胰腺癌的发病率和病死率均呈现上升趋势。据统计,北京、上海等大城市胰腺癌死亡人数已占所有恶性肿瘤的第五位[1,2];在西方国家,胰腺癌死亡人数是所有恶性肿瘤的第四位[3,4]。由于胰腺癌起病隐匿,仅有少数患者可行根治性手术切除,而术后5年生存率仅约20%;绝大多数患者,在确诊时已经丧失手术机会,且放化疗效果甚微,中位生存期仅4~6个月[5]。在过去的30年里,科技和医疗水平迅猛发展,尽管大多数肿瘤患者生存率有了明显的改善,但胰腺癌却无明显改变[3,4]。为探索胰腺癌的发病规律,本研究回顾性分析复旦大学附属华东医院75例早期胰腺导管腺癌(PDAC)的一般情况和临床病理学特征,以期为胰腺癌的临床诊治及预后评估提供参考。
1 资料与方法
1.1 一般资料 收集2002年1月至2011年12月复旦大学附属华东医院的75例P<0.05的一般情况和临床病理学特征。在75例患者中,男46例,女29例;年龄38~81岁,平均年龄(61.97±9.76)岁,其中,年龄<65岁43例,≥65岁32例;肿瘤位于胰头52例,胰体尾23例;肿瘤最大径≤2 cm 14例,最大径>2 cm 61例;高-中分化60例,低分化15例;参照2019年WHO消化系统肿瘤分类,TNM分期Ⅰ期32例,Ⅱ期43例;有神经侵犯者30例;术后病理证实手术切缘阳性者14例。
1.2 纳入与排除标准
1.2.1 纳入标准:①病理诊断为胰腺导管腺癌;②TNM分期为Ⅰ期和Ⅱ期;③获取至少3年的患者生存随访资料;④术前未行放化疗。
1.2.2 排除标准:①围手术期死亡病例;②姑息性切除手术。最终随访时间为2021年3月。
1.3 方法 对75例PDAC患者的电子病历资料进行查阅,记录患者性别、年龄、肿瘤大小、肿瘤部位、肿瘤分级、肿瘤分期、神经侵犯和手术切缘等临床资料。术后经过门诊或电话随访、住院病史查询和户籍科查询,随访至2021年3月1日。
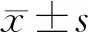
2 结果
2.1 75例早期PDAC患者临床病理特征 75例早期PDAC患者中,男46例,占比为61.3%,女29例,占比为38.7%;年龄38~81岁,平均年龄(61.97±9.76)岁,其中,年龄<65岁43例,占57.3%,≥65岁32例,占42.7%;肿瘤位于胰头52例,胰体尾23例,分别占69.3%和30.7%;本研究所收集病例均为早期病例,参照2019年WHO消化系统肿瘤分类,TNM分期Ⅰ期32例,占42.7%,Ⅱ期43例,占57.3%;胰腺导管腺癌侵犯神经者30例,占40.0%,未侵犯神经者45例,占60.0%;肿瘤最大径≤2 cm 14例,最大径>2 cm 61例,分别占18.7%和81.3%;本研究所收集病例无未分化癌,为研究方便,将高分化癌和低分化癌归为一组,即高-中分化组,高-中分化癌60例,占80.0%,低分化癌15例,占20.0%;术后病理证实手术切缘阳性者14例,占18.7%,其余61例切缘阴性,占81.3%。见表1。
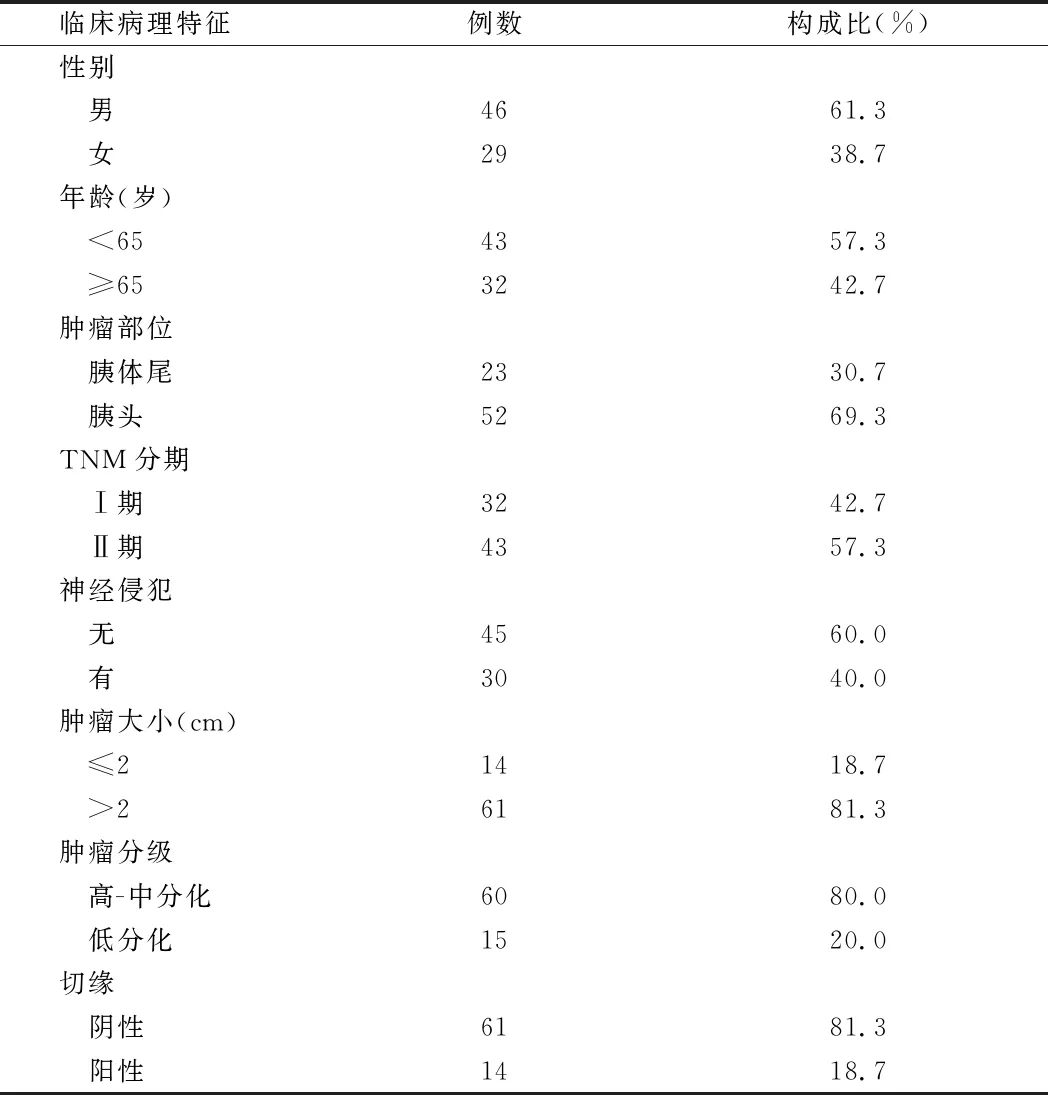
表1 75例早期PDAC患者临床病理特征
2.2 75例早期PDAC患者术后生存情况 生存情况随访截止2021年3月,75例患者中死亡63例,存活9例,失随访3例,总体生存时间为1.8~171.8个月,中位生存时间(21.53±2.77)个月。术后1年生存率为73.3%,术后2年生存率为46.7%,术后3年生存率为33.3%,术后5年生存率为18.7%。见图1、2。

图1 早期胰腺导管腺癌根治术后生存函数

图2 早期胰腺导管腺癌根治术后危险函数
2.3 单因素分析PDAC患者临床特征与生存期的关系 不同性别、年龄、肿瘤部位、TNM分期、神经侵犯的中位生存时间比较,差异均无统计学意义(P>0.05)。PDAC肿瘤最大经≥2 cm者较>2 cm者术后生存中位时间长,高-中分化者较低分化者术后生存中位时间长,手术切缘阴性者较切缘阳性者术后生存中位时间长,差异均有统计学意义(P<0.05)。见表2,图3~5。

表2 单因素分析PDAC患者临床特征与生存期的关系 例(%)


图3 不同肿瘤大小的早期PDAC术后生存曲线图4 不同肿瘤分级的早期PDAC术后生存曲线图5 不同手术切缘的早期PDAC术后生存曲线
2.4 多因素Cox回归分析早期PDAC根治术后患者临床特征与总生存期的关系 多因素Cox回归分析显示,肿瘤大小(P=0.038,HR=2.125,95%CI:1.043~4.330)、肿瘤分级(P=0.041,HR=1.371,95%CI:1.014~1.854)、手术切缘(P=0.018,HR=2.107,95%CI:1.138~3.901)均为早期胰腺导管腺癌根治术后患者预后的独立危险因素。见表3。

表3 多因素Cox回归分析PDAC患者临床特征与生存期的关系
3 讨论
在我国,根据国家癌症中心发布的数据,胰腺癌占所有恶性肿瘤的2.7%,排名第十位,而其病死率排在所有恶性肿瘤的第五位,恶性程度极高,5年生存率仅为7.2%,为常见肿瘤中最差[6]。任虎等[7]对307例经过R0切除的胰腺癌患者进行随访,中位生存期为24.0个月,1年、3年、5年生存率分别为72.0%、35.5%和24.0%。无论是中位生存期还是3年、5年生存率均略好于本研究的结果。究其原因,任虎等[7]选择的是更为严格的R0切除术后的患者,本研究选择的是宏观根治术后的患者,故病理证实仍有14例切缘阳性患者。在本研究中,若仅分析切缘阴性的61例PADC患者,中位生存期和生存率分别与任虎等[7]研究结果较为接近。
本研究发现,单因素生存分析表明肿瘤大小、分化程度和手术切缘与预后相关。多因素分析表明,肿瘤大小、分化程度和切缘是预后相关的独立危险因素。Kaplan-Meier生存分析显示PDAC肿瘤最大径≤2 cm者和肿瘤最大径>2 cm者术后中位生存时间分别为26.47个月和20.47个月,差异有统计学意义(P=0.028)。李佶松等[8]通过对手术切除的143例胰腺导管腺癌病例进行回顾性分析,认为肿瘤大小是预后的独立危险因素。Oba等[9]对7 849例PDAC患者进行分析,认为肿瘤大小与生存期相关。Nakamura等[10]分析278接受手术切除的患者,认为肿瘤大小>2 cm是PDAC患者预后不良的独立预测因素。Kaplan-Meier生存分析显示PDAC高-中分化者和低分化者中位生存时间分别为25.20个月和12.73个月,差异有统计学意义(P=0.040)。阿布拉·白克热等[11]通过对139例老年胰腺癌患者研究,认为低分化是影响胰腺癌预后的危险因素。任虎等[7]对307例经过R0切除的胰腺癌患者进行分析,认为分化程度是R0切除后胰腺癌患者的独立预后因素。高翔等[12]认为低分化胰腺癌比中-高分化者预后差。这些与本研究结果一致。究其原因,分化程度越低,患者肿瘤细胞越活跃,侵袭性越强,进展速度快,预后越差[13]。Kaplan-Meier生存分析显示PDAC手术切缘阴性者和切缘阳性者术后中位生存时间分别为25.20个月和16.13个月,差异有统计学意义(P=0.024)。刘心悦等[14]对102例病理诊断为胰腺癌的患者进行回顾性研究,4例手术切缘阳性的胰腺癌患者中位生存期为5.85个月,1年生存率为25.0%,而40例切缘阴性的胰腺癌患者中位生存期为14.85个月,1年生存率为62.5%(P=0.025),认为切缘癌浸润是胰腺癌的危险因素。由于本实验选取的胰腺癌病例为早期,故中位生存期和生存率均好于刘心悦等[14]的研究结果。
刘心悦等[14]研究显示,不能证明性别、肿瘤部位与胰腺癌预后相关。而本研究亦未能证明患者生存期与性别、年龄组成、肿瘤部位、TNM分期、神经侵犯有关。陈祺等[15]认为早期胰腺癌的预后与年龄相关。在本实验中,未发现预后与年龄相关。张永寒等[16]认为肿瘤部位是预后是患者术后总生存期的独立预后因素。但本实验未发现肿瘤部位与预后相关。Lee等[17]发现位于胰头的胰腺癌的5年生存率明显高于位于胰腺体尾部。在多因素分析中,肿瘤位置不是胰腺癌的独立预后因素。胰腺癌预后与年龄的关系,学术界有争议。Ntala等[18]发现50岁以下PDAC比老年PDAC患者接受了积极的治疗,但生存期未有明显差别。PDAC患者生存期与年龄无关。然而,Zorgetto等[19]对100例胰腺癌病例的研究显示,高龄(74岁以上)是胰腺癌预后因素。年龄越高,发展为肿瘤的概率越大。在我们的研究中,未发现胰腺癌生存期与年龄相关。
综上所述,早期胰腺癌经过根治性手术,生存期可明显延长。PDAC患者的根治术后生存时间与肿瘤大小、分化程度和手术切缘相关,可为判断胰腺癌的预后提供依据。胰腺癌应早发现、早治疗,可提高胰腺癌的治疗效果,延长患者术后生存期。

