藏药唐古特白刺果提取物改善2型糖尿病大鼠认知功能的作用及可能机制※
常 琼,丘熠童,马晓雨,常秀君,何 敏,夏晓晓,黎 娅,吴 穹#
(1.青海大学附属医院,西宁 810001;2.青海大学医学院,西宁 810001;3.重庆市大足区人民医院,重庆 402360)
藏药唐古特白刺果临床用于改善2型糖尿病患者认知功能[1],但尚无依据。本研究利用唐古特白刺果提取物开展动物实验研究,探讨其改善2型糖尿病大鼠认知功能的作用,并进一步分析其作用机制。
1.材料与方法
1.1 材料
SD大鼠〔北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006〕,4周龄,体质量约100 g。唐古特白刺提取物(青海大学基础医学实验中心);柠檬酸钠缓无菌缓冲液(Solarbio公司);多聚甲醛(Wabcan公司);TNF-α(Solarbio公司);RAGE(Solarbio公司);NFκB-P65(Solarbio公司);IL-1β(Solarbio公司);高脂饲料(基础饲料+10%猪油、10%蔗糖、1%胆固醇、0.3%胆酸钠。北京博爱港公司);链脲佐菌素(STZ,MeRcK公司)。-80 ℃低温冰箱(Thermo Forma公司);台式离心机(Heraeus公司)。
1.2 方法
1.2.1 模型建立
通过给予大鼠高糖高脂饲料结合STZ尾静脉注射法建立。参照文献[2],将30只大鼠置同一环境适应性饲养72 h,结束后随机分成两组:对照组(NG,10只)、模型组(DE,20只),分别用等量普通饲料、高脂饲料喂养。12 w后,在保证大鼠意识清楚的情况下,模型组大鼠经尾静脉注射STZ(25mg/kg),NG组大鼠注射等剂量柠檬酸钠无菌缓冲液。第7 d时取尾静脉血测定血糖。造模成功标准:随机血糖水平≥16.7 mmol/L。
1.2.2 动物分组及给药
将造模成功的20只大鼠随机分为模型组(DM,10只)、治疗组(DM+NTB,10只)后灌胃,治疗组的灌胃物为唐古特白刺提取物(3.6/kg·d),NG、DM组予以等剂量生理盐水,持续4 w。
1.2.3 标本收集及指标测定
将大鼠禁食12 h,麻醉[腹腔注射10%水合氯醛(0.3mL/100g)],剥离海马组织后迅速放入4%多聚甲醛固定液中,至少浸泡48 h。
1.2.4 HE染色
将海马组织脱水、包埋、切片、染色,使用光镜观察大鼠海马及皮层神经细胞的形态结构。
1.2.5 免疫组化染色
海马组织固定、包埋、切片过程同HE染色,按试剂盒说明行免疫组织化学染色。镜下观察,阳性细胞呈黄色或棕黄色。
1.2.6 统计学处理

2.结果
2.1 HE染色情况
光镜下发现,NG组大鼠海马区细胞排列密集且较为平整,轮廓清晰,核膜连续无中断,胞核多呈圆形。DM组细胞排列较NG组显杂乱,部分细胞结构断裂且胞浆呈空泡状,可见坏死的神经元,其分布范围广。DM+NTB组细胞排布尚齐整,细胞间隙增大,可见散在的坏死神经细胞,较DM组有改善。详见图1。
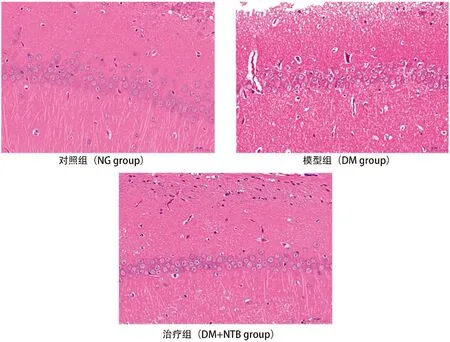
图1 海马细胞形态结构变化图(HE染色×,400)
2.2 RAGE、NF-κB(p65)、TNF-α、IL-1β蛋白在海马组织中的表达情况
免疫组化结果显示,RAGE产生的阳性产物大多集中在细胞核;NF-κB(p65)、TNFα、IL-1β蛋白主要分布在细胞质。NG组海马组织中的RAGE、NF-κB P65、TNF-α、IL-1β蛋白表达少且分布区域局限;DM组RAGE、NF-κB P65、TNF-α、IL-1β蛋白明显增加且分布区域扩大;DM+NTB组RAGE、NF-κB P65、TNF-α、IL-1β蛋白表达水平介于NG和DM之间。详见图2~5。

图2 RAGE在海马组织中的表达图(免疫组化染色,×400)

图3 NF-κB在海马组织中的表达图(免疫组化染色,×400)

图4 TNF-α在海马组织中的表达图(免疫组化染色,×400)

图5 IL-1β在海马组织中的表达图(免疫组化染色,×400)
三组RAGE、NF-κB(p65)、TNFα、IL-1β蛋白表达(光密度值)比较均有统计学差异(P<0.05),两两比较,DM组高于NG组(P<0.05);DM+NTB组介于NG组和DM组之间,其中DM+NTB组的RAGE、NF-κB(p65)、TNFα蛋白表达(光密度值)与NG组比较有统计学意义(P<0.05),DM+NTB组的RAGE、NF-κB(p65)、TNFα、IL-1β蛋白表达(光密度值)与DM组比较有统计学意义(P<0.05),详见表1。上述结果显示,藏药唐古特白刺果提取物可能通过抑制RAGE/NF-κB炎症信号通路而起到保护大鼠海马神经细胞的作用。

表1 三组蛋白表达水平
3.讨论
本研究利用唐古特白刺果提取物开展动物实验研究,明确其具有改善糖尿病大鼠认知功能的作用,且可能通过抑制RAGE/NF-κB信号通路改善糖尿病大鼠认知功能。
大鼠认知能力出现异常与脑组织受损相伴[3]。有研究认为,氧化应激、AGEs增多和NF-κB(p65)、IL-1β、IL-6等蛋白升高因素构成了DE发生的关键神经病理基础。本研究试图探讨唐古特白刺果通过抑制RAGE/NF-κB信号通路改善糖尿病大鼠认知功能的作用机制。
目前已证实,随着病情进展,2型糖尿病患者伴发认知障碍的可能性较高,后期可迁延至痴呆[4]。许多研究表明,糖尿病作为引发患者认知功能减退和阿尔兹海默症(AD)等病症的独立危险因素,其与AD的病理基础存在较大相关性[5],如AGEs及其受体RAGE不仅在T2DM动物模型中表达增加,在AD中也会增加[6]。DE是指糖尿病患者随着病情发展至影响中枢神经系统功能的神经病理学改变。大量基础研究也证实DE的病理发展过程与晚期糖基化终末产物(AGEs)增多、氧化应激、胰岛素抵抗等多种因素关系密切[7]。
AGEs是葡萄糖和果糖自动氧化产生的衰老蛋白质衍生物,在重建组织和维持人体内环境稳态过程发挥关键作用。但过量蓄积也会导致多器官组织产生病理改变,如导致机体处于持续的高血糖状态,AGEs作为高血糖应激产物相应地快速累积,可导致凝血途径异常,加速血栓形成,最终引起脑部疾病。RAGE在多种组织细胞中均有表达,如星形胶质细胞、内皮细胞等,可通过蛋白修饰和降解AGEs降低神经炎症反应,减轻脑损伤。AGES及受体RAGE可以通过多种机制引起神经细胞的功能减退。AGEs与RAGE结合可引起氧化应激,从而诱导如IL-6、TNF-α等增加。这些细胞因子可破坏神经元的正常生理进程,使神经元轴突、树突数量减少,突触可塑性减低,导致认知障碍。此外,上述机制还参与介导炎症年龄效应。AGEs能预生成血管内皮生长因子(VEGF)[8],并通过激活NF-κB通路,引起靶基因产物VEGF的产生[9]。新生血管、血脑屏障通透性和硬脑膜淋巴管的病理性改变是DM患者脑血管病变特征,即VEGF的生成与DE直接相关[10]。RAGE在组织中的过表达参与胰岛素抵抗,而新陈代谢和胰岛素信号水平异常可引发脑部疾病。有研究表明,RAGE和LRP-1的上下行调控不平衡可引发DM大鼠海马和前额叶Aβ沉积,并进一步加重认知障碍[11]。关于天然化合物治疗DE的研究已开展,目前发现小檗碱、黄芪提取物毛蕊异黄酮、姜黄素等具有显著的抗氧化和抗炎作用,且已有动物实验证明上述药物能够有效改善认知能力。应用具有保护神经活性作用的天然药物,有助于改善2型糖尿病患者脑神经细胞退化和引发的认知障碍。
本研究结果表明,唐古特白刺果能够改善2型糖尿病大鼠的认知障碍,提示其机制与抑制RAGE/NF-κB炎性信号通路有关。

