VEGF在高成瘤MDCK、Hela细胞裸鼠模型肿瘤中的表达情况
许 瑾,张 兰,钟璧欢,黄 婕,杨映雪,乔自林,2,3,杨 琨,2*
(1.西北民族大学 生命科学与工程学院,甘肃 兰州 730030;
2.西北民族大学 生物医学研究中心 甘肃省动物细胞技术创新中心,甘肃 兰州 730030;3.西北民族大学 生物医学研究中心 生物工程与技术国家民委重点实验室,甘肃 兰州 730030)
血管内皮生长因子(vascular endothelial growth factor,VEGF),是一种高度特异性促进血管内皮细胞生长的因子,可以有效促进肿瘤细胞的生长以及肿瘤血管的生成[1]。科学研究表明,肿瘤血管比正常血管对VEGF敏感[2]。VEGF与血管内皮细胞表面受体结合后通过自分泌及旁分泌调节机制,促进血管内皮细胞分裂增殖,血管内皮通透性增加,使血浆蛋白渗出,为肿瘤生长提供合适的微环境。也有相关研究显示[3-4],VEGF在低氧或缺氧条件下,有利于其与肿瘤相关巨噬细胞(TAM)表面受体结合,促进VEGF-A的分泌,进而促进肿瘤血管形成、侵袭及转移。此外,肿瘤的恶性程度以及不同分化程度也会影响VEGF的作用水平[5]。
MDCK细胞是Madin和Darby于1958年从美国Cocker Spaniel母曲架犬的肾脏组织分离出的呈贴壁生长的上皮样细胞。MDCK细胞增殖迅速、易培养,对流感病毒敏感且不易发生突变[6]。Hela细胞系是一种常用于肿瘤研究的细胞系,采用人工体外培养方式可以无限繁殖。试验选取裸鼠为研究对象,裸鼠先天性胸腺依赖性免疫功能缺乏或T、B淋巴细胞功能完全丧失,异种移植不产生排斥反应,并且皮下注射肿瘤细胞系的基因将导致裸鼠成瘤[7]。本次试验通过HE染色法观察肿瘤形态学特征;免疫组织SP法化学染色检测血管内皮生长因子(VEGF)在肿瘤中的分布情况,为探究肿瘤形成机制提供参考依据。
1 材料与方法
1.1 实验动物
免疫功能缺陷小鼠:每组1 0只,雌性BALB/c裸小鼠4~7周大,购自北京维通利华实验动物技术有限公司。
1.2 试剂与仪器
试验材料:Hela细胞悬液,购自国家实验细胞资源共享服务平台;MDCK细胞,购自ATCC细胞库;VEGF多克隆抗体和免疫组织化学检测试剂盒(SP-0023),均购自北京博奥森生物技术有限公司;DAB浓缩型显色试剂盒(DA1010),购自北京索莱宝科技有限公司。
试验仪器:病理组织切片机和YD-AB2生物组织摊-烤片机,均购自金华市益迪医疗设备有限公司;电热鼓风干燥箱,购自天津市泰斯特仪器有限公司;显微镜拍照系统等。
1.3 方法
1.3.1样本采集 前期通过注射等量的不同细胞悬液构建裸鼠模型。
高成瘤MDCK细胞裸鼠模型:裸鼠肩胛部位皮下注射200 μl前期项目组经单细胞克隆实验,克隆出具有高度成瘤性的MDCK细胞悬液。
Hela细胞裸鼠模型:裸鼠肩胛部位皮下注射200 μl Hela细胞悬液。
饲养4个月后,颈椎脱臼法处死后采集其肿瘤等新鲜组织立即置于4%多聚甲醛中固定,长期室温保存,每隔12小时更换1次固定液。
1.3.2组织包埋 采集组织于4%多聚甲醛中固定1~2个月后,将肿瘤切至体积约1 cm3进行石蜡包埋。包埋好的组织蜡块低温储存。病理组织切片机切片,先进行厚度为20 μm的粗切,待观察组织完全暴露转为厚度为5 μm的细切。取细切的组织于组织摊-烤片机中,摊片(温度45 ℃),后烤片(温度45 ℃),待组织周围石蜡与载玻片紧密粘附无水滴(约2 h)即可收片于切片盒中储存。
1.3.3 HE染色 首先选取组织切片进行烤片45 ℃(15 min),其次依次进行脱蜡至水—苏木精核染(约2 min)—流水冲洗(10 min)—酸水分化(约2~3 s)—流水冲洗(10 min)—伊红染色(约4 min)—酒精分化—脱水—透明等一系列步骤,最后使用中性树脂封片,并观察。
1.3.4免疫组织SP法化学染色 组织切片经15 min4 5 ℃烤片,再依次进行脱蜡至水、抗原修复(柠檬酸盐缓冲液-微波热修复法)、阻断、滴加A液(封闭用正常山羊血清工作液)、滴加一抗、二抗、湿盒37 ℃孵育、滴加三抗(辣根酶标记链霉卵白素工作液)、孵育、DAB显色、苏木精复染等一系列操作,最后用中性树脂封片。其中,阻断液、A液、二抗、三抗工作液均来自免疫组化SP试剂盒;一抗为兔的多克隆抗体。
2 结果与分析
2.1 肿瘤的形态学观察
Hela细胞、高成瘤MDCK细胞裸鼠模型中,两种异源移植瘤的结构相同。选取Hela裸鼠模型中的肿瘤组织进行分析。HE染色后对肿瘤组织学结构观察,染色结果如图1所示。图1A观察到:裸鼠皮下注射部位形成的肿瘤呈现结节状,肿瘤边缘处细胞分布密集,成巢状,细胞体积较大,胞核大小不一。异源移植瘤中心位置可见坏死情况,大多为崩解碎裂的肿瘤细胞。图1B观察到,异源移植细胞形成的肿瘤周围组织中有较为丰富的血管分布。

图1 肿瘤HE染色结果观察
2.2 VEGF在肿瘤中的表达及分布情况
如图2所示,在异源移植细胞形成的肿瘤中,VEGF在肿瘤生长的周围组织中阳性表达显著,肿瘤边缘细胞次之,肿瘤中心位置的细胞阳性表达最弱。VEGF在肿瘤生长周围组织以及细胞胞质中表达,细胞核中不表达。注射高成瘤MDCK细胞形成的肿瘤中有淋巴滤泡样结构的肿瘤细胞灶(如图2D);通过图2C、图2D对比可知,VEGF在肿瘤生长的周围组织中含量:图2C>图2D,肿瘤中心部位VEGF在图2C上呈现强而少的分布,图2D上表达呈现弱而广的分布。VEGF分别在Hela细胞、高成瘤MDCK细胞裸鼠模型肿瘤中都存在表达,表达位置相同,但每个结构表达的含量存在差异。
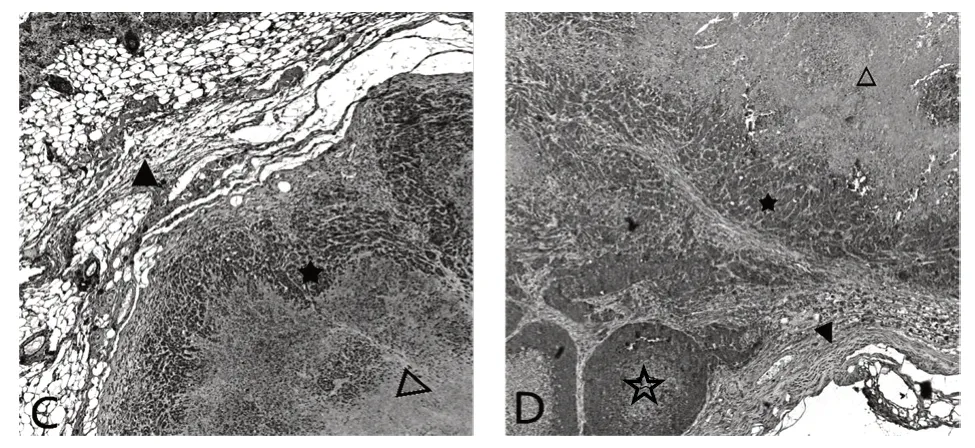
图2 VEGF蛋白免疫组化染色结果
3 讨论
VEGF具有促进血管生成,增强血管细胞壁通透性的功能[8],肿瘤微环境中VEGF含量的增加有利于肿瘤血管的形成。肿瘤形成后,由于肿瘤细胞周围没有新血管,氧气以及营养物质供给不足,此时肿瘤细胞需要通过扩散的方式获取营养,因而生长缓慢。当周围新血管生成后,肿瘤生长所需要的营养物质由血管供给,肿瘤细胞迅速生长繁殖[2]。肿瘤周围组织以及肿瘤边缘细胞处VEGF含量的增多,促进肿瘤血管生成,这也就说明了本次试验中发现VEGF在肿瘤周围近皮肤侧的组织以及肿瘤边缘均呈现阳性表达的原因。同时,在近皮肤侧的组织有血管分布,可能是肿瘤形成并已经进入迅速生长状态的重要标志,阻断肿瘤血管的生成可能是抑制肿瘤生长的途径之一。研究发现,大部分肿瘤细胞也可以分泌VEGF,加快血管内皮细胞增殖速度,为肿瘤细胞的生长提供物质基础,促进肿瘤进一步形成[9-10]。肿瘤的形成速率以及分化程度都会影响微环境中VEGF的水平[5],试验中也发现,高成瘤MDCK细胞裸鼠模型的肿瘤组织中有淋巴滤泡样结构的肿瘤细胞灶形成,肿瘤内部VEGF的分布广而弱;Hela细胞裸鼠模型中肿瘤内部的VEGF呈现强而少的分布状态。VEGF在皮下注射Hela细胞形成的肿瘤近皮肤侧的组织含量较高,且血管分布较多,说明皮下注射Hela细胞形成的肿瘤可能主要通过促进微环境中的VEGF以及内部肿瘤细胞分泌的VEGF含量增多来共同促进血管的生成,有利于肿瘤的生长。而注射高成瘤MDCK细胞形成的肿瘤则是通过肿瘤内部细胞分泌的VEGF含量增多以促进血管形成,同时更易形成肿瘤细胞灶,促进肿瘤细胞发生迁移。由此推测出,注射高成瘤MDCK细胞与注射Hela细胞可能具有同等强度的成瘤性,形成肿瘤的恶性程度可能相同,但肿瘤的形成机制可能不同。
4 结论
本实验通过研究VEGF在MDCK、Hela细胞裸鼠模型肿瘤中的分布情况,以及对肿瘤结构进行分析,发现裸鼠皮下注射部位形成的肿瘤呈现结节状,高成瘤MDCK细胞裸鼠模型的肿瘤组织中有淋巴滤泡样结构的肿瘤细胞灶形成,VEGF在肿瘤靠近皮肤侧的组织阳性表达显著,肿瘤边缘细胞次之,肿瘤中心位置的细胞阳性表达最弱。由此推测,高成瘤MDCK细胞与Hela细胞可能有相同的致瘤性,但两者成瘤机制可能不同。同时结合VEGF具有促进肿瘤细胞生成、侵袭、转移等生理学功能,说明该蛋白可能通过改变肿瘤微环境促进肿瘤血管生成,对肿瘤的形成具有一定促进作用,也为研究通过抑制肿瘤新血管的生成阻止肿瘤发生提供理论参考。

