HAL光动力治疗联合吡柔比星对膀胱癌细胞的杀伤作用及其机制的体外实验研究
罗婉茹 田军 章慧平 余洁 王璐瑶 庞义军
膀胱癌是泌尿系统最常见的恶性肿瘤,约70%为非肌层浸润性膀胱癌,其标准的治疗方式是经尿道膀胱肿瘤电切,再辅以膀胱灌注化疗药物或卡介苗,但膀胱癌治疗后的复发率仍达30%~70%[1]。有研究表明癌细胞可通过表达耐药蛋白、增强抗凋亡能力、利用炎症反应促进肿瘤再生、DNA修复等机制,对治疗产生耐药抵抗,从而引起肿瘤复发[2]。膀胱癌辅助治疗的应用已超过半个世纪,一直没有突破性的进展,膀胱癌术后复发成为非肌层浸润性膀胱癌治疗的一个难点。
有研究显示光动力治疗(photodynamic therapy, PDT)的细胞毒效应可破坏癌细胞的耐药蛋白、线粒体、DNA等,能与化疗、放疗、靶向治疗等产生协同抗肿瘤作用[3]。相关临床研究也显示,PDT联合化疗用于胆管癌[4]、肺癌[5]和食管癌[6]患者的治疗,可提高疗效且患者耐受良好,是一种有前景的肿瘤治疗策略。体外研究发现化疗药物和PDT联合能提高对膀胱癌细胞的杀伤作用[7],但其作用机制尚不明确。本研究旨在验证六氨基乙酰丙酸(hexaminolevulinate, HAL)介导的PDT联合吡柔比星(pirarubicin, THP)在体外对膀胱癌细胞杀伤的协同效应,并初步阐明其作用机制,为临床治疗提供新的思路。
材料与方法
一、实验材料
膀胱癌细胞株T24细胞由华中科技大学同济医学院附属同济医院泌尿外科赠予;膀胱癌细胞株RT4细胞、T24细胞完全培养液和RT4细胞完全培养液购自武汉普诺赛生物科技有限公司;THP购自Sigma-Aldrich公司;HAL由广东精观生物医药科技有限公司赠予;光动力治疗仪(60 W)由苏州精观医疗科技有限公司赠予;CCK-8试剂购自大连美仑生物科技有限公司;酶标仪购自深圳雷杜生命科学股份有限公司;Hoechst/PI双染试剂盒购自Biosharp公司;倒置荧光显微镜购自Olympus公司;Bcl-2、Bax基因引物购自上海生物工程有限公司;逆转录试剂盒购自Takara公司;2×Tap Mix试剂盒购自康为世纪生物科技有限公司;普通梯度PCR仪购自Thermo公司;实时荧光定量PCR仪购自Roche公司;兔抗P-gp抗体购自美国Abcam公司;鼠抗GAPDH抗体购自武汉博士德生物工程有限公司;BCA蛋白定量试剂盒购自碧云天生物技术公司;SDS-PAGE凝胶配制试剂盒购自武汉谷歌生物公司;WB电泳设备、化学发光凝胶成像系统购自BIO-RAD公司;ECL显色剂购自康为世纪生物有限公司。
二、RT4和T24细胞培养及实验分组
将膀胱癌细胞株RT4和T24细胞用其完全培养液培养,置于5% CO2、37 ℃恒温培养箱中培养。观察细胞状态并换液,当细胞生长至80%~90%时予以传代。传代培养3次后取对数生长期的细胞用于实验,各实验均将RT4和T24细胞分为空白对照组(Control组)、PDT组、THP组、PDT+THP组。
三、细胞增殖实验
采用CCK-8法检测细胞增殖情况。取对数生长的RT4和T24细胞,接种于96孔板,密度为5×103个细胞/孔,细胞生长至70%时,进行后续的药物处理,每组设置4个复孔。Control组:加入完全培养液培养24 h,CCK-8法测定细胞毒性。PDT组:两种细胞加入相同浓度的HAL(0、6.250、12.500、25.000、50.000 μg/ml),37 ℃条件下避光孵育4 h,PBS清洗3次,将光动力治疗仪光纤固定于铁架台上,垂直照射培养板形成直径为10 cm的光斑,给予450 nm波长蓝光照射处理10 min,继续避光培养24 h后加入10% CCK-8(100 μl/孔),于37 ℃条件下避光孵育1 h,使用酶标仪检测450 nm处吸光度值。THP组:两种细胞加入不同浓度的THP(RT4:0、0.250、0.500、1.000、2.000 μg/ml;T24:0、0.625、1.250、2.500、5.000 μg/ml),24 h后用PBS清洗3次,同上以CCK-8法测定细胞毒性。根据实验结果,确定用于以下PDT与THP联合治疗时的HAL的浓度和光照时间。PDT+THP组:两种细胞均加入浓度为12.500 μg/ml的HAL,37 ℃条件下避光孵育4 h,PBS清洗3次,给予光照处理10 min后,RT4细胞加入浓度为0.500 μg/ml的THP,T24细胞加入浓度为1.250 μg/ml的THP,24 h后PBS清洗3次,同上以CCK-8法测定细胞毒性。用GraphPad Prism 8.0绘制细胞生长曲线。
四、Hoechst/PI双染法检测细胞凋亡
取对数生长的RT4和T24细胞,接种于96孔板,密度为5×103个细胞/孔,细胞生长至70%时,Control组:加入完全培养液培养24 h;PDT组:两种细胞均加入浓度为12.500 μg/ml的HAL,37 ℃条件下避光孵育4 h,PBS清洗3次,给予光照处理10 min后孵育24 h;THP组:RT4和T24细胞分别加入浓度为0.500 μg/ml和1.250 μg/ml的THP孵育24 h;PDT+THP组:两种细胞均加入浓度为12.500 μg/ml的HAL,37 ℃条件下避光孵育4 h,PBS清洗3次,给予光照处理10 min后,RT4和T24细胞分别加入浓度为0.500 μg/ml和1.250 μg/ml的THP孵育24 h。处理完后,均加入PBS清洗3次。每孔加入5 μl Hoechst染色液和5 μl PI染色液,混匀,4 ℃孵育20 min。染色后用PBS清洗1次,在荧光显微镜下观察,正常细胞为弱红色荧光+弱蓝色荧光,凋亡细胞为弱红色荧光+强蓝色荧光,坏死细胞为强红色荧光+强蓝色荧光。
五、Western blot检测P-gp蛋白表达
取对数生长的T24和RT4细胞,接种于6孔板,细胞生长至70%时,Control组:加入完全培养液培养12 h;PDT组:两种细胞均加入浓度为12.500 μg/ml的HAL,37 ℃条件下避光孵育4 h,PBS清洗3次,给予光照处理10 min后孵育12 h;THP组:RT4和T24细胞分别加入浓度为0.500 μg/ml和1.250 μg/ml的THP孵育12 h;PDT+THP组:两种细胞均加入浓度为12.500 μg/ml的HAL,37 ℃条件下避光孵育4 h,PBS清洗3次,给予光照处理10 min后,RT4和T24细胞分别加入浓度为0.500 μg/ml和1.250 μg/ml的THP孵育12 h。收集各组处理后的RT4和T24细胞,PBS洗涤,加入100 μl细胞裂解液,冰上裂解30 min,15 000 rpm、4 ℃离心20 min,弃沉淀,上清液即为细胞总蛋白。采用BCA法测定蛋白浓度。配置10% SDS-PAGE凝胶,恒压(上层胶90 V、30 min,下层胶120 V、60 min)电泳,恒流(300 mA、120 min)转膜,用含5%脱脂牛奶的TBST封闭2 h及一抗4 ℃孵育过夜、二抗室温孵育2 h、ECL液显影及成像拍照。
六、RT-qPCR检测Bcl-2、Bax基因表达
取对数生长期的RT4和T24细胞,接种于6孔细胞培养板中,待细胞基本贴壁后,Control组:加入完全培养液培养24 h;PDT组:两种细胞均加入浓度为12.500 μg/ml的HAL,37 ℃条件下避光孵育4 h,PBS清洗3次,给予光照处理10 min后孵育24 h;THP组:RT4和T24细胞分别加入浓度为0.500 μg/ml和1.250 μg/ml的THP孵育24 h;PDT+THP组:两种细胞均加入浓度为12.500 μg/ml的HAL,37 ℃条件下避光孵育4 h,PBS清洗3次,给予光照处理10 min后,RT4和T24细胞分别加入浓度为0.500 μg/ml和1.250 μg/ml的THP孵育24 h。每组设置3个平行样本。用Trizol提取细胞总RNA,参照逆转录试剂盒将RNA逆转录为cDNA;以所得cDNA为模板,制备RT-qPCR反应体系,内参为GAPDH(表1);按照2×Tap Mix试剂盒说明书操作测得CT值,采用2-ΔΔCT法计算Bax、Bcl-2相对表达量。

表1 Bax、Bcl-2及相应内参GAPDH的引物序列
七、统计学方法
使用SPSS 25.0软件进行统计分析,实验结果以均数±标准差表示,组间差异采用方差分析进行比较,P<0.05为差异有统计学意义。
结 果
一、PDT+THP组抑制RT4和T24细胞增殖
各组细胞处理后,采用CCK-8法检测细胞增殖情况。RT4细胞选择THP浓度为0.500 μg/ml用于联合治疗,该剂量下RT4细胞存活率为(60.09±3.55)%(P<0.05)(图1A);T24细胞选择THP浓度为1.250 μg/ml用于联合治疗,该剂量下T24细胞存活率为(64.42±8.73)%(P<0.05)(图1B)。两种细胞均选择HAL浓度为12.500 μg/ml用于联合治疗,该剂量下RT4细胞存活率为(52.38±2.39)%(P<0.01)(图2A),T24细胞存活率为(65.79±6.33)%(P<0.05)(图2B)。实验结果显示,PDT+THP组能够协同抑制RT4和T24细胞的增殖,此时细胞存活率分别为(17.72±4.23)%、(27.52±6.46)%,与PDT组、THP组相比,差异均有统计学意义(均P<0.01)(图3)。
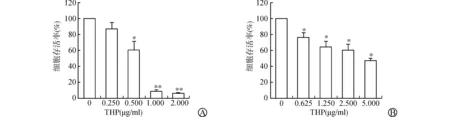
A:不同浓度THP对RT4细胞增殖的影响;B:不同浓度THP对T24细胞增殖的影响(与0 μg/ml THP组比较 *P<0.05,**P<0.01)
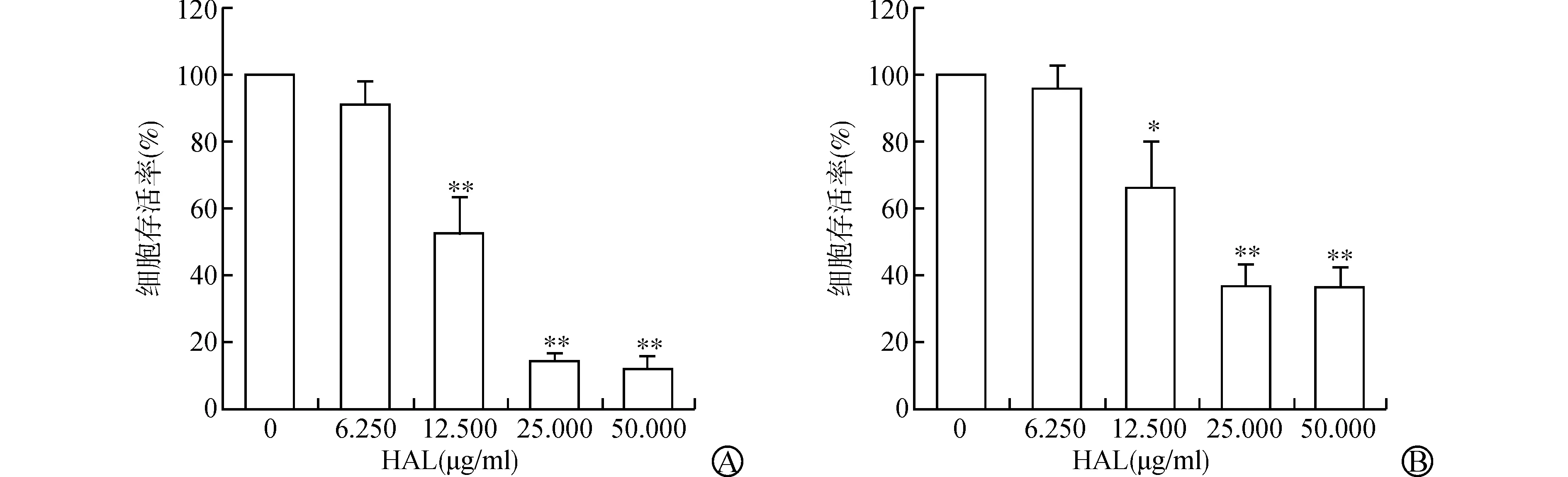
A:不同浓度HAL介导的PDT对RT4细胞增殖的影响;B:不同浓度HAL介导的PDT对T24细胞增殖的影响(与0 μg/ml HAL组比较 *P<0.05,**P<0.01)
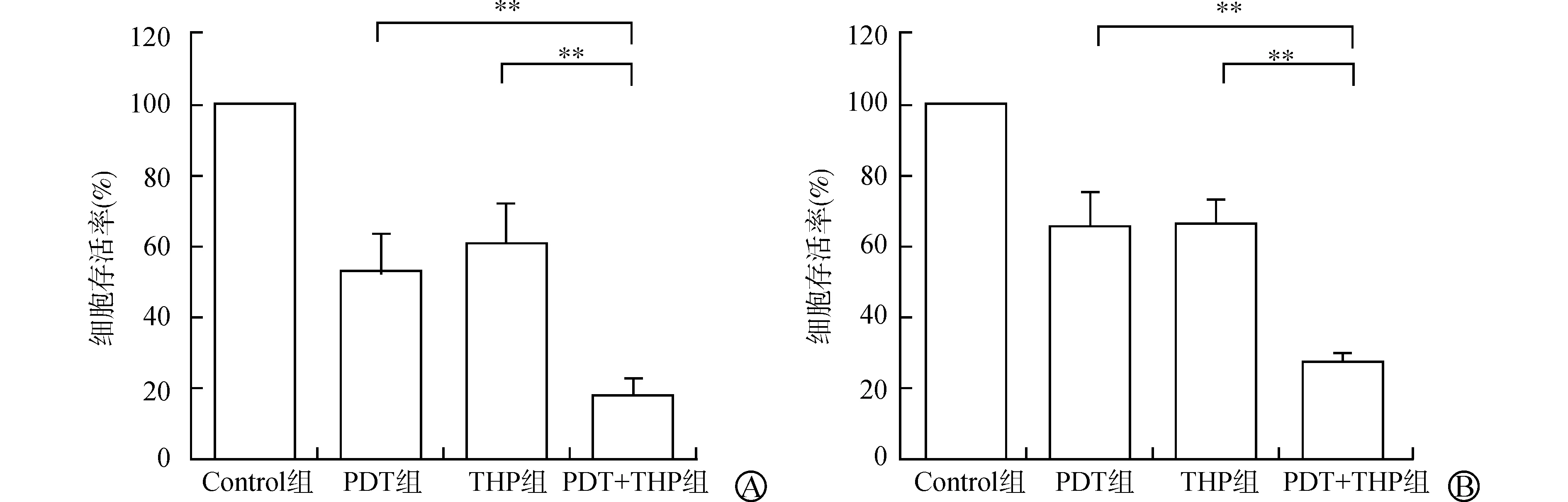
A:各组对RT4细胞增殖的影响;B:各组对T24细胞增殖的影响(与PDT组、THP组比较 **P<0.01)
二、PDT+THP组促进RT4和T24细胞凋亡
采用Hoechst/PI双染法检测细胞凋亡情况。结果显示,RT4细胞和T24细胞PDT+THP组PI标记红色荧光数量均多于PDT组和THP组,表明PDT+THP能够协同促进细胞凋亡(图4)。
三、PDT+THP组抑制P-gp蛋白的表达
Western blot检测结果显示,在RT4和T24细胞中,与Control组、PDT组和THP组相比,PDT+THP组显著下调P-gp蛋白的表达,表明PDT+THP能够协同抑制膀胱癌细胞P-gp蛋白的表达(图5)。
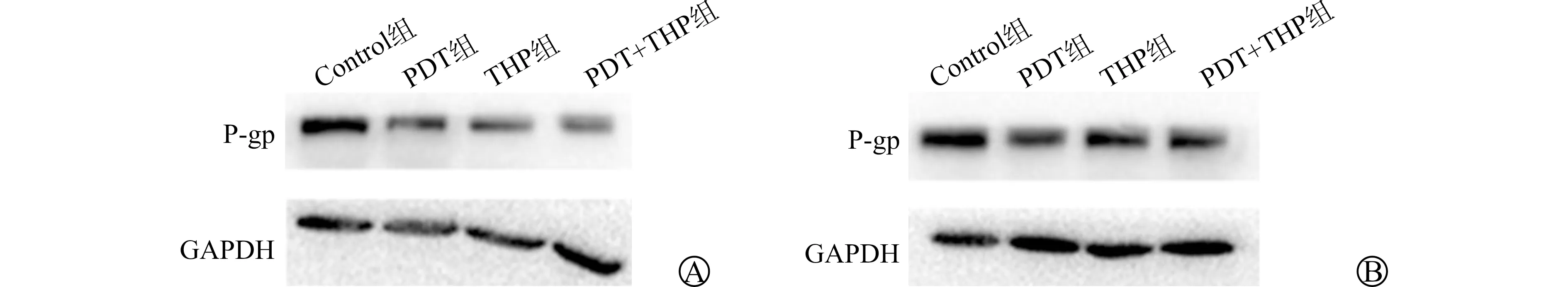
A:各组对RT4细胞中P-gp蛋白表达的影响;B:各组对T24细胞中P-gp蛋白表达的影响
四、PDT+THP组对RT4和T24细胞Bcl-2、Bax基因表达的影响
RT-qPCR检测结果显示,在RT4和T24细胞中,PDT+THP组能够协同降低Bcl-2基因的表达、增加Bax基因的表达,与PDT组、THP组相比,差异均有统计学意义(均P<0.01)(图6、7)。
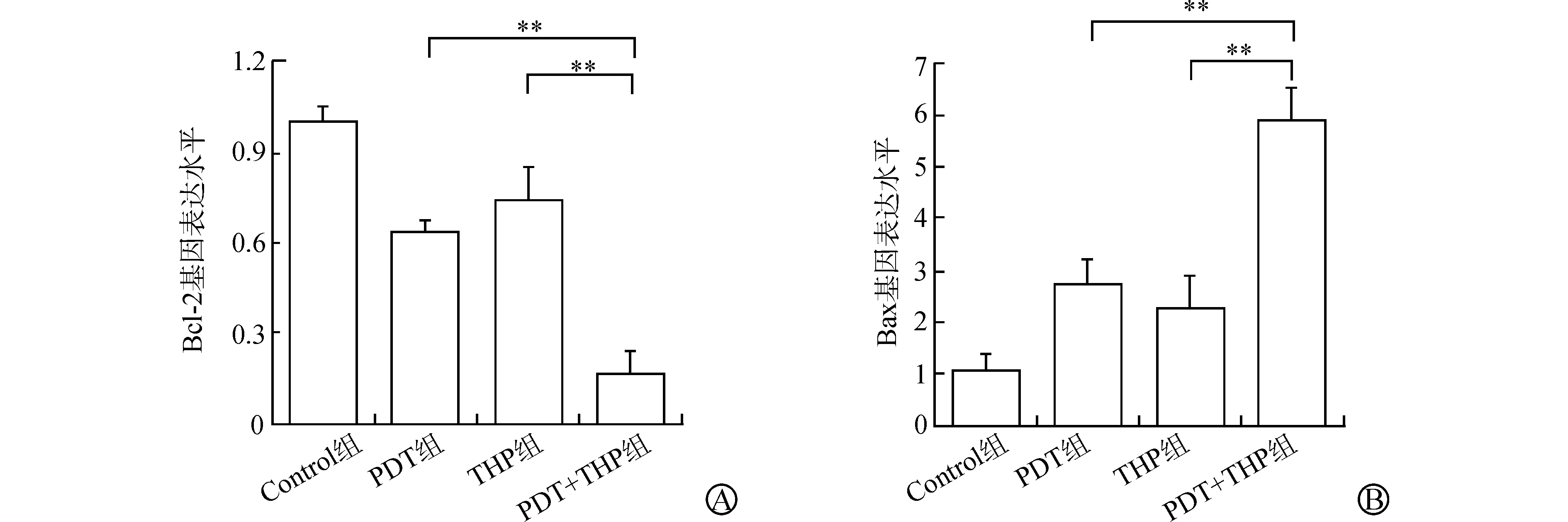
A:各组对T24细胞中Bcl-2基因表达的影响;B:各组对T24细胞中Bax基因表达的影响(与PDT组、THP组比较 **P<0.01)
讨 论
膀胱癌经电切后辅以膀胱灌注化疗,化疗的同时会出现多药耐药(multidrug resistance, MDR)现象。MDR的机制主要包括:①药物外排转运蛋白表达增加;②肿瘤微环境变化与癌症干细胞调控;③表观遗传改变和microRNA调节基因表达;④药物靶点改变;⑤细胞凋亡易感性降低;⑥DNA损伤修复能力增强[8]。PDT利用光敏剂在肿瘤组织中的选择性富集,通过激光触发光敏剂产生单态氧等活性氧分子,氧化损伤周边的细胞器和生物分子,造成肿瘤细胞坏死、凋亡、自噬、铁死亡,并诱发免疫反应进而杀伤肿瘤细胞,在膀胱癌治疗中,能与化疗[9]、放疗[10]和免疫治疗[11]产生协同抗肿瘤作用。
P-gp是药物外排蛋白中的一种,其表达水平与细胞膜的通透性、细胞内药物浓度及耐药程度有关[12]。P-gp可将细胞内的毒性代谢产物泵出细胞,对组织细胞起保护作用,同样P-gp亦可通过三磷酸腺苷(adenosine triphosphate, ATP)提供的能量将已进入细胞内的药物从胞内泵出胞外,从而降低细胞内抗癌药物的浓度,使细胞毒性作用减弱或完全消失,使癌细胞产生耐药现象。有研究表明,PDT联合化疗能特异性降低药物外排蛋白的表达从而产生协同抗肿瘤作用[13-14]。Khdair等[15]以亚甲基蓝为光敏剂介导的PDT抑制了P-gp导致的抗癌药物的外排作用,从而增加了阿霉素在卵巢癌细胞中的细胞毒性。Huang等[16]的研究结果显示,以苯并卟啉衍生物为光敏剂介导的PDT增加了前列腺癌细胞内伊立替康的浓度,其机制为PDT降低了ATP结合盒转运体G2的表达,激活了细胞凋亡信号通路。Arentsen等[17]的研究表明,以二磺化四苯氯为光敏剂的PDT联合博莱霉素在体内可诱导协同抑制T24和AY-27膀胱癌细胞株生长,结果显示PDT联合博莱霉素治疗效果显著高于单一处理的治疗效果。这些研究均说明PDT在增强药物治疗和逆转耐药中的作用。本研究发现PDT联合THP能使膀胱癌细胞P-gp表达降低,说明联合治疗可通过下调药物外排泵P-gp的表达,改善药物的耐药性,使癌细胞对药物的敏感性增加,从而增强药物的毒性作用。
Bcl-2和Bax在肿瘤细胞凋亡中具有重要的调控作用。Bax/Bcl-2比值越高细胞越易凋亡,相反Bax/Bcl-2比值低则细胞抗凋亡能力增强。P-gp作为MDR1基因的表达产物,除了具有药物外排泵的功能外还可能存在抗凋亡作用,过表达的P-gp可通过抑制Bax/Bcl-2比值的升高及半胱氨酸天冬氨酸蛋白酶3和9的活性,直接抑制细胞凋亡;也可以通过活化PI3K通路,间接抑制细胞凋亡[18]。Xu等[19]的研究表明,P-gp抑制剂维拉帕米类似物能够促进耐阿霉素的白血病细胞凋亡。本研究发现,与PDT组和THP组相比,PDT+THP组能够协同降低P-gp蛋白的表达,下调Bcl-2基因的表达、上调Bax基因的表达,表明PDT联合化疗能够改善药物耐药性,增加膀胱癌细胞凋亡易感性。
此外,一项体外研究显示,在小鼠的肝癌细胞中,先用PDT处理后再用阿霉素处理与先用阿霉素处理再用PDT处理比较,其对肿瘤细胞的增殖抑制率提高了20%,其原因主要是由于阿霉素产生的细胞毒性作用使细胞对光敏剂的摄取减少[20]。因此本研究采用先用PDT处理再用THP处理的方式进行实验。
综上所述,本研究发现HAL介导的PDT联合THP对RT4和T24细胞具有协同杀伤作用,其机制可能与联合治疗后膀胱癌细胞的P-gp下调、Bcl-2基因表达下调以及Bax基因表达上调,从而降低了癌细胞的耐药性和促进了癌细胞的凋亡有关。本研究未能在动物实验中进一步证明PDT联合THP具有协同杀伤膀胱癌细胞的作用,这部分内容有待于今后进一步完善。

