辅助性和调节性T淋巴细胞亚群与过敏性紫癜患儿疾病严重程度的关系
张丽丽,林慧晶,吴明赴,季正华,李晓忠
(1.扬州大学附属医院,江苏 扬州 225000;2.苏州大学附属儿童医院,江苏 苏州 215003)
过敏性紫癜(henoch-schonlein purpura,HSP)是一种免疫性血管炎疾病,儿童期最常见[1-2];全年可发病,且春季多发,男多于女[3]。HSP以皮肤或黏膜下出血、皮肤紫癜(鲜红或紫红色)为主要临床特征,双下肢和臀部最多见,部分同时存在腹痛、便血、肾损害症状及荨麻疹等多系统疾病[4-5]。HSP属于良性疾病,具有自限性,病情一般6~8周逐渐缓解,大多数患儿预后良好;但该病易反复发作,机体易受免疫应答及炎性反应损伤而累及肾脏,严重者甚至会发生急性肾功能衰竭[6]。
HSP发病机制复杂且尚未明确。相关研究表明,外周血T淋巴细胞亚群在其中发挥了重要作用[7],其为临床早期治疗HSP患儿提供了依据。既往研究大多是关于HSP严重程度与辅助性T淋巴细胞(helper T lymphocytes,Th)变化的关系,尚未见与调节性T淋巴细胞(regulatory T lymphocytes,Treg)变化的相关研究。本研究对150例HSP患儿的一般资料和实验室指标进行了数据分析,以进一步明确Th和Treg的变化与HSP严重程度的关系,为早期干预治疗提供理论参考,从而避免和减缓病情的发展,改善患儿的预后。
1 研究对象与方法
1.1 研究对象
选择2018年1月至2021年1月苏州大学附属儿童医院收治的150例HSP患儿为研究对象,其中男87例,女63例;年龄为5~14岁,平均(9.50±1.40)岁;皮肤型56例,腹型35例,关节型17例,肾型24例,混合型18例。根据HSP症状积分[8]将患儿分为轻度组(<33分,50例)、中度组(33~67分,56例)、重度组(>67分,44例)。另选择同期于门诊进行体检的150例健康儿童为对照组,其中男89例,女61例;年龄为5~14岁,平均(9.33±1.74)岁。
纳入标准:①符合HSP诊断标准[9];②初次发病;③近2周内未使用过激素及其他免疫抑制剂治疗。排除标准:①合并严重感染性疾病;②合并其他免疫系统性疾病;③合并心、肝、肺等重要脏器功能障碍。
本研究经苏州大学附属儿童医院伦理委员会审批(批准号:20201112),患儿家属均签署知情同意书。
1.2 研究方法
1.2.1 资料的收集
收集患儿的年龄、性别、体质量指数(body mass index,BMI)、HSP类型、过敏原类型、首发症状、皮肤紫癜持续时间、HSP症状积分等临床资料。
1.2.2 实验室指标的测定
清晨空腹状态下取肘静脉血3mL,离心,血清保存于-80℃冰箱待检。①采用全自动血液分析仪(Sysmex CS-5100)检测外周血白细胞计数(white blood cell count,WBC)、C-反应蛋白(C-reactive protein,CRP)及D-二聚体(D-Dimer,D-D)水平;采用日立7600-010生化分析仪检测血肌酐(serum creatinine,SCr)水平。②采用酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)双抗体夹心法检测样本血清中白细胞介素-21(interleukin-21,IL-21)、转化生长因子β1(transforming growth factor β1,TGF-β1)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)水平。③利用免疫比浊法(仪器ADVIA2400,西门子公司)测定血清中免疫球蛋白A(immunoglobulin A,IgA)、免疫球蛋白G(immunoglobulin G,IgG)、免疫球蛋白M(immunoglobulin M,IgM)水平。④采用流式细胞仪(BD公司,美国)分析样本T淋巴细胞亚群,分别取CD3-PC5、D8-PE、CD4-PE、CD19-Percp、CD11b-PE、CD5-APC鼠抗人单克隆抗体(BD公司,美国)各10μL,加入肝素抗凝血50μL,混匀后室温暗处放置20min,分别加入红细胞裂解液混匀,在流式细胞仪上计数5×104以上细胞,分别记录Th(CD3+CD4+)、Treg(CD4+CD25+)的阳性率。
1.3 统计学方法
2 结果
2.1 各组儿童的临床资料
轻度组、中度组、重度组、对照组儿童的年龄、性别、BMI比较差异均无统计学意义(P>0.05),具有可比性,见表1。
表1 各组儿童临床资料的比较
2.2 不同病情程度HSP患儿的临床症状
轻度组、中度组、重度组患儿皮肤紫癜持续时间>28d的比例比较差异有统计学意义(P<0.05),随着HSP病情的加重,患儿皮肤紫癜持续时间>28d的比例有所增高;不同病情程度患儿HSP类型、过敏原类型(吸入性和食入性)及首发症状的比例比较差异均无统计学意义(P>0.05),见表2。
2.3 各组儿童的实验室指标
轻度组、中度组、重度组、对照组儿童的WBC、CRP、D-D、IgA、CD3+CD4+、CD4+CD25+、IL-21、TGF-β1及TNF-α水平比较差异均有统计学意义(P<0.05),随着HSP病情的加重,WBC、CRP、D-D、IgA、TGF-β1及TNF-α水平均有所升高,而CD3+CD4+、CD4+CD25+及IL-21水平均有所降低,组间两两比较差异均有统计学意义(P<0.05);轻度组、中度组、重度组、对照组儿童的SCr、IgG、IgM水平比较差异均无统计学意义(P>0.05);组间两两比较差异均有统计学意义(P<0.05),见表3。

表3 各组儿童实验室指标的比较
2.4 曲线拟合及阈值效应分析
在调整年龄、性别、BMI后,经曲线拟合发现,随着CD3+CD4+和CD4+CD25+水平的升高,HSP症状积分呈下降趋势,见图1。在曲线拟合的基础上,进一步进行阈值效应分析发现,当CD3+CD4+>37.3%时,随着CD3+CD4+水平升高,HSP症状积分未受影响,其OR=1.000(95%CI:0.991~1.015,P=0.368),当CD3+CD4+<37.3%时,随着CD3+CD4+水平升高,HSP症状积分呈下降趋势,其OR=0.962(95%CI:0.947~0.977,P<0.001);当CD4+CD25+>10.2%时,随着CD4+CD25+水平升高,HSP症状积分未受影响,其OR=1.000(95%CI:0.998~1.003,P=0.347),当CD4+CD25+<10.2%时,随着CD4+CD25+水平升高,HSP症状积分呈下降趋势,其OR=0.976(95%CI:0.953~0.998,P<0.001)。
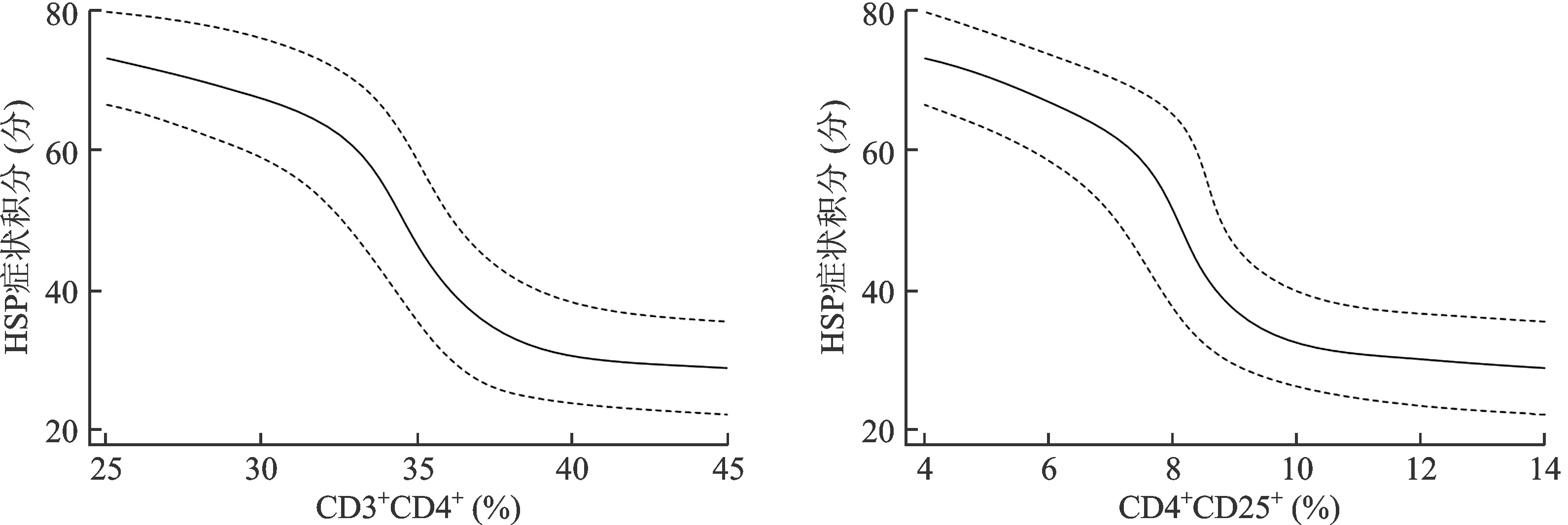
图1 CD3+CD4+、CD4+CD25+与HSP症状积分的曲线拟合分析
2.5 影响HSP加重的多因素Logistic回归分析
以前述分析中(表1~表3)差异具有统计学意义(P<0.05)的各项指标为自变量,以重度HSP为因变量,纳入LASSO模型进行分析,最佳λ值通过交叉验证法选择,折叠10次。以λ的对数值为下方横坐标,以进入模型的非零系数变量的个数为上方横坐标,以标准误为纵坐标,然后利用标准误最小的λ值筛选用于构建LASSO回归模型的因素,见图2A;自变量系数随λ值变化,λ值越大,模型压缩程度越大,进入模型的自变量个数越少,模型的选择功能越强,见图2B。本研究选择λ值为0.009时性能最优且纳入变量最少,此时纳入的变量包括CRP、D-D、IgA、CD3+CD4+、CD4+CD25+、IL-21、TGF-β1及TNF-α。

注:A图为LASSO模型中最佳λ值的判定使用10折交叉验证和最小准则;B图为患儿临床特征的LASSO模型系数曲线。
以LASSO模型分析中筛选出的8个非零特征预测因子为自变量,以重度HSP为因变量,进行多因素Logistic回归分析,结果显示,CRP>12.4mg/L、D-D>3.4mg/L、IgA>2.3g/L、TGF-β1≥6.5pg/mL及TNF-α≥14.5pg/mL均为发生重度HSP的独立危险因素(P<0.05);CD3+CD4+≥32%、CD4+CD25+≥7%及IL-21≥23.1pg/mL均为独立保护因素(P<0.05),见表4、表5。

表4 多因素Logistic回归分析赋值表
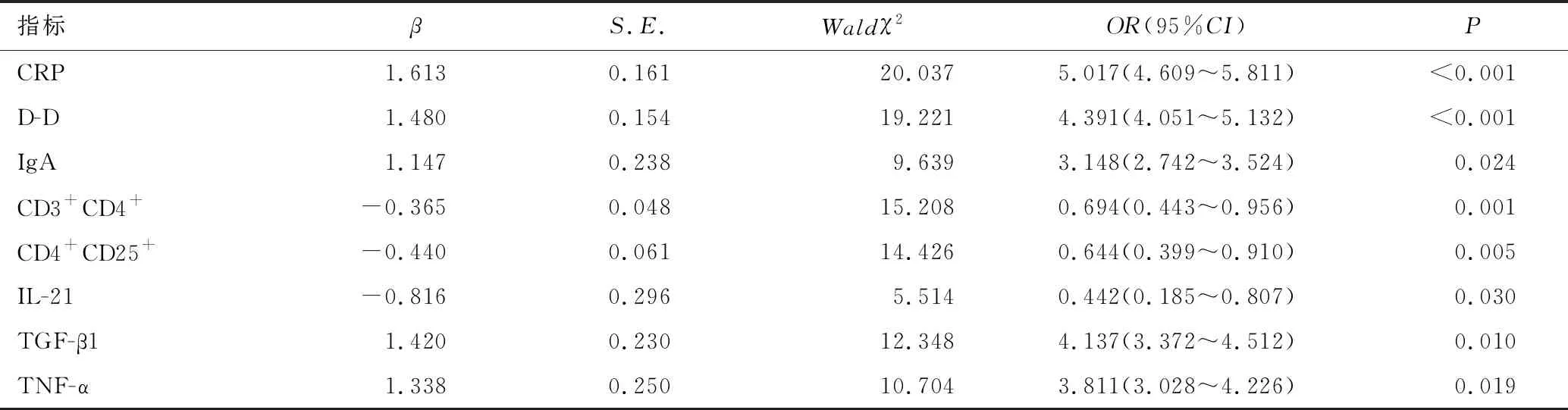
表5 多因素Logistic回归分析
2.6 BP神经网络模型的构建
将前述影响发生重度HSP的独立危险因素作为输入层纳入BP神经网络模型,采用反复交叉验证确定隐含层节点数,当隐含层节点数为4时,交叉验证的均方根误差最小,见图3;以HSP严重程度作为输出层,构建BP神经网络模型,见图4。对BP神经网络模型变量重要性评分进行排序,其中CRP(0.160分)、D-D(0.154分)、CD3+CD4+(0.135分)、CD4+CD25+(0.130分)对模型分类的贡献度较高,IgA(0.100分)、IL-21(0.096分)、TGF-β1(0.114分)、TNF-α(0.111分)也能在一定程度上影响模型的分类结果。

图3 交叉验证确定隐含层节点数

图4 BP神经网络模型
2.7 BP神经网络模型的评价
2.7.1 模型区分度的评价
采用Bootstrap自抽样法进行内部验证,结果显示,该预测模型C-index为0.801(95%CI:0.714~0.888),ROC曲线下面积为0.820(95%CI:0.731~0.909),P<0.05,表明该预测模型的区分度尚可,见图5。

图5 BP神经网络模型的ROC曲线
2.7.2 模型校准度的评价
绘制预测模型的校准曲线,结果显示,模型预测重度HSP发生概率与实际概率拟合度良好,Hosmer-Lemeshow拟合优度检验结果差异无统计学意义(P>0.05),表明该预测模型的准确度较高,见图6。
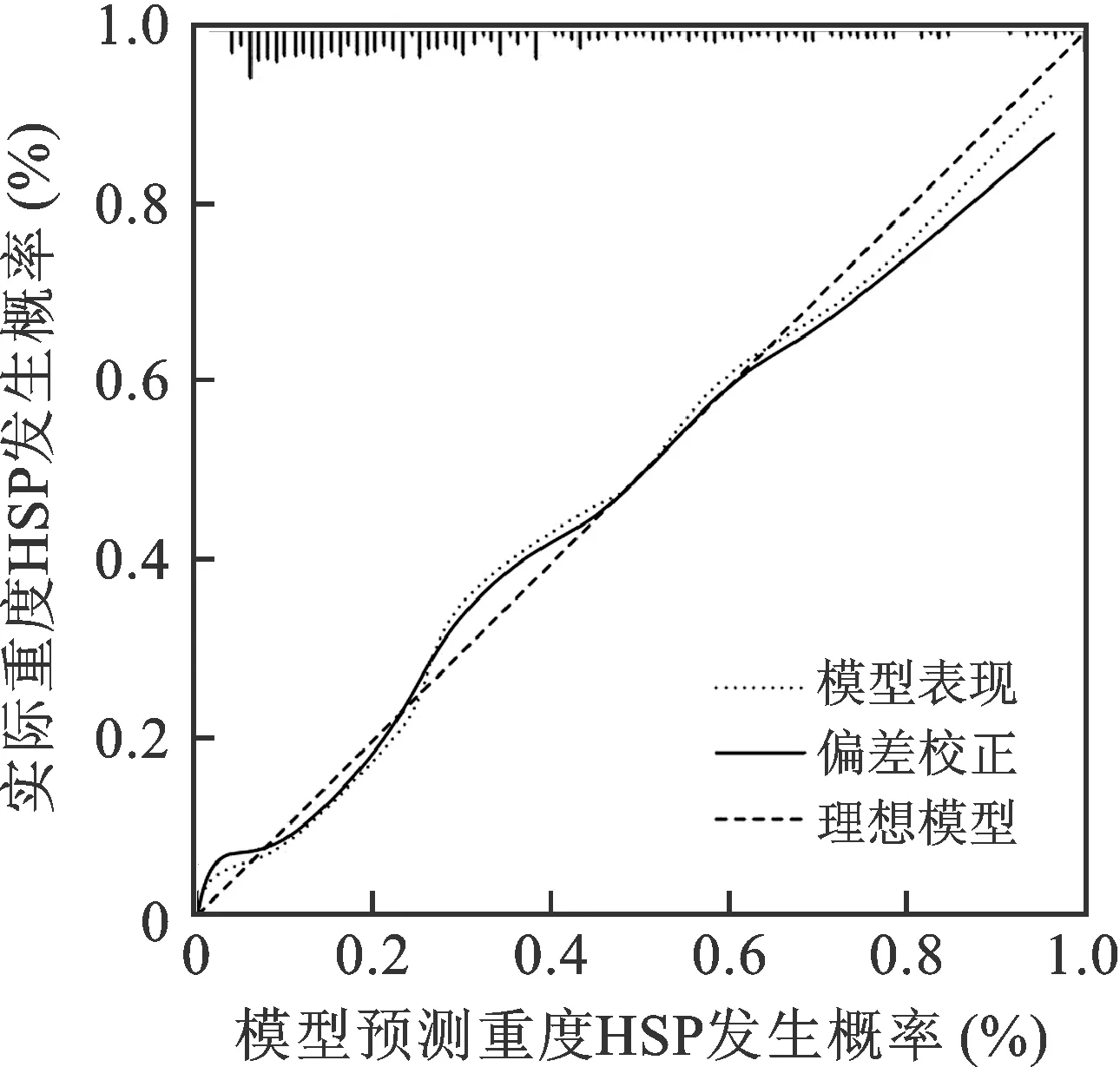
图6 BP神经网络模型的校准曲线
2.7.3 模型有效性的评价
预测模型的DCA曲线阈值概率为0.01~0.92,净获益率>0,表明其有效性较好,安全可靠,实用性强,见图7。
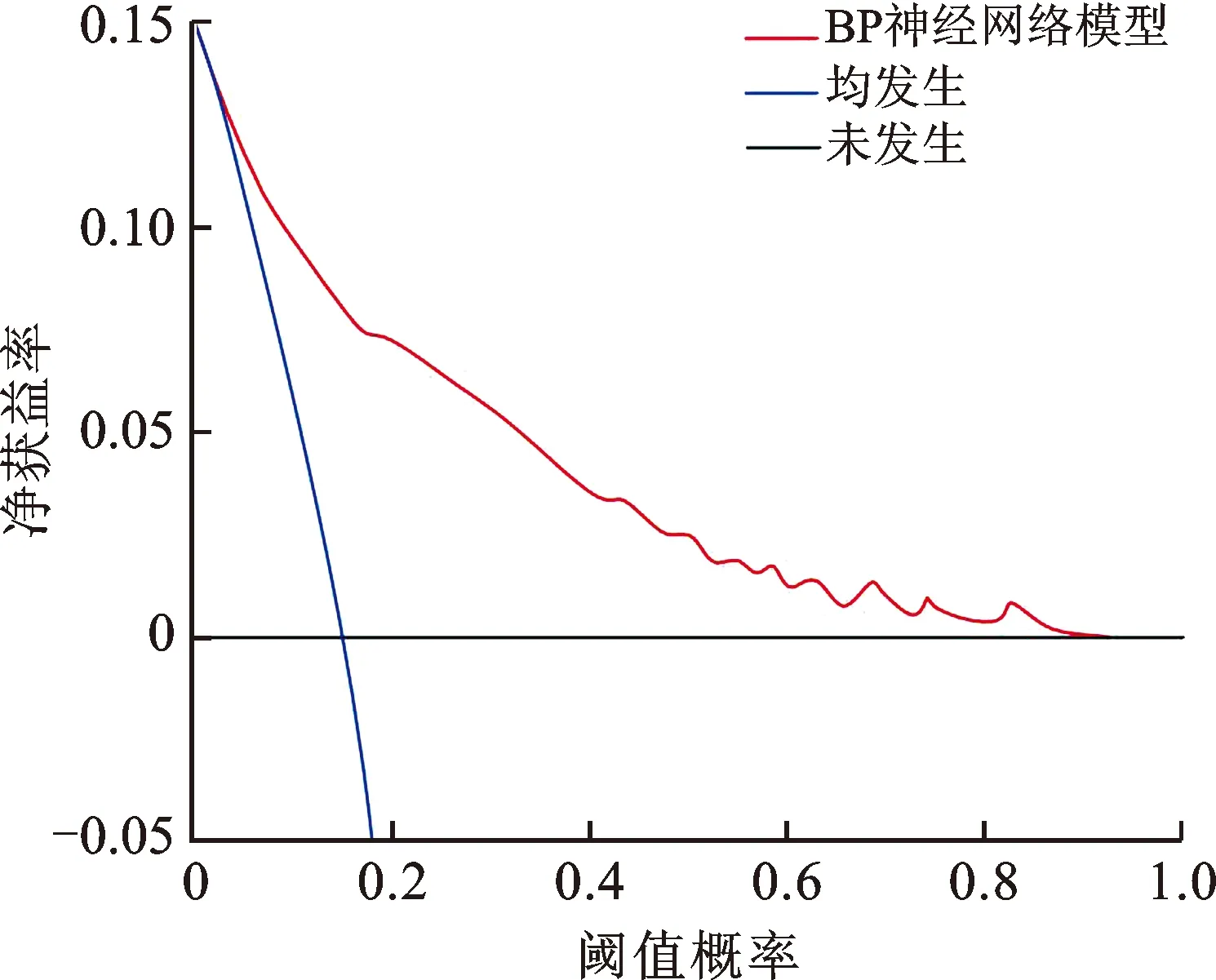
图7 BP神经网络模型的DCA曲线
3 讨论
HSP发病呈全球性,不同区域和种族存在差异,学龄期高发,6~10岁的儿童约占90%[10-11]。近年来,HSP发病率逐年上升,首发症状一般为皮肤紫癜,严重的可引起各系统并发症[12]。目前,临床大多依靠患儿的临床症状和体征进行诊疗,以及判断疾病的活动性,尚缺乏明确性的实验室诊断指标。因此,对于不典型症状者,易因误诊而延误病情。随着研究的深入,大多数学者认为HSP发病涉及T淋巴细胞亚群、细胞因子、凝血机制和炎性因子异常等情况,但主要发病机制仍是免疫应答介导的血管炎[13-14]。
3.1 HSP患儿的机体免疫和体液功能分析
相关研究表明,HSP发病与人类白细胞抗原和家庭性地中海基因密切相关,带有上述基因的儿童,一旦受到致病因子侵袭,便会造成呼吸及黏膜系统损伤,激活T淋巴细胞亚群,进一步导致机体免疫和体液功能发生紊乱[15]。T淋巴细胞是机体免疫的核心部分,在抗原物质刺激下,可引起T淋巴细胞亚群失衡加重、免疫功能紊乱及组织炎性因子分泌失衡,产生相应抗体,使得血清中免疫球蛋白水平升高[16]。本研究显示,随着HSP患儿病情加重,IgA、TGF-β1、TNF-α水平均升高,IL-21水平降低,表明HSP病情加重,机体细胞和体液免疫系统紊乱。抗原进入黏膜,激发黏膜免疫系统产生免疫反应,从而使IgA增多。血清中清除IgA的可能机制为,肝细胞表面的脱唾液酸糖蛋白受体特异性识别并结合半乳糖基可清除IgA分子,而其低糖基化使得脱唾液酸糖蛋白受体减少,导致IgA增加。免疫系统紊乱使得组织炎性介质分泌失控,TNF-α为促炎性因子,参与发病过程,可能是HSP病理损伤的重要因素之一;TGF-β1为抑炎性因子,发挥免疫调节作用,二者相互制约和调节;而IL-21水平下降,表明T淋巴细胞分泌IL-21受到抑制,但IL-21分泌不足的机制有待进一步研究。
3.2 HSP患儿的CD3+CD4+和CD4+CD25+水平分析
相关研究表明,HSP的发病主要是由机体免疫功能紊乱所导致,在发病初期,患者存在显著的免疫失衡[17]。高婧等[8]研究表明,随着HSP病情加重,CD3+CD4+水平下降。本研究显示,随着HSP病情加重,CD3+CD4+、CD4+CD25+水平均降低,Th(CD3+CD4+)通过释放细胞辅助因子促进效应T细胞活化,进而促使体液及细胞免疫作用调节或增强机体免疫功能,其减少表明患儿此刻机体免疫功能降低;Treg(CD4+CD25+)具有免疫抑制和调节的功能,是机体维持自身免疫耐受的重要组成部分,其减少会导致免疫抑制效应不足,这可能是HSP发病初期机体免疫失衡的重要原因。
3.3 HSP患儿的凝血功能和炎性因子水平分析
本研究显示,D-D和CRP也是影响患儿病情程度的重要因素。D-D是凝血功能异常的重要指标,可表明是否存在血栓的形成,对HSP病情的评估具有十分重要的意义。CRP是一种急性时相蛋白,与急性感染、组织损伤、心血管疾病等密切相关;在发病急性期,血清中CRP水平迅速上升,病情缓解时,其水平又迅速下降,因此其常作为一种疾病活动时筛查指标。本研究表明,随着HSP病情加重,D-D、CRP水平均升高。刘钧菲等[18]研究显示,D-D水平越高,HSP病情越重;其表明HSP患儿的血浆D-D水平与疾病发展密切相关,提示在临床治疗时,医护人员应密切监测患儿的D-D水平,以判断病情的进展情况。HSP属毛细血管变态反应性疾病,炎症常累及其他器官,如关节、肾脏等。当HSP病情加重,免疫功能失衡,肝细胞产生CRP且大量释放进入血液,促进炎性因子TNF-α分泌,加强机体免疫功能。
基于多因素分析结果,本研究构建了BP神经网络模型,当隐含层节点数为4时,误差最小,其中CRP(0.160分)、D-D(0.154分)、CD3+CD4+(0.135分)、CD4+CD25+(0.130分)对模型分类的贡献度较高。ROC曲线、校准曲线和DCA曲线显示,该预测模型的区分度及准确性和有效性均较高。
3.4 本研究的局限性
本研究为回顾性分析,具有一定的局限性,纳入病历数目较少。但随着医疗技术的发展,相信有针对性的前瞻性、大样本量研究可为临床治疗HSP提供更高级别的医学证据。
综上所述,CD3+CD4+、CD4+CD25+水平异常变化与HSP症状积分密切相关,随着患儿HSP病情进展,CD3+CD4+、CD4+CD25+水平明显降低;CRP>12.4mg/L、D-D>3.4mg/L、IgA>2.3g/L、TGF-β1≥6.5pg/mL及TNF-α≥14.5pg/mL均为发生重度HSP的独立危险因素,CD3+CD4+≥32%、CD4+CD25+≥7%及IL-21≥23.1pg/mL均为独立保护因素。临床医护人员应密切关注相关指标,对HSP患儿做到早发现、早诊治,改善其预后。

