借助等效平衡模型的构建研究定性分析和定量分析的应用
姚秀成
(云南师范大学附属怒江州民族中学,云南怒江 673200)
通过对相关课程的学习,学生能运用勒夏特列原理判断化学平衡的移动方向,能比较转化率、产率、百分含量等。但勒夏特列原理只适用于定性分析,往往只适合改变某一个条件,若多个条件同时发生改变,从定量的角度分析更加准确。等效平衡是化学平衡的拓展,学生在高考中运用等效平衡的思想解决问题更加快速准确,但等效平衡又是学生很难理解的一个内容。笔者将从定性和定量的角度分析等效平衡,从而使学生体会到定性分析和定量分析的应用。
一、从定量的角度引出等效平衡的概念
例1:在一定温度下,分别在两个容积均为1L的密闭容器中,按下列物质的量向容器中投料,发生如下反应:。已知容器A平衡时,H2的平衡转化率为20%,试分析:两个容器达到平衡时,A、B容器中各物质的物质的量为多少?各物质的物质的量分数为多少?

解:对于A容器,平衡时,H2的平衡转化率为20%,所以△c(H2)=1mol/L,20%=0.2mol/L。
三行式如下:

对于B容器,设转化的H2的物质的量浓度为xmol/L,三行式如下:


由于温度相同,

经计算得出,A、B两容器中,H2(g)的物质的量均为0.8mol,物质的量分数为40%;I2(g)的物质的量均为0.8mol,物质的量分数为40%;2HI(g)的物质的量均为0.4mol,物质的量分数为20%。两平衡等效,由此引出等效平衡的定义。在一定条件(恒温恒容或恒温恒压)下,同一可逆反应体系无论是从正反应开始,还是从逆反应开始,或是正逆反应同时开始,只要起始投料“相当”,达到化学平衡状态时,任何相同组分的百分含量(体积分数、物质的量分数)均相同,这样的化学平衡称为等效平衡。
例2:在恒温恒容的密闭容器中,按下列五种情况进行投料,是否等效?

上述五种不同投料情况,按极值转化的思想全部转化为SO2(g)和O2(g),得到如下情况:

由此发现,按照极值转化的思想,①②③三种情况相当于投料相同,一定等效。④起始投料与前三种情况对比,SO2(g)的物质的量相同,但O2(g)的物质的量不同,相当于增大了O2(g)的浓度。根据勒夏特列原理,平衡向着正反应方向移动,④达到的平衡与前三种不等效。⑤的起始投料与前三种情况的起始投料比相同,这时是否等效,需要我们在后面进行讨论。
二、从定性和定量的角度分析恒温恒容条件下的等效平衡的条件
(一)恒温恒容条件下,对于反应前后气体体积不变的可逆反应
例3:将例1中A容器改为2molH2(g),2molI2(g)投料,重新计算各物质的物质的量为多少?各物质的物质的量分数为多少?
经计算,H2(g)的物质的量均为1.6mol,物质的量分数为40%;I2(g)的物质的量均为1.6mol,物质的量分数为40%;HI(g)的物质的量均为0.8mol,物质的量分数为20%。与A容器中的平衡等效。
由此得出:恒温恒容条件下,对于反应前后气体体积不变的可逆反应,要求极值等比投料才可以使平衡等效。
(二)恒温恒容条件下,对于反应前后气体体积变化的可逆反应
例4:恒温恒容(1L)的密闭容器C、D中,按下列物质的量向两容器中投料,发生反应:2SO2(g)+O2(g)。

分析:C、D两容器所达到的平衡是否等效?
1.定量角度
方法1:设C容器达到平衡时,SO2转化的物质的量为2xmol,D容器达到平衡时,SO2转化的物质的量为4ymol。

根据温度相同,K1=K2,
C、D两容器不等效。达到平衡时,D容器中SO2(g)、O2(g)的百分含量比C容器小,SO3(g)的百分含量比C容器大。
方法2:设C容器达到平衡时,SO2的物质的量浓度为amol/L,O2的物质的量浓度为bmol/l,SO3的物质的量浓度为cmol/L,则。
若D容器与C容器等效,则容器D达到平衡时,SO2的物质的量浓度为2amol/L,O2的物质的量浓度为2bmol/l,SO3的物质的量浓度为2cmol/L,此时,。当温度相同时,K3=K4,而此时K3>K4,不相等,说明容器D达平衡时,各物质的量浓度不是上述假设结果。为了使K3=K4,D容器中SO2(g)、O2(g)的浓度要比假设结果小,SO3(g)的浓度要比假设结果大,才能满足K值相等。
由此得出:C、D两容器不等效。
2.定性角度
我们将D容器的体积扩大为原来的两倍后,可以得到E容器(图略)。因为C、E两容器中各物质的浓度相等,所以C、E两容器等效。由E容器到D容器,相当于压强增大,平衡要向正反应方向移动。在平衡时,D容器中SO2(g)、O2(g)的百分含量比C容器小,SO3(g)的百分含量比C容器大。
由此得出:恒温恒容条件下,对于反应前后气体体积变化的可逆反应,要求极值等量投料才可以使平衡等效。
三、从定性和定量的角度分析恒温恒压条件下的等效平衡的条件
(一)恒温恒压条件下,对于反应前后气体体积变化的可逆反应
例5:将例3中的恒温恒容改为恒温恒压的密闭容器中,发生反应:2SO2(g)+O2(g)2SO3(g),按下图所示方式投料,

分析:F、G两容器所达到的平衡是否等效?
1.定量角度
在恒温恒压条件下,设F容器中达到化学平衡时,SO2(g)转化的物质的量为2xmol,G容器中达到化学平衡时,SO2(g)转化的物质的量为4ymol
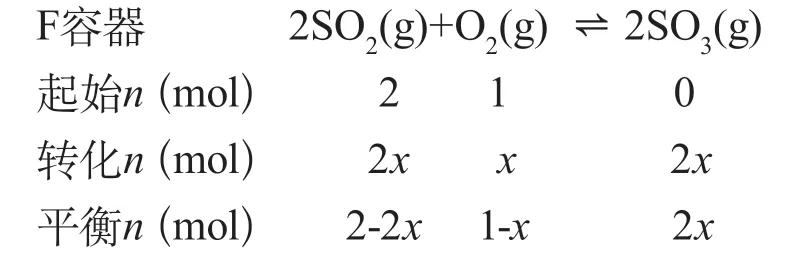
假设F容器达到平衡时的体积为VL

根据PV=nRT,可知在相同的温度和压强下,体积之比等于物质的量之比,G容器达到平衡时的体积为,所以K6=。
根据K5=K6,x=y,可知两平衡等效。达到平衡时,G容器中SO2(g)、O2(g)、SO3(g)的百分含量与F容器相同。
2.定性角度
F、G两容器中各物质的物质的量浓度相同,压强相同,类似于G容器中有两个F容器同时建立平衡,所以F、G两容器等效。
(二)恒温恒压条件下,对于反应前后气体体积不变的可逆反应
例6:在两个相同温度和压强的密闭容器(H、I)中,分别充入1molH2(g)、1molI2(g)和2molH2(g),2molI2(g)发生如下反应:H2(g)+I2(g)2HI(g),分析H、I是否等效?
1.定量角度
解:由于该反应为气体体积不变的反应,设H容器的体积为VL,H2转化的物质的量为xmol,则I容器的体积为2VL,H2转化的物质的量为2ymol
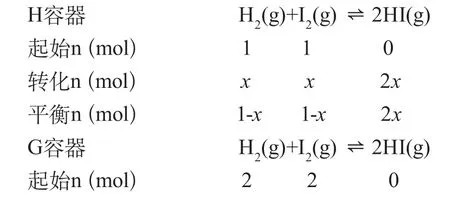

根据K值相等,得出x=y。达到平衡时,H2(g)、I2(g)、2HI(g)百分含量相同,两平衡等效。
2.定性角度
H、I两容器中,各物质的物质的量浓度相同,压强相同,类似于H容器中有两个I容器同时建立平衡,所以H、I两容器等效。
由此得出:恒温恒压条件下,不管反应前后气体体积是否改变,要求极值等比投料才可以使平衡等效。
四、等效平衡的应用
(一)适用于特殊下转化率、产率、百分含量等的判断
例7:在恒温恒容的密闭容器中发生如下反应。
1.PCl5(g)PCl3(g)+Cl2(g)
达到平衡后再充入PCl5(g),平衡向________ 方向移动,达到平衡后,PCl5(g)(g)的转化率________ ,PCl5(g)的百分含量________ 。
答案:正反应 减小 增大。
达到平衡后再充入HI(g),平衡向________ 方向移动,达到平衡后,HI的分解率________ ,HI的百分含量________ 。
答案:正反应 不变 不变。
3.2NO2(g)N2O4(g)
达到平衡后再充入NO2(g),平衡向________ 方向移动,达到平衡后,NO2(g)的转化率________ ,NO2(g)的百分含量________ 。
答案:正反应 增大 减小。
在以上几种情况中,根据勒夏特列原理,增大反应物的浓度,平衡均向正向移动,正向移动的结果是反应物的转化的物质的量增大,但起始的物质的量也增大。根据转化率=×100%,由于分子、分母均增大,所以不能直接判断转化率的大小,但从等效平衡的角度可以快速、准确地对转化率、产率、百分含量等作出判断。
(二)应用等效平衡思想模型降低解题难度,减少计算量
例8:在5L恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)C(g)+D(g),所得实验数据如表1所示。

表1 实验数据
求a、b的值?

根据K=1,求得a=0.06。
③方法一:按照② 的方法进行计算,求得a=0.03。
方法二:应用等效模型可以发现②③等效,直接得出a=0.03。
分析:等效平衡是一种思维分析方式和解题方法,等效平衡使化学平衡试题的解题策略和方法研究更加科学,让学生的学习和做题更加高效[1]。
五、结束语
笔者从定性和定量的角度研究了等效平衡及其应用,定性分析和定量分析不仅适用于等效平衡的构建,而且适用于化学平衡的其他应用以及水溶液中的离子平衡,如稀释问题、化学反应速率大小的判断等。从定性的角度分析化学试题有直观、方便的特点,但有些反应涉及多种因素的变化。当定性分析结果不一致时,教师从定量的角度进行分析更容易让学生接受。

