获得性血友病A的诊疗新进展
徐圆(Xu Yuan),薛峰(Xue Feng)*,杨仁池(Yang Renchi)
1.中国医学科学院血液病医院(中国医学科学院血液学研究所),实验血液学国家重点实验室,国家血液系统疾病临床医学研究中心,细胞生态海河实验室,天津市血液病基因治疗研究重点实验室,中国医学科学院血液病基因治疗重点实验室,天津 300020;
2.天津医学健康研究院,天津 301600;
获得性血友病A(acquired hemophilia A,AHA)是一种获得性出血性疾病,由针对自身凝血因子Ⅷ(coagulation factor Ⅷ,FⅧ)的自身抗体导致的。AHA 主要临床表现是急性出血,高达69.5%的患者可出现致命或有致残风险的严重出血[1]。治疗成功的关键在于及时诊断、及早给予恰当的治疗、及时控制出血及清除抗体[2]。近年来,国内外有多项注册研究结果发表,为AHA 的诊疗提供了新的证据,本文主要就AHA 临床诊断路径及止血治疗的研究进展进行总结,为今后的临床实践提供证据参考。
1 AHA发病率与流行病学特点
AHA年发病率为每百万人1.5例[3],可发生于男女各年龄段,发病率随着年龄的增长而增加,16岁以下儿童中约为0.045/百万,85 岁以上人群中约为14.7/百万[4]。欧洲获得性血友病登记处(European Acquired Hemophilia Registry,EACH2)的结果显示,AHA 诊断时的中位年龄为73.9 岁,在20 ~40 岁的年龄范围内女性居多,在老年组中男性居多[5]。中国获得性血友病登记(China Acquired Hemophilia Registry,CARE)研究结果显示我国AHA 诊断时的中位年龄为52岁[5],中位年龄较国外研究中报道的年轻,这可能与我国年轻患者较老年患者更容易被转诊进行进一步诊治有关。AHA 死亡率很高,在目前登记的数据中死亡率从6.7%~38.2%不等[3,5-6],早期报道死亡率高达42%,近年来下降至不超过12%,中国CARE研究结果显示死亡率为6.7%,出血、继发于免疫抑制治疗(immunosuppressive therapy,IST)的严重感染以及基础疾病等是主要的死亡原因。
2 AHA临床表现、实验室检查及诊断
2.1 临床表现
既往无出血史、无出血性疾病家族史的患者近期出现急性自发性出血,部分患者出血发生在侵入性检查或手术后。最常见出血部位是皮下(80%),肌肉出血次之(约40%)[7],皮下血肿可以是AHA的首发表现[8],少数患者可无出血表现。在产后患者中,软组织、肌肉和阴道出血是常见临床表现[7]。FⅧ抗体可经胎盘转移,导致新生儿出血[9]。出血的危害程度取决于出血部位和出血量。
2.2 实验室检查
2021版中国AHA 诊疗指南推荐对于疑似AHA的患者通过活化的部分凝血活酶时间(activated partial thromboplastin time,APTT)混合血浆纠正实验进行抑制物筛查,并完善FⅧ活性(factor Ⅷcoagulant activity,FⅧ:C)检测及抑制物定量来确定诊断。明确了APTT 延长的定义:超过当天本实验室正常对照值10 s 以上,或超过本实验室正常参考范围上限[2]。
2.2.1 APTT 混合血浆纠正试验 因为APTT 纠正试验缺乏统一标准,不能单独用于确诊或排除AHA[10],所以为了尽快确诊,需同时进行FⅧ抑制物定量、FⅧ∶C和狼疮抗凝物(lupus anticoagulant,LA)检测。
2.2.2 FⅧ∶C 检测 FⅧ∶C 在健康人群中为50 ~150 IU/dL,若FⅧ∶C 低于50%提示可能为AHA。同时,需要与获得性血管性血友病综合征、血管性血友病和遗传性血友病A相鉴别。极低的FⅧ:C水平(<1%)与较低的缓解率、较晚实现缓解及较差的总生存率相关[11-13]。另外,FⅧ:C 水平与出血风险无明显相关性,即使是水平稍高的患者也可能发生严重出血[14]。
2.2.3 抑制物定量 测定抑制物滴度是AHA 的确诊方法。常用的检测方法为Nijmegen 改良法及Bethesda 法。阳性结果为抑制物滴度≥0.6 BU/mL。Nijmegen 方法是Bethesda 法基础上的改良方法,在抑制物滴度较低时(<1 BU/mL),可以增加特异性及敏感性。检测前采用热灭活法灭活血浆中FⅧ,可增加检测准确性和敏感性。
2.3 诊断
AHA 具有罕见、突发及出血异质性大的特点,出现以下情况时需要考虑AHA的可能:①既往凝血功能正常的患者,尤其是老年人及产后患者,检测发现无其他原因解释的孤立性APTT 延长,并且在有创操作或外伤后发生较预期更多的出血、或出现自发性出血;②术前检查发现孤立性APTT延长,并且无其他原因可以解释。一些患者没有出血表现,而APTT延长可能是AHA的唯一迹象[8]。
由于AHA发病的罕见性及突然性,患者首诊科室往往不是血液科[8],缺乏对AHA 的认知导致无法及时诊断和治疗[14]。EACH2登记显示1/3的患者存在明显的诊断延迟,22%的患者在首次出血后1 个月诊断AHA,11.1%的患者诊断时间超过1 个月。CARE 研究显示我国AHA 患者从出血到明确诊断的中位时间为30 d,46.5%的患者没有及时诊断。延迟诊断超过1个月与出血时间延长和更高的止血因子需求相关[15],对止血治疗时间和免疫抑制治疗效果有显著影响[5]。
因此,为了提高临床医生对疾病的认识、利于早期诊断和治疗,改善患者预后,2021 版中国AHA 诊疗指南建立了适合我国的诊断路径[2,8]。与2020 版国际AHA诊疗建议诊断路径对比(图1):国际AHA诊疗建议在高度怀疑AHA 之后以是否有出血作为鉴别,无出血的患者进一步完善LA 检测和发色底物法检测FⅧ∶C;确认FⅧ缺乏和有出血的患者转诊至血液科、通过Bethesda 法或ELISA 检测FⅧ抗体。若使用重组猪序列抗血友病因子(recombinant porcine FⅧ,rpFⅧ)止血时,检测抗rpFⅧ抗体。国内指南在怀疑AHA 时通常进一步检测LA,以LA结果进行鉴别,LA 结果异常者则通过发色底物法或多稀释度检测FⅧ∶C,确认FⅧ缺乏及LA 结果正常患者转诊血液科,通过Bethesda 法及Nijmegen 改良法确定FⅧ抗体滴度,这些差异原因与国内采用发色底物法检测FⅧ∶C 开展较少和未开展ELISA方法检测rpFⅧ抗体有关。
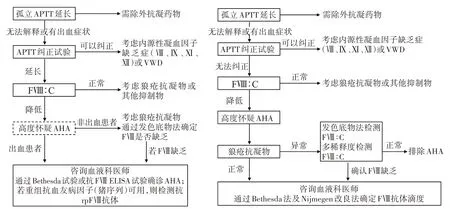
图1 2020年AHA国际诊疗建议诊断路径与2021版AHA诊疗中国指南诊断路径对比
3 治疗
治疗的基本原则:治疗原发病及去除诱因,及时治疗出血和预防复发,为了尽快清除FⅧ抑制物应尽早启动免疫抑制治疗。
3.1 治疗原发病及去除诱因
大约一半的AHA患者伴有基础疾病,最常见的是其他自身免疫性疾病和恶性肿瘤[1,16],大约1%~5%的病例中,AHA 是在怀孕期间或分娩后1 年内确诊的[17]。中国CARE 研究中,5.98%合并有恶性肿瘤,其中73%为实体肿瘤;12%合并有自身免疫性疾病,包括类风湿性关节炎、自身免疫性溶血性贫血、免疫性血小板减少症等;22.5%与妊娠相关。最近,多个国家有关于接种COVID-19 疫苗后被诊断AHA 的病例报道[18-22]。但是,现有研究不支持COVID-19 疫苗与AHA 发病率增加相关,需进行大规模多数据库研究,疫苗接种的益处仍然大于风险[23-24]。积极处理原发病及诱发因素,在反复复发或一线及二线治疗均无效时,需继续查找潜在病因并处理。
3.2 止血治疗
3.2.1 止血治疗的原则 为了预防严重出血的发生,确诊后应立即采取治疗措施。避免有创操作和手术等,如必须进行,应在有治疗经验的医院或专家指导下应用旁路途径药物预防性止血治疗后完成操作。止血药物治疗首要目标是控制患者急性出血,同时需警惕血栓形成的风险,AHA 出血患者的伴随疾病和出血时的行动受限是血栓形成的危险因素[8]。国外指南推荐止血治疗一线用药为旁路途经药物和rpFⅧ,rpFⅧ未在国内上市,国内指南推荐旁路途经药物rFⅦa 为止血治疗的一线治疗药物[8]。
3.2.2 旁路途经止血药物 旁路途经药物包括活化凝血酶原复合物(activated prothrombin complex concentrate,APCC)和活化人凝血因子Ⅶ(recombinant activated FⅦ,rFⅦa),rFⅦa、APCC 用法见表1。由于APCC 未在国内上市,使用凝血酶原复合物(prothrombin complex concentrate,PCC)替代APCC。
①rFⅦa:国内指南中推荐rFⅦa 作为止血一线治疗,CARE 研究中[5],rFⅦa 主要作为二线或三线挽救性治疗,在对PCC 初始治疗无反应的患者、初始FⅧ制剂治疗失败的患者、对挽救性PCC 治疗无效的患者中使用rFⅦa 治疗,出血均获得缓解。中位止血时间为5 h,明显优于PCC(72 h)和FⅧ制剂(250 h)。一项回顾性分析数据显示,rFⅦa 总有效率为97%,作为一线治疗时(86.6%)的止血疗效高于作为二线治疗(66.7%),并且用于二线治疗时的较低疗效和剂量增加可能使出血更严重,更难以控制,这项研究提示rFⅦa 更适用于一线治疗[25]。一项荟萃分析评估了rFⅦa 用于止血治疗时的不良反应,12项研究中2项报道了严重不良反应,发生率为2.9%和4.5%;其中8 项报道了血栓栓塞和心血管事件,发生率为0~2.9%[26]。
②PCC:CARE 研究中使用PCC 作为一线治疗AHA 时的有效率为84.6%,在初始FⅧ制剂治疗失败的患者中PCC 作为挽救治疗时的有效率为78.3%[5]。2021 中国AHA 诊疗指南建议当无法使用rFⅦa 时,可使用PCC 止血,剂量一般不超过150 IU·kg-1·d-1,分次使用。
③旁路途径药物联合应用:两种旁路药物序贯或联合使用时,血栓事件的发生率有所增加[27]。因此,国内指南建议在患者出现难以控制的出血且rFⅦa或PCC 效果均不佳,或由于药物可及性或经济原因无法持续应用rFⅦa 时,在权衡血栓风险并发症风险后,可谨慎考虑选择序贯应用rFⅦa及PCC[2]。
3.2.3 rpFⅧ 由于旁路途径药物治疗期间无法通过实验室检查进行监测,并且存在血栓风险,国外的一线治疗选择中还有rpFⅧ[7],用法见表1。在一项单臂多中心前瞻性研究中[28],100%的患者在使用rpFⅧ24 h 内出现阳性治疗反应,rpFⅧ用于一线治疗时有效率为94%,与作为二线治疗时(73%)相比有更高的治疗成功率,85.7%的患者最终获得完全缓解,未出现血栓事件、血小板减少及过敏反应,未发生治疗相关的严重不良反应。rpFⅧ与旁路途径药物的一个重要区别是能够通过监测FⅧ:C 水平,调整治疗剂量,从而允许针对患者给予个体化的治疗。同时避免FⅧ:C 过度升高导致血栓形成风险增加[29]。一项回顾性分析显示,在伴有心血管疾病的严重出血患者中,由于血栓风险增加,减少APCC和rFⅦa 的初始剂量被证明是无效的,在这些患者中使用推荐剂量或低于推荐剂量的rpFⅧ治疗均有效,且未增加血栓风险,有效性和安全性良好[30]。
3.2.4 FⅧ浓缩剂和1-去氨基-8-D-精氨酸加压素(1-desamino-8-D-arginine-vasopressin,DDAVP) 急性出血时FⅧ制剂和DDAVP通常效果不佳或无效,尤其对于高抑制物滴度(>5 BU/mL)的患者,即使使用大剂量FⅧ制剂也难以有效[14]。国外指南建议DDAVP 可考虑用于低抑制物滴度(<5 BU)时的轻微出血发作[7]。2021版中国指南建议仅在患者为低滴度抑制物且无法获得旁路途径药物时或其疗效不佳时使用大剂量FⅧ止血,如疗效不佳,及时更换其他止血药物。在无其他选择且出血轻微时,DDAVP需在谨慎评估后使用。
3.2.5 抗纤溶及其他药物 抗纤溶药物可作为出血的辅助治疗,泌尿系出血患者不建议使用,常用药物有氨甲环酸、氨基己酸等。由于抗纤溶药物与PCC 同时应用时血栓风险增加,应避免联合用药,如必须同时使用建议间隔6 h 以上。APCC 与抗纤溶药物联合使用时未增加血栓风险[32]。
艾美赛珠单抗是一种重组人源化、双特异性单克隆抗体,由于血药浓度达峰需要数周,只能用于预防出血,不能用于治疗急性出血。日本一项前瞻性、多中心、开放标签的Ⅲ期临床研究评价了艾美赛珠单抗在AHA 患者中的疗效、安全性和药代动力学,在应用艾美赛珠单抗之前58.3%的患者发生了严重出血,在治疗期间,所有患者均未出现严重出血,未发生出血或严重感染所致死亡或任何研究相关的严重不良事件,没有实验室检查显示有高凝倾向[33]。此外,还有两项正在进行的评估艾美赛珠单抗预防AHA 患者出血疗效的临床试验[34-35]。Engelen MM等[36]回顾性分析7名成人AHA患者使用艾美赛珠单抗止血治疗,有效并且未出现新的出血。但目前缺乏大规模临床使用数据评估其有效性及安全性。
3.2.6 止血疗效评估 综合评估患者的主诉、症状和体征、红细胞压积、血红蛋白水平及影像学改变。在急性出血发作期间,应在短时间(6 ~12 h)内评估出血部位和严重程度[14]。治疗效果和恶化情况的指标因出血部位的不同而存在差异,在评估是否止血或治疗是否无效的观察间隔上也存在差异。有研究建议止血治疗完全缓解定义为“在使用止血药物治疗2天后没有再出血”[37]。
3.3 抑制物清除
3.3.1 一般原则 所有患者在确诊后应立即采取IST 以清除FⅧ抑制物,恢复FⅧ:C 水平,因为在抑制物被清除之前,患者仍然有出血的风险。但是,一些研究显示高达37%的患者出现了IST相关副反应,如白细胞减少、严重感染和脓毒血症、血小板减少、糖皮质激素诱导的糖尿病和精神疾病,死亡率高达16%[1,38-39],其中,严重感染是AHA 患者死亡的重要原因。如何获取快速清除抑制物减少出血和治疗相关副反应风险之间的平衡至关重要[6]。
3.3.2 一线治疗 一线治疗方法包括糖皮质激素单药(S)、糖皮质激素+环磷酰胺(S/C)、糖皮质激素+利妥昔单抗(S/R)[2]。有研究显示:高抑制物滴度、严重出血和糖皮质激素单药治疗与较低的缓解率独立相关,糖皮质激素单药治疗的完全缓解率(complete response,CR)显著低于糖皮质激素联合治疗,但联合治疗的感染率和感染导致的死亡率显著高于单药治疗(表2)[6]。因此必须对每个患者仔细评估风险与收益后选择合适治疗方案,根据患者IST 疗效分为不良组和良好组,不良组:FⅧ∶C<1%或抑制物滴度>20 BU/mL,良好组:FⅧ∶C≥1%且抑制物滴度≤20 BU/mL。根据分组推荐一线治疗方案:良好组给予糖皮质激素单药,不良组给予糖皮质激素联合利妥昔单抗或环磷酰胺[2]。妊娠相关AHA 的IST 治疗首选糖皮质激素单药治疗。对于联合治疗的患者应加强预防感染治疗[6]。一线治疗方案用法见表3。
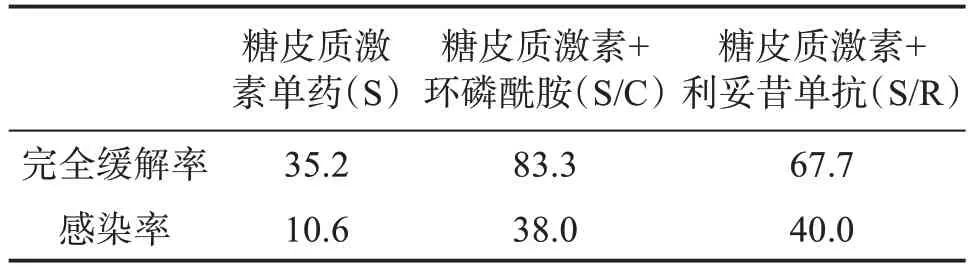
表2 IST一线治疗方案对比%

表3 IST一线治疗方案建议[2]
3.3.3 二线治疗及其他治疗 在一线治疗3 ~5 周后,患者FⅧ:C 较基线值上升不明显或抑制物滴度下降不明显时考虑给予二线治疗。不推荐以清除抗体为目的大剂量静脉注射免疫球蛋白[2]。血浆置换或者免疫吸附法可快速清除血浆中的抑制物并补充FⅧ,可用于难治性出血事件或需要外科干预等特殊情况,但无法持续清除抑制物。CD38 单抗是一种用于治疗白血病和淋巴瘤等恶性肿瘤的药物,近来,Liu W 等[40]报道了4 例对一线和二线抑制物清除治疗无效的AHA 患者在接受CD38 单抗治疗后获得良好的疗效并且均未发生严重感染,为难治性AHA抑制物清除治疗提供了新思路。
3.3.4 治疗期间监测 为了评估疗效及可能的并发症,需每周检测1 次抑制物滴度、FⅧ:C、血常规等。由于6%~7%的AHA 患者死亡原因是血栓形成、心梗和中风,建议对FⅧ:C已恢复正常的非出血患者进行血栓预防治疗,包括机械(弹性长袜)和/或药物血栓预防[41-42],而由于出血和AHA 诊断而停用之前正在进行的抗血小板和/或抗凝治疗,应限于出血风险最高的时期,在出血完全控制和恢复足够FⅧ水平后应重新开始使用抗血栓药物。尽量减少可能引起出血的检查和治疗。
4 总结
近年来,国内对AHA诊治的研究取得了较大进展,诊断路径和止血治疗选择路径的建立便于临床医生(尤其是非血液科医生)对疾病做出及时诊断及治疗。迅速控制急性出血,同时立即采取IST 以清除FⅧ抑制物、提高FⅧ:C,以消除患者出血风险,治疗期间应权衡治疗获益和相关副反应之间的利弊,制定个体化治疗方案,进而改善患者预后。
作者贡献声明徐圆、薛峰、杨仁池撰写文章;薛峰、杨仁池负责整体设计和审阅
利益冲突武田(中国)制药公司对本文发表提供审校支持
致谢武田(中国)制药公司对本文发表提供审校支持

