内分泌治疗乳腺癌的新药:elacestrant
林家桐,申玉婷*,朱震基
阳江市中医医院,1 药剂科,2 重症医学科,阳江 529500
GLOBOCAN 2020 数据[1]显示乳腺癌已取代肺癌成为全球发病率最高的恶性肿瘤。根据雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)以及人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)表达与否,乳腺癌主要分为3个亚型,即激素受体(hormone receptor,HR)阳性型(ER+/PR+)乳腺癌,约占70%;HER2阳性型乳腺癌,约占15%~20%;三阴性乳腺癌(triple-negative breast cancer,TNBC),约占15%[2]。内分泌治疗作为乳腺癌临床治疗的重要手段,尤其对ER+乳腺癌具有高反应性[3]。当前,选择性雌激素受体下调剂(selective estrogen receptor degrader,SERD)为关注度较高的一类ER+乳腺癌内分泌治疗药物。作为首个上市的 SERD,氟维司群已在绝经后ER+/HER2-局部晚期、转移性乳腺癌患者中得到广泛应用。它虽疗效确切,但仍有部分患者出现原发性或继发性耐药,其中一个重要的耐药机制为雌激素受体1(estrogen receptor 1,ESR1)基因突变[4]。氟维司群是一种长效制剂,药动学不佳且需经肌内注射的特点限制了它在临床中的应用[5]。因此,亟需一种可针对原发性或继发性耐药、拥有良好药动学且使用方便的SERD来满足临床需要。Elacestrant(Ela)是一种可口服的SERD药物,由Stemline Therapeutics 公司研发,于2023年1月27日获美国食品药品监督管理局(FDA)批准上市。在对既往至少接受1种内分泌治疗后出现疾病进展的ER+/HER2-晚期或转移性乳腺癌患者(包括ESR1突变患者)的最新研究中,Ela显示出较好的临床疗效[6]。Ela的常规给药方案为345mg/次,每日随食物口服1次,直至患者出现疾病进展或不可耐受的不良反应。本文将从 Ela 的作用机制、药效学、药动学、临床疗效及安全性等作一综述,为临床治疗乳腺癌提供一定的参考,现介绍如下。
1 基本信息
Ela的分子式为C30H40Cl2N2O2,相对分子质量为531.56g/mol,结构式见图1[7]。
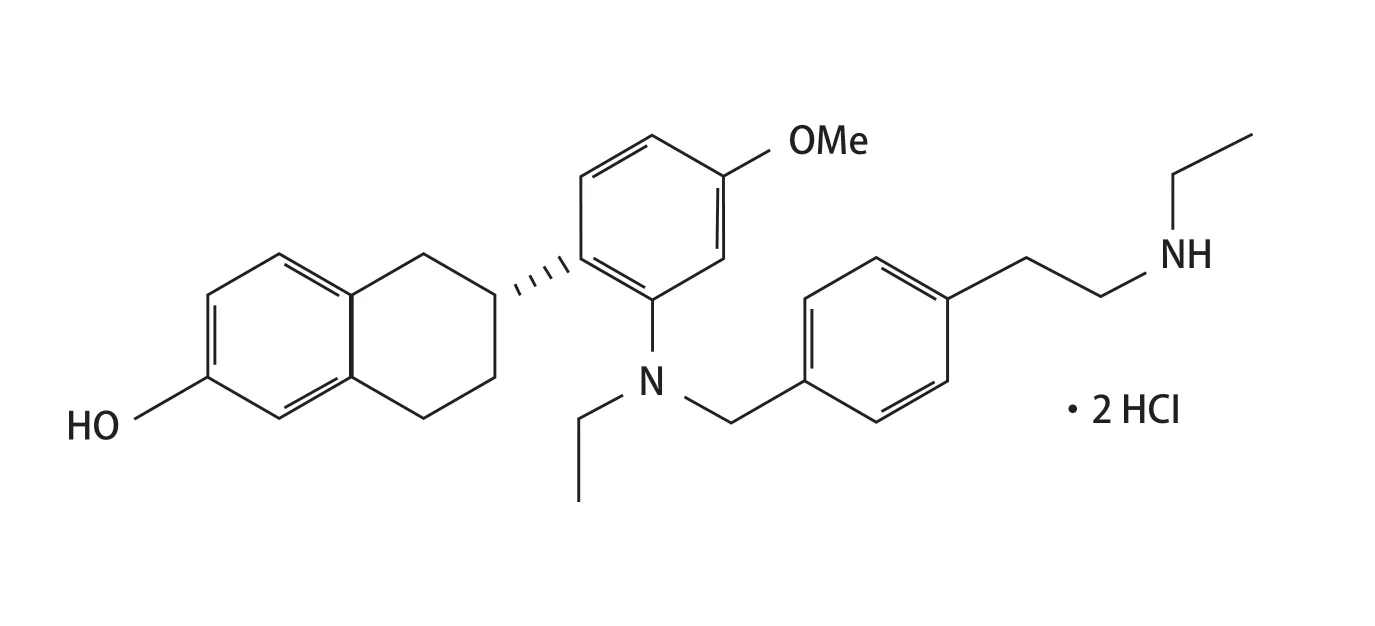
图1 elacestrant 的结构式
2 作用机制
ER为核受体蛋白超家族成员,包括雌激素受体α(ERα)、雌激素受体β(ERβ)2种亚型。ER作为一种配体依赖的转录调节因子,雌二醇与其配体结合区域结合,致使ER构象发生改变,并在DNA活化因子1的协同作用下,调节下游基因的转录,促进乳腺肿瘤细胞的生长、增殖和存活[8]。SERD通过与ER特异性结合,抑制其下游靶基因的转录并降低ER稳定性,促使ER被胞内蛋白酶体降解而显著降低其水平,拮抗雌激素的作用,从而达到抑制癌细胞增殖的效果[9]。Ela 是一种结合ERα的ER拮抗剂;在ER+/HER2-乳腺癌患者中,Ela可抑制17β-雌二醇介导的肿瘤细胞增殖,并通过蛋白酶体途径诱导ERα蛋白降解,进而阻止肿瘤细胞生长[7]。
3 药效学
Ela 作为一种SERD药物,在竞争性受体结合试验中,Ela 对ERα、ERβ的半抑制浓度(IC50)分别为48nmol/L、870nmol/L[10]。Ela已被证实在体外和体内均具有抗肿瘤活性。在MCF7肿瘤异种移植模型中,Ela以60mg/kg剂量单药治疗以及与依维莫司或哌柏西利联合治疗均可抑制肿瘤细胞,且单个肿瘤细胞的ER、PR表达均有所下降[11]。在ST986(ESR1:WT,PIK3CA:E542K),HBCx-21(ESR1:WT,PIK3CA:WT)和MAXF-713(ESR1:WT,PIK3CA:WT)3种人源性组织异种移植(patient-derived xenografts,PDX)模型中,Ela在30mg/kg、60mg/kg、120mg/kg剂量水平均能显著抑制肿瘤细胞生长[11]。此外,Ela对氟维司群和细胞周期蛋白依赖性激酶4/6(cyclin-dependent kinase 4/6,CDK4/6)抑制剂耐药以及含有ESR1突变的ER+/HER2-乳腺癌模型也表现出抑制作用[12-13]。Ela作为目前已知的一种能通过血脑屏障的SERD药物[14],与氟维司群相比,可显著延长乳腺癌脑转移小鼠的生存期[10]。
4 药动学
Ela在43~862mg剂量范围内,药物峰浓度(Cmax)和曲线下面积(area under the curve,AUC)会随剂量增加不成比例地升高[7]。与高热量、高脂肪食物同时服用,Ela的Cmax增加42%,AUC增加22%。Ela口服生物利用度约为10%,每日单次服用345mg后,中位达峰时间为1~4h,并在第6天达稳态浓度,其平均稳态Cmax为119ng/ml,AUC0~24h为2440(ng·h)/ml,AUC0~24h较初始增加2倍。Ela平均表观分布容积为5800L,血浆蛋白结合率>99%,且不受血药浓度影响;半衰期(t1/2)为30~50h,肾脏清除率≤0.14L/h[7]。Ela主要经肝脏由CYP3A4代谢,少数由CYP2A6和CYP2C9代谢。受试者单次口服345mg放射标记的Ela 后,约82%通过粪便排出,其中34%以原型排出体外;另外约7.5%通过尿液排出,其中小于1%以原型排出体外[7]。
年龄、性别、体重对 Ela 的药动学无明显影响,在轻度肝功能损伤患者中,Ela的Cmax和AUC比较无统计学差异;在中度肝功能损伤患者中,Ela的AUC增加83%;重度肝损伤对Ela药动学的影响尚不清楚[7]。
5 药物相互作用
每日联合口服Ela 172mg与伊曲康唑,Ela的Cmax和AUC分别增加4.4倍和5.3倍;单次联合口服Ela 345mg与氟康唑,Ela的Cmax和AUC分别增加1.6倍和2.3倍。而单次联合口服Ela 345mg与利福平,Ela的Cmax和AUC分别减少73%和86%;单次联合口服Ela 345mg与依非韦伦,Ela的Cmax和AUC分别减少44%~63%和55%~73%。此外,单次联合口服Ela 345mg与地高辛,地高辛的Cmax和AUC分别增加1.3和1.1倍;单次联合口服Ela 345mg与瑞舒伐他汀,瑞舒伐他汀的Cmax和AUC分别增加1.5倍和1.2倍[7]。因此,在临床上联合使用Ela与其他药物时,应注意药物相互作用对Ela临床疗效的影响。
6 非临床毒理研究
目前,尚无Ela致癌性以及对动物生育能力影响的相关研究。体外细菌回复突变实验和大鼠骨髓微核体内实验发现Ela无致突变作用[7]。在大鼠和食蟹猴中进行的为期26周和39周的重复剂量毒性研究中,当每日服用Ela≥10mg/kg时,在雌性生殖器官中观察到阴道、宫颈和子宫萎缩以及卵泡囊肿;当每日服用Ela≥50mg/kg时,在雄性大鼠中观察到睾丸间质细胞减少和生精上皮衰退或萎缩[7]。
7 临床疗效
一项Ⅰ期临床试验旨在明确Ela在ER+/HER2-乳腺癌患者治疗中的最大耐受剂量(maximal tolerance dose,MTD)和Ⅱ期临床试验推荐剂量(recommended phase Ⅱ dose,RP2D)[15]。在纳入的57名绝经后ER+/HER2-乳腺癌患者中,18名患者每日口服1次Ela,剂量由200mg按“3+3”剂量递增方式增至600mg,未出现剂量限制性毒性,并确定RP2D剂量为400mg。在RP2D剂量水平最常见的不良反应为恶心(33.3%)、甘油三酯升高和血磷降低(各为25%),多数不良反应为1~2级。31例接受RP2D剂量治疗可评估疗效的患者客观有效率为19.4%,其中既往接受过SERD、CDK4/6抑制剂治疗和ESR1突变患者的客观有效率分别为15%、16.7%和33.3%。47例接受RP2D剂量水平治疗的患者24周临床获益率(clinical benefit rate,CBR)为42.6%,其中既往接受过SERD、CDK4/6抑制剂治疗和ESR1突变患者24周的CBR分别为33.3%、30.4%和56.5%。上述研究初步显示出Ela对既往接受多线治疗的ER+/HER2-转移性乳腺癌患者,尤其是ESR1突变患者具有良好的耐受性和临床疗效。
NCT02650817试验[16]是一项多中心、开放、非随机的Ⅰb期临床试验,旨在通过18F-16α-17β氟雌二醇(18F-FES)正电子发射计算机断层显像(positron emission computed tomography,PET)评估Ela在绝经后ER+乳腺癌晚期患者中对ER的抑制作用。此试验共纳入16例经1~3线内分泌治疗时间超过6个月的绝经后ER+/HER2-晚期乳腺癌患者,平均分为2组。C1组患者口服Ela 400mg,每日1次,C2组患者口服Ela 200mg,每日1次,并在第14天剂量增至400mg,每日口服1次,所有患者接受持续治疗直至出现疾病进展或不可耐受的毒性。患者在首次用药前和治疗第14天用药4h后进行18F-FES PET。试验主要终点是比较接受Ela治疗前和治疗14天后患者肿瘤病灶FES摄取值的差异,并根据实体肿瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)[17]评估总体疗效。结果显示,所有患者肿瘤病灶FES摄取减少百分比中位数为89.1%,C1组患者肿瘤病灶FES摄取减少百分比中位数为88.7%,C2组患者肿瘤病灶FES摄取减少百分比中位数为89.1%;患者总体有效率(overall response rate,ORR)为11.1%,CBR为30.8%。通过18F-FES PET可知Ela具有降低ER的作用,这一结果表明了Ela可发挥抗乳腺肿瘤的作用。
EMERALD研究[18]为一项多中心、开放、随机的Ⅲ期临床试验,旨在比较Ela与标准(standard of care,SOC)内分泌治疗在ER+/HER2-晚期或转移性乳腺癌患者中的临床疗效差异。共纳入477例患者(包括228例ESR1突变患者),按1∶1随机分配至Ela组(239例,400mg/d)和SOC组(氟维司群165例,芳香化酶抑制剂73例,均为药品说明书推荐剂量),并接受持续治疗直至出现疾病进展或不可耐受的毒性。主要终点为所有患者无进展生存期(progression free survival,PFS)。结果显示,Ela组和SOC组的12个月PFS比率分别为22.3%和9.4%,而在ESR1突变患者中分别为26.8%和8.2%;在所有患者中,Ela组6个月和12个月的PFS优于SOC组(HR=0.70,95%Cl:0.55~0.88,P=0.0018),在ESR1突变患者亚组中,Ela组6个月和12个月的PFS同样优于SOC组(HR=0.55,95%Cl:0.39~0.77,P=0.0005)。此外,Ela可使所有患者疾病进展或死亡风险降低30%,ESR1突变患者降低45%。与氟维司群相比,Ela可使所有患者疾病进展或死亡风险降低32%,ESR1突变患者降低50%。以上研究表明在ER+/HER2-晚期或转移性乳腺癌患者(包括ESR1突变患者中),Ela的临床疗效和降低患者疾病进展或死亡风险较当前标准内分泌治疗手段更显著,其临床应用前景值得期待。
NCT05386108试验[19]为一项多中心、开放、全球性Ⅰb/Ⅱ期临床试验,该研究纳入了106例患者并分为2个阶段完成。第1阶段研究明确RP2D,该阶段包括3组患者,C1(Ela 300mg/d联合阿贝西利100mg,bid)、C2(Ela 400mg/d联合阿贝西利100mg,bid)和C3(Ela 400mg/d联合阿贝西利150mg,bid)。第2阶段评估Ela在RP2D剂量水平联合阿贝西利治疗ER+/HER2-乳腺癌脑转移患者的初步临床疗效,主要观察指标为客观有效率,次要指标为根据RECIST和神经肿瘤反应评价(Response Assessment in Neuro-Oncology,RANO)标准[20]评价患者颅内反应率、肿瘤反应持续时间、CRB和PFS。预计该试验将在2025年12月完成。
8 安全性
目前,Ela常见不良反应包括胆固醇升高、甘油三酯升高、丙氨酸转氨酶(ALT)升高、天冬氨酸转氨酶(AST)升高、血红蛋白降低、低钠、肌酐升高等指标异常以及肌肉骨骼疼痛、疲劳乏力、头痛、潮热、食欲减退、恶心、呕吐、便秘、腹泻和消化不良等[7]。
BARDIA等[15]进行的Ⅰ期临床试验中,Ela的大部分不良事件为1级或2级,主要为恶心(33.3%)、甘油三酯升高(25.0%)和血磷降低(25.0%)。在NCT02650817试验[16]中,Ela最常见的不良反应为胃肠道功能紊乱(93.8%),主要为恶心(68.8%)、消化不良(43.8%)、呕吐(37.5%)、食欲减退(31.3%)、疲劳乏力(50.0%)和潮热(31.3%)。大多数不良事件为2级,4名患者出现3级不良事件,未发生4~5级不良事件。
在EMERALD研究[18]中,92%接受Ela治疗的患者出现不良事件,其中最常见的为恶心(35.0%)、疲劳(19.0%)、呕吐(19.0%)、食欲降低(14.8%)和关节痛(14.3%);27.0%接受Ela治疗的患者出现3~4级不良事件,其中最常见的为恶心(2.5%)、背部疼痛(2.5%)和ALT升高(2.1%);15名患者(6.3%)因不良事件中止治疗。但研究者认为出现与Ela治疗相关的不良反应发生率为63.3%,3~4级不良事件发生率为7.2%,3.4%的患者因不良反应而中止治疗,35.0%的患者出现不同程度的恶心。
9 结语
Ela作为一种SERD药物,在体内外试验中均对ER+/HER2-晚期或转移性乳腺癌患者,包括ESR1突变患者显示出较好的临床疗效和安全性。Ela的上市为ER+/HER2-晚期或转移性乳腺癌患者提供了重要的治疗手段,或许将成为对芳香酶抑制剂、CDK4/6抑制剂甚至氟维司群耐药的ER+/HER2-晚期或转移性乳腺癌患者的首选用药。
由于 Ela刚批准用于既往接受至少1种内分泌治疗后出现疾病进展的绝经后女性或成年男性ER+/HER2-的晚期或转移性乳腺癌,其临床疗效和安全性方面的资料尚不充分,仍有待更大规模、更长时间的临床试验来提供循证支持。

