四种微藻对长棘海星幼虫存活率和生长发育的影响
苏 南,张 颖,杨栎潼,陈慧真,3,高 倩,3,陈 偿,4*,杨宇峰
(1.暨南大学水生生物研究所,广东 广州 510632; 2.中国科学院南海海洋研究所、中国科学院热带海洋生物资源和生态可持续发展重点实验室、广东省应用海洋生物学重点实验室,广东 广州 510301;3.中国科学院大学,北京 100049; 4.中国科学院南海海洋研究所、海南西沙海洋环境国家野外科学观测研究站,海南 三沙 573100)
长棘海星[Crown-of-Thorns Seastar(CoTS);Acanthasterspp.]以其强大的破坏珊瑚礁生态系统的能力而闻名[1]。自1963年在澳大利亚大堡礁[2]首次报道了长棘海星的大规模暴发以来,印度洋-太平洋多地区包括波利尼西亚[3]、印度尼西亚[4]和冲绳(琉球)[5]的珊瑚礁都发生过长棘海星的暴发。长棘海星在我国主要分布在中沙群岛西南部、西沙群岛、南沙群岛、海南岛、台湾岛等珊瑚礁海域[6]。自 2004 年以来,我国西沙海域的珊瑚礁经历了两次长棘海星大规模暴发事件,对我国珊瑚礁生态系统造成了严重的破坏[7-9]。在最近的一次报道中,南沙群岛中的太平岛因长棘海星暴发导致珊瑚的覆盖率大幅下降,从2017年的33.0%下降到2021年的0.9%[10]。长棘海星繁殖力强,一只性成熟的雌性海星在一次产卵活动中可产出上亿枚卵子[4],浮游幼虫阶段的存活率决定了成体种群的规模,是长棘海星暴发的生物学基础。
与大多数棘皮动物幼虫一样,长棘海星幼虫以微型浮游植物为食,幼虫的发育速度和存活率随着食物的可利用性而增加[11]。迄今为止,有关长棘海星幼虫的食性研究主要集中在浮游植物的大小和浓度对幼虫摄食行为的影响方面。例如,前人研究发现,长棘海星幼虫对较小浮游植物(1~2 μm)的摄食率显著低于较大的浮游植物(4~5 μm)[12]。长棘海星幼虫主要以中等大小的浮游植物为食,例如,大于5 um的鞭毛藻(dinoflagellates)和羽纹纲硅藻(pennate diatoms)[11,13-19]。长棘海星幼虫发育速度和存活率随着藻类含量的增加而增加[11]。当用叶绿素a浓度表征浮游植物生物量时,幼虫生长速度随着叶绿素a水平(>2 μg/L)增加而加快[16-18, 20-22]。此外,Wolfe等认为,叶绿素a水平在0.4~1.0 μg/L之间可能是幼虫生存和发育的最佳范围[19-21]。因此,前人以叶绿素a浓度作为主要参数,建立了长棘海星幼虫密度相关模型,用以预测长棘海星的暴发[17]。
虽然上述研究有助于了解长棘海星幼虫的食性,但通过以叶绿素a含量来代表被长棘海星幼虫摄食的浮游植物含量的做法存在很大争议。叶绿素a含量主要与水体总浮游植物的生物量有关[22]。它既不能区分藻类的大小,也不能区分其种类,而特定大小和种类的饵料藻类可能才是决定幼体发育的关键因素。例如,Wolfe等人用一种具有极低叶绿素a浓度的隐藻(Proteomonassulcata)喂养长棘海星幼虫,结果证明它们可以完成发育[23-24]。然而,与澳大利亚大堡礁海域该藻类细胞浓度相比,在实验中所需藻类饵料的细胞浓度却很高[24-25]。因此,对于促进长棘海星幼虫的快速发育和存活,特定浮游植物的生物量可能比浮游植物总生物量(以及相应的叶绿素a浓度)更为重要[26]。
目前对珊瑚捕食者幼虫的摄食生态了解有限,特别是对不同微藻如何影响长棘海星幼虫的存活率和生长发育等方面的报道很少。以往对南海海域浮游植物群落结构的研究表明,南海海域夏季主要以硅藻门为主,其中角毛藻属(Chaetocerossp.)为优势物种,还包括一些绿藻门的物种[26-27],因此本研究选取硅藻门和绿藻门的藻种用以喂食长棘海星幼虫,即两种常用于长棘海星幼虫实验的杜氏盐藻(Dunaliellasalina)和牟氏角毛藻(Chaetocerosmeülleri)[20-21,28-30],以及两种常用于棘皮动物幼虫养殖实验的亚心形扁藻(Platymonassubcordiformis)和小球藻(Chlorellavulgaris)[31-32]。比较了4种微藻对长棘海星幼虫存活率和生长发育的影响,分析了幼虫的发育与微藻营养含量的相关性。以便了解长棘海星浮浪幼虫阶段的摄食及营养需求,探明幼虫生长发育的关键影响因素,为长棘海星防控手段的开发提供了新的方向。
1 材料与方法
1.1 长棘海星的催产与幼虫培养
2022年4月30日于海南省琼海海域(19°09′19″N,110°37′12″E)采集19只长棘海星成体,其中雌性为8只,雄性为11只。随后运至海南热带水产研究开发中心人工养殖池中,自然流动海水暂养2周,平均水温为28 ℃。
长棘海星的催产及其配子受精的方法参考Tian和Keesing等的方法[29,33]。使用6只雌性和3只雄性进行催产受精。一旦配子释放结束后,移除父本和母本,立即将精卵配子按100∶1的比例进行受精。20 min后,收集受精卵,转移到2个1 000 L装有过滤海水的养殖池中进行通气暂养。受精卵和幼虫的暂养密度约为2 ind./mL。
1.2 浮游微藻的培养与营养分析
4种实验微藻由海南热带水产研究开发中心提供,分别为3种绿藻:杜氏盐藻、亚心形扁藻、小球藻和1种硅藻:牟氏角毛藻。采用F/2培养基在26 ℃下进行12 h∶12 h光暗循环培养。每种微藻随机选取30个在光学显微镜下进行拍照,采用ImageView软件测量微藻的直径。
为了分析微藻的营养含量,将4种微藻样品寄送杭州研趣信息技术科学指南针检测机构进行营养成分的测定。依据《食品安全国家标准 食品中脂肪的测定》[34]测定藻类脂肪含量。依据《食品安全国家标准 食品中蛋白质的测定》[35]测定藻类蛋白质含量。根据Bureau等发表的脂肪和蛋白质的燃烧值焓确定每种藻的能量含量[36]:脂肪的燃烧焓值以每克脂肪含有39.5 kJ 能量计算,蛋白质的燃烧焓值以每克蛋白质含有23.9 kJ计算,每种藻的能量含量等于脂肪和蛋白质燃烧焓值之和。
依据《食品安全国家标准 食品中脂肪酸的测定》[34],测定藻类脂肪酸含量。称取10 g藻液试样,在碱性条件下皂化和甲酯化,生成脂肪酸甲酯,经毛细管柱气相色谱分析,面积归一化法定量测定脂肪酸百分含量。试样中某个脂肪酸占总脂肪酸的百分比Yi(%)按式(1)计算,通过测定相应峰面积对所有成分峰面积总和的百分数来计算给定组分i的含量:
(1)
式(1)中:AS为试样测定液中各脂肪酸甲酯的峰面积;FF为脂肪酸甲酯i转化成脂肪酸的系数;∑AS为试样测定液中各脂肪酸甲酯的峰面积之和。
以上所得测定脂肪、蛋白质、脂肪酸含量的数据结果为在重复性条件下获得的两次独立测定结果的绝对差值没有超过算术平均值的10%。
1.3 幼虫喂养实验
受精后48 h,幼虫拥有完整的消化道。采用放回抽样法对2个养殖缸中的幼虫数量进行估算[27]。抽吸游动的幼虫,随机分配至12个含10 L过滤海水的培养箱,幼虫密度约为0.5 ind./mL。每个饲养箱通入充气石,以确保水的混合和保持高水平的溶解氧。培养水体温度为(30.44±0.62)℃,盐度为35.13±0.16 ,pH为8.27±0.06,适宜幼虫生长发育[1,19]。实验共用4种微藻单独投喂,每种藻类分别设3个重复。每天投喂前,采用血球计数板测定藻类浓度,确保藻类的喂养浓度为5 000 cells/mL[19-20]。每隔一天使用150目滤网更换培养箱中一半海水。
分别于实验第1天、第5天、第9天、第13天、第16天测量幼虫发育指标。用一次性巴氏吸管从每个培养箱中随机收集10只幼虫,使用安装在奥林巴斯DP26显微镜上的相机拍照。采用ImageView软件测量幼虫的长度和宽度、胃表面积,以每个重复9只幼虫的平均值作为分析数据(n=9)。于实验结束时(第16天)计算所存活的幼虫的数量,即通过对每个培养箱中100 mL的子样本进行3次放回抽样计数,以3次的平均数值作为每个培养箱中幼虫的存活数。
1.4 数据分析
使用Excel 2010整理数据,Origin 9.0软件用于绘图。利用SPSS 19.0 软件进行数据统计分析,所有数据结果进行正态性检验(Shapiro-Wilk tests)和方差齐性检验(Levene’s tests)[37],对同一实验时间的幼虫测量数据进行单因素方差分析(One-Way ANOVA),以藻的种类作为固定因素,事后多重比较(Tukey’s HSD)用于确定不同处理之间的差异。图表中的数据用平均值±标准差表示。
2 结果与分析
2.1 4种微藻的主要生理指标与营养含量
4种微藻具有不同的蛋白质、脂肪和能量含量(图1)。亚心形扁藻的蛋白质和脂肪含量分别为154 pg/cell、300 pg/cell[图1(a)、(b)],均高于其他3种微藻。牟氏角毛藻的蛋白质含量(92.0 pg/cell)次之。杜氏盐藻的蛋白质含量(32.8 pg/cell)最低,但其脂肪含量(73.8 pg/cell)却高于牟氏角毛藻(49.0 pg/cell)和小球藻(34.3 pg/cell)[图1 (b)]。粗营养成分与藻类细胞的能量含量正相关。亚心形扁藻的能量含量(15.50×10-9kJ/cell)明显高于其他3种藻,其次是牟氏角毛藻(4.95×10-9kJ/cell)和杜氏盐藻(3.70×10-9kJ/cell),能量含量最低的是小球藻(2.84×10-9kJ/cell)[图1(c)]。
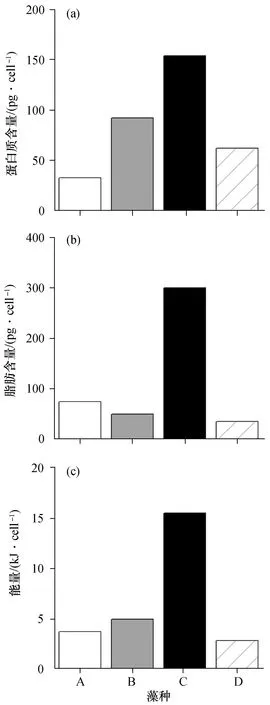
图1 4种藻的营养含量Fig. 1 Nutrient contents of the four algae speciesA:杜氏盐藻;B:牟氏角毛藻;C:亚心形扁藻 ;D:小球藻。下同 。
4种微藻具有不同的直径大小(表1)。亚心形扁藻的直径为[(13.32±0.43)μm],显著大于其他3种藻,其次是牟氏角毛藻[(8.74±0.27) μm]和杜氏盐藻[(7.23±0.61)μm ],小球藻[(2.29±0.04)μm]的直径最小。4种藻大致呈球形,除亚心形扁藻游动频繁以外,其他藻游动并不明显[38-41]。

表1 4种藻类的直径大小Tab. 1 Diameters of the four algae species
4种微藻的脂肪酸含量存在差异(表2)。小球藻所含C20系列脂肪酸、饱和脂肪酸和单不饱和脂肪酸含量最高,其次是牟氏角毛藻。亚心形扁藻所含饱和脂肪酸和单不饱和脂肪酸含量最低。而就n-6 多不饱和脂肪酸和总不饱和脂肪酸的含量而言,4种微藻所含趋势却相反,亚心形扁藻的含量最高,其次是杜氏盐藻、牟氏角毛藻、小球藻。此外,就3种对幼虫生长发育比较重要的多不饱和脂肪酸C20:4 N6(ARA)、C20:5 N3(EPA)和C22:6 N3(DHA)而言,这4种微藻均未检出,可能是4种微藻不含有这些脂肪酸或脂肪酸含量低于检出限(0.001 3%)。
2.2 4种微藻对长棘海星幼虫存活率的影响
4种微藻喂养的长棘海星幼虫存活率存在显著的差异(图2)。在实验结束时(第16天),发现喂养牟氏角毛藻的幼虫存活率为(7.20±0.01)%,显著高于其他3种微藻喂养的幼虫(F(3,7)= 293.7;P<0.01),其次是喂养亚心形扁藻[幼虫存活率为(0.79±0.30)%]和小球藻[幼虫存活率为(0.68±0.30)%]的幼虫,喂养杜氏盐藻的幼虫存活率最低,为(0.24±0.11)%。
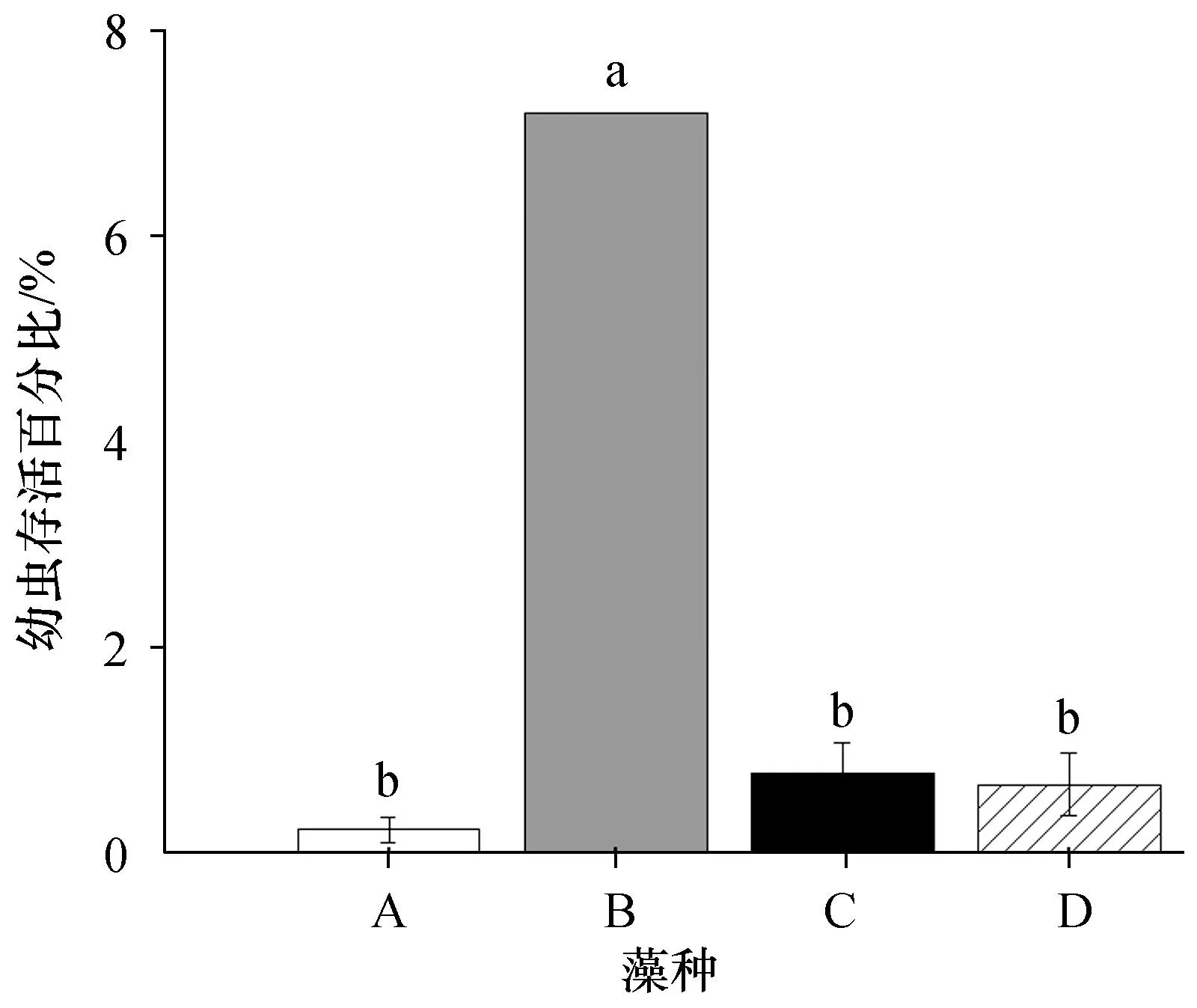
图2 在4种不同藻类饲养下第16天长棘海星幼虫存活百分比Fig. 2 Larval survival percentage of CoTS larvae reared with four different algae in 16 days不同小写字母表示差异显著(P<0.05)。
2.3 4种微藻对长棘海星幼虫生长发育的影响
4种微藻显著影响了长棘海星幼虫的体长(F(3,160)= 27.62;P<0. 01)、体宽(F(3,160)= 17.70;P<0. 01)和胃面积(F(3,160)=47.62;P<0.01)(图3)。在实验第5天,杜氏盐藻和牟氏角毛藻喂养的幼虫体长(F(3,32)= 5.70;P<0.01)分别为831.25 μm和794.45 μm,均显著高于小球藻喂养的幼虫体长(675.56 μm),杜氏盐藻和牟氏角毛藻喂养的幼虫胃面积(F(3,32)= 14.18;P<0.01)分别为24 871.63 μm2和19 930.22 μm2,均显著高于亚心形扁藻和小球藻喂养的幼虫胃面积(分别为10 657.90 μm2和8 151.82 μm2)[图3(a)、(c)]。在实验第9天,杜氏盐藻喂养幼虫体长和胃面积分别为680.16 μm、12 136.54 μm2,牟氏角毛藻喂养幼虫体长和胃面积分别为713.68 μm、14 688.71 μm2,亚心形扁藻喂养幼虫体长和胃面积分别为684.28 μm、12 210.46 μm2,这3种藻喂养的幼虫体长(F(3,32)= 5.60;P<0.01)和胃面积(F(3,32)= 5.36;P<0.01)均显著高于小球藻喂养的幼虫(体长606.95 μm、胃面积6 918.91 μm2)[图3(a)、(c)]。第13天,牟氏角毛藻喂养的幼虫比其他3种微藻喂养的幼虫长36%~69%,宽33%~69%。第16天,牟氏角毛藻喂养的幼虫比其他3种微藻喂养的幼虫长43%~74%,宽51%~71%[图3(a)、(b)]。统计分析表明,在实验第13天和第16天,牟氏角毛藻喂养的幼虫,其体长(F(3,32)= 21.73;P<0.01;F(3,32)= 22.17;P<0.01)、体宽(F(3,32)= 14.14;P<0.01;F(3,32)= 15.41;P<0.01)和胃面积(F(3,32)= 11.57;P<0.01;F(3,32)= 12.17;P<0.01)均极显著大于其他3种藻类喂养的幼虫(图3)。
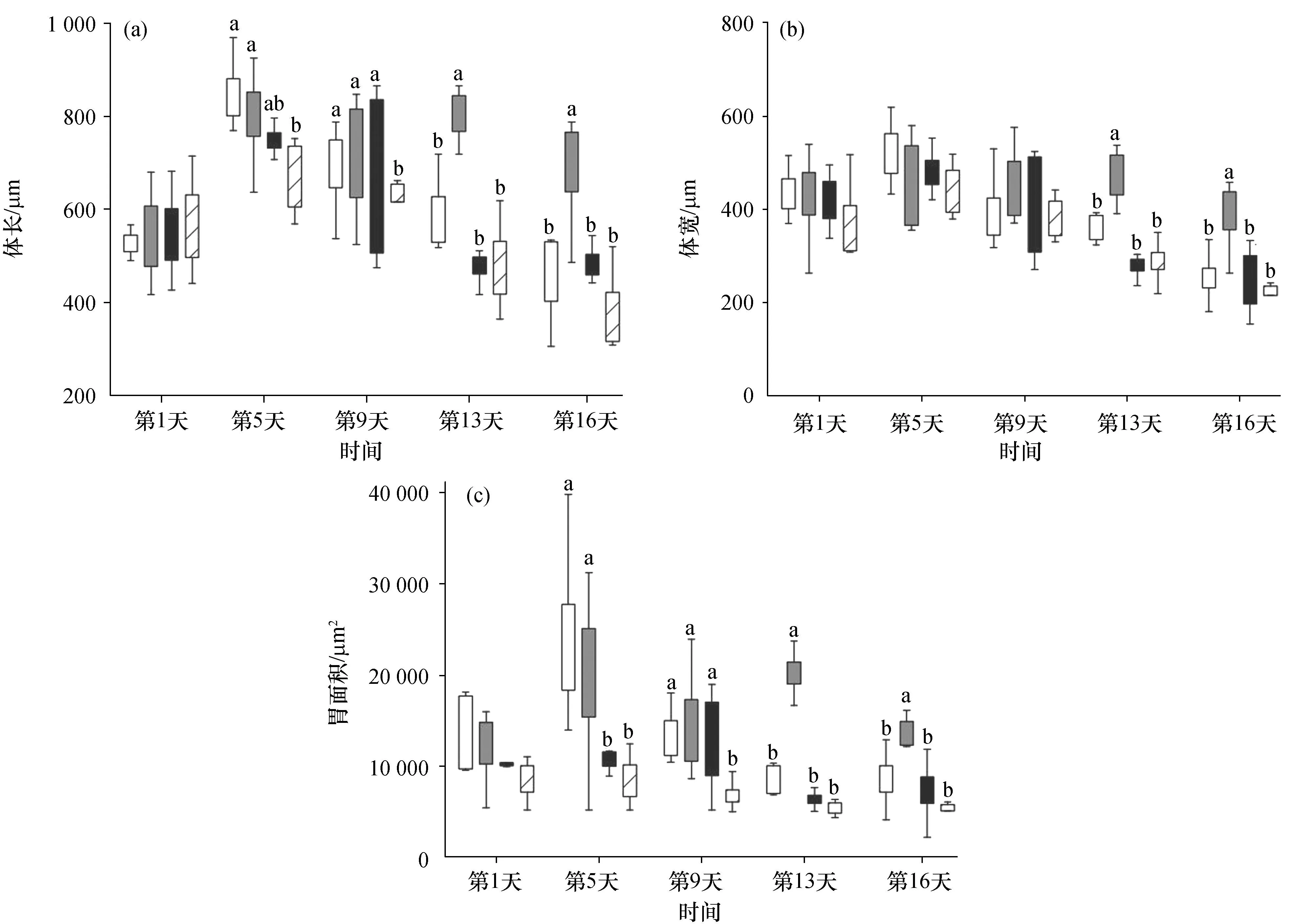
图3 第1、5、9、13、16天在4种不同藻类下饲养的长棘海星幼虫的体长、体宽、胃面积 Fig. 3 Body length、body width and stomach area of CoTS larvae reared with four different algae in 1, 5, 9, 13 and 16 days
3 讨论
自然条件下的长棘海星幼虫可以接触到多种不同的食物,为其发育到底栖幼体阶段提供营养[1]。不同食物可能最终决定了幼虫种群完全不同的生长速度和存活率,因此最佳饵料的密度可能是长棘海星种群暴发的主要驱动因素之一[21,42]。本研究使用4种微藻喂养长棘海星幼虫,发现幼虫的存活和生长发育存在显著差异,牟氏角毛藻喂养的幼虫发育最好,杜氏盐藻次之,其后分别是亚心形扁藻和小球藻。证明了饵料藻类对长棘海星幼虫的发育有显著影响。
微藻富含蛋白质、脂肪、多糖、维生素、抗氧化物质、色素及微量元素等营养物质,不同种的微藻对棘皮动物的生长、发育、变态过程有着不同的影响[43]。在本研究中,与摄食其他3种微藻的幼虫相比,摄食牟氏角毛藻的幼虫表现出较良好的生长状态和存活率,这与Mellin等的研究结果一致[44]。Mellin等发现,当藻类喂养浓度相同时,长棘海星幼虫会选择性地摄食角毛藻,而不是三角褐指藻、巴夫藻或等鞭金藻。有研究表明,角毛藻被认为是世界上最适合饲养软体动物幼虫的微藻种类之一[45]。本研究中牟氏角毛藻的蛋白质含量、能量高于杜氏盐藻和小球藻,含有的C20系列脂肪酸、饱和脂肪酸和单不饱和脂肪酸也高于杜氏盐藻和小球藻,表明当提供相同浓度的微藻时,长棘海星幼虫在可获取摄食的微藻(摄食颗粒直径大约在5~15 μm)中会选择性地摄入能量较高、营养成分多样化的微藻。微藻中不同的初级代谢物(如蛋白质、氨基酸、糖)驱动长棘海星幼虫独特的初级代谢通路,最终可能对幼虫的存活、生长、发育产生影响[44]。
胃面积可以用来评价幼虫的生长状态,反映其消化能力和摄食藻类所提供的营养是否适合幼虫,当幼虫被喂食最合适的饵料时,可以发现更大的胃面积[46-47]。本实验第5天,喂食杜氏盐藻和牟氏角毛藻的幼虫胃面积显著高于喂食其他两种微藻的幼虫,而发育后期,喂食杜氏盐藻的幼虫生长缓慢。这可能是由于杜氏盐藻没有细胞壁[38],因此在幼虫发育初期更容易被消化,但随着幼虫消化系统发育逐渐完善,杜氏盐藻中的营养跟不上幼虫所需,杜氏盐藻的营养优势较发育初期也逐渐下降了。牟氏角毛藻细胞壁薄[45],也易被幼虫消化吸收,而亚心形扁藻具有一层纤维素细胞壁,相较之下幼虫摄食后难以裂解消化。前人的研究发现,由于扁藻的纤维素细胞壁,很难被摄食的紫海胆浮游幼体裂解消化,导致其幼体胃部由起初的大和圆逐渐变小和萎缩[31]。
幼虫的摄食选择性除与饵料的营养能量相关外,还与藻类饵料的大小和形状有关[43-44]。Okaji等人的研究发现,长棘海星通常消耗5~15 μm的颗粒[12]。在本研究中,亚心形扁藻的脂肪、蛋白质、能量、不饱和脂肪酸含量均高于其他3种微藻,然而喂养亚心形扁藻的幼虫发育却不如预期。可能是由于亚心形扁藻的个体显著大于其他3种微藻,而且其直径(13 μm)接近CoTS幼虫摄食颗粒粒径的末端,加之亚心形扁藻游动迅速频繁[39],可能导致其很难被长棘海星幼虫捕获。小球藻因其适应性强、繁殖快以及丰富的蛋白含量,被广泛应用于海洋动物养殖[43]。在本研究中,小球藻综合能量最低,且其直径(2.29±0.04 μm)大小也显著低于其他3种微藻。Ayukai等人的研究表明,长棘海星幼虫对小粒径细胞(球形直径1~2 μm)的摄食率要远低于对更大的藻类细胞(如球形直径4.7 μm的三角脂褐藻和球形直径6.1 μm的杜氏盐藻)的摄食率,而且当细胞球形直径在5 μm以下时,浮游植物会显著影响长棘海星幼虫的进食率[48]。本研究中摄食小球藻的长棘海星幼虫生长缓慢,与Ayukai等人的研究结果一致。
本研究表明,在4种单一微藻喂养条件下,幼虫在受精后16天时存活率最高为7%,其他藻类均不足1%,与类似实验相比[19,29],本研究中同时期幼虫的存活率偏低,可能是由微藻种类和喂养浓度等因素引起的。Wolfe等人[19]使用Proteomonassulcata来喂养幼虫,当幼虫密度为1 ind./mL,藻类大小为7~10 μm,且喂养浓度为10 000 cells/mL时,幼虫存活率为65%,本研究与Wolfe等人使用了相同的幼虫培养密度和同等大小微藻的喂养浓度,但是存活率偏低,可能是由于本研究使用了不同的微藻进行幼虫的喂养,提示不同的微藻可能具有不同的营养含量,从而影响幼虫的生长发育和存活。与Tian等人[29]的实验(存活率30%左右)相比,本研究使用了同一种微藻(牟氏角毛藻)喂养幼虫,但幼虫的存活率仅为7%,可能是由于本实验微藻的喂养浓度大约在5 000 cells/mL,低于Tian等人的微藻喂养浓度(15 000~20 000 cells/mL)。其次,除投喂牟氏角毛藻以外,Tian等人还每日投喂3次海洋红酵母。考虑到Tian等人的实验并未提到幼虫的培养密度,使我们的结果无法与其进行有效的比较,因此这些因素只能作为潜在的可能原因。此外,以往的喂养实验很少使用单一藻种投喂幼虫,大多使用两种及以上的微藻混合投喂,单一藻种喂养所提供的营养跟不上幼虫生长发育所需可能也是导致本实验存活率偏低的一个原因[11-12,18-19,21,23]。
在对棘皮动物幼虫的营养需求研究中,Hinegardner等人利用14种相同浓度的单一藻种分别喂养5种海胆幼虫,发现只有3种藻类可使海胆幼虫成功发育[49]。与之相比,本研究的4种藻均能在一定程度上支持幼虫发育,表明长棘海星的幼虫具有较广谱食性,这可能是其种群暴发的生物学基础之一。广泛引起讨论用于解释长棘海星暴发原因的两个假说,即幼虫恢复力假说和营养增强假说,都是以叶绿素a浓度代表幼虫摄食藻类含量。虽然叶绿素a含量易于测量,但叶绿素a含量在不同藻类之间差异很大,并不一定反映藻类的营养价值[1,28],仅仅基于水体叶绿素a浓度来预测长棘海星种群密度及其暴发趋势的模型可能不全面和准确[17]。本研究的结果表明,藻类的种类及其营养成分对幼虫的生存发育也存在显著的影响。
长棘海星具有强大的繁殖力,即使在浮游幼虫阶段存活率的小幅增加也可能对成体种群大小产生显著影响,因此了解自然状态下,长棘海星浮游幼虫摄食微藻的营养状况对于了解长棘海星种群暴发的开始和传播很重要[4-5]。目前对南海岛礁浮游藻类的物种组成、季节演替和地理分布知之甚少,未来需要深入调查和分析重点海域浮游植物群落演替规律,研究优势藻类对长棘海星幼虫生长发育的影响,并针对幼虫的选择性摄食行为,从形态结构、生理生化和分子水平上解析偏好性藻类对长棘海星幼虫发育的影响机制,从而揭示南海长棘海星周期性暴发的机理和规律,以期为防控长棘海星生态灾害提供科学依据。
4 结论
4种微藻均能在一定程度上支持长棘海星幼虫的发育,但不同微藻喂养下幼虫的存活和发育存在显著差异。牟氏角毛藻喂养的幼虫存活率、幼虫体长、体宽、胃面积均显著高于杜氏盐藻、亚心形扁藻和小球藻喂养的幼虫,其余3种微藻喂养的幼虫存活及各发育指标均无统计学差异。结合藻类生理指标和营养成分分析结果,发现牟氏角毛藻的蛋白质含量、能量、以及C20系列脂肪酸、饱和脂肪酸和单不饱和脂肪酸均高于杜氏盐藻和小球藻,而且其大小更适宜幼虫的捕食,表明微藻的种类、大小和营养成分均会影响长棘海星幼虫的发育,以往仅以叶绿素a含量表征长棘海星幼虫的食物浓度,预测幼虫种群的动态变化是不够全面和准确的。
致谢:感谢海南热带水产研究开发中心陈明强老师提供藻种。

