斜带髭鲷内脏白点病病原的分离鉴定及耐药性分析
李慧耀,杨求华,葛 辉,何丽斌,吴丽云,吴建绍*
(1.福建省水产研究所,福建 厦门 361013; 2.福建省海洋生物增养殖与高值化利用重点实验室,福建 厦门 361013)
斜带髭鲷(Hapalogenysnitens)是一种重要的海水养殖经济鱼类,隶属于鲈形目(Perciformes) ,石鲈科(Haemulidae) ,髭鲷属(Hapalogenys),主要分布在西北太平洋地区,是东亚特有海洋鱼类[1]。斜带髭鲷在我国东海、南海均有野生资源分布,主要生活在近海中下层水体,摄食底栖的鱼类或者贝类[2]。斜带髭鲷具有长速快、肉质鲜美等优良养殖性状,1995年成功进行人工育苗,随着养殖规模迅速扩大,已发展成为我国沿海重要的养殖经济鱼类之一[3]。然而,近年来随着养殖规模的发展和养殖密度扩大,斜带髭鲷患内脏白点病发病越来越频繁,制约了该养殖业的可持续发展。
内脏白点病是鱼类中常见的一种细菌性疾病,主要临床表现为病鱼活力下降、食欲减退,体表无明显症状,但解剖后可观察到脾脏、肝脏、肾脏等内脏有许多白色结节小点,可能伴有严重的腹水、胀气等症状,发病初期不易察觉,后期死亡率极高,易造成较大的经济损失[4]。鱼类内脏白点病的病原呈现多样化特点,有鰤鱼诺卡氏菌(Nocardiaseriolea)[5]、变形假单胞菌(Pseudomonasplecoglossicida)[6]、巴氏杆菌(Pasteurellapiscicida)[7]、嗜水气单胞菌(Aeromonashydrophila)[8]、美人鱼发光杆菌(Photobacteriumdamselae)[9]和立克次氏体[10]等。由于不同病原菌感染鱼类所引起的内脏白点病外观症状相似,因此有必要对发生内脏白点病的病原进行分离鉴定。
目前,关于斜带髭鲷内脏白点病的研究未见报道。本研究从患内脏白点病的斜带髭鲷的内脏中分离得到一株优势菌株,结合形态学、生理生化特征和分子生物学技术对其进行种类鉴定,并对分离得到的菌株进行了药物敏感性试验,本研究可为斜带髭鲷内脏白点病的防治提供理论依据。
1 材料与方法
1.1 细菌分离培养与形态学观察
患病和健康的斜带髭鲷均采集自福建省漳州市龙海区斗美海域鱼排网箱,重量为(395±23) g,采集样本时海区水温为15 ℃,盐度为25,溶解氧浓度为8.13 mg/L。病鱼临床表现为腹部胀大、食欲不振、游泳无力。使用无菌采样袋将病鱼转移至实验室进行解剖观察,无菌操作条件下,从病鱼的脾脏和头肾等器官病灶处取样,使用2216E液体培养基(青岛海博生物技术有限公司)对病原菌进行分离培养,在28 ℃、220 r/min条件下培养过夜。然后用无菌接种环挑取单菌落在2216E琼脂平板上划线纯化,重复3次。纯化后的菌种用体积分数为20%甘油生理盐水保存于-80℃超低温冰箱中备用。使用透射电子显微镜(日立HT7800,日本)观察分离菌的显微形态。
1.2 回归感染
将分离的菌株接种于5 mL的液体培养基,在220 r/min、28 ℃条件下培养细菌至对数生长期。用无菌生理盐水(北京索莱宝科技有限公司)稀释菌液至浓度约为106 CFU/mL,采用腹腔注射法进行回归感染,每尾鱼注射菌悬液100 μL,对照组注射等量无菌生理盐水,每组设置3个平行,每个平行10尾鱼,回归感染用鱼规格为(73±8) g,感染后取症状明显的个体进行病原菌的分离。
1.3 系统发育分析
使用细菌基因组提取试剂盒(上海捷瑞生物工程有限公司)提取细菌基因组DNA,具体步骤按照说明书进行。使用引物扩增细菌的16S rRNA、dnaJ、gyrB基因[11],引物序列如表1所示。PCR反应条件如下:95 ℃预变性5 min,95 ℃变性30 s,45~57 ℃退火30 s,72 ℃延伸1 min,72 ℃延伸10 min,4 ℃保存,反应循环数为35次,反应体系为50 μL。反应产物交由厦门铂尚生物技术有限公司进行测序。测序所得到的序列与NCBI(National Center for Biotechnology Information)下载的序列通过软件MEGA 7.0基于Neighbour-joining方法构建其系统发育树。
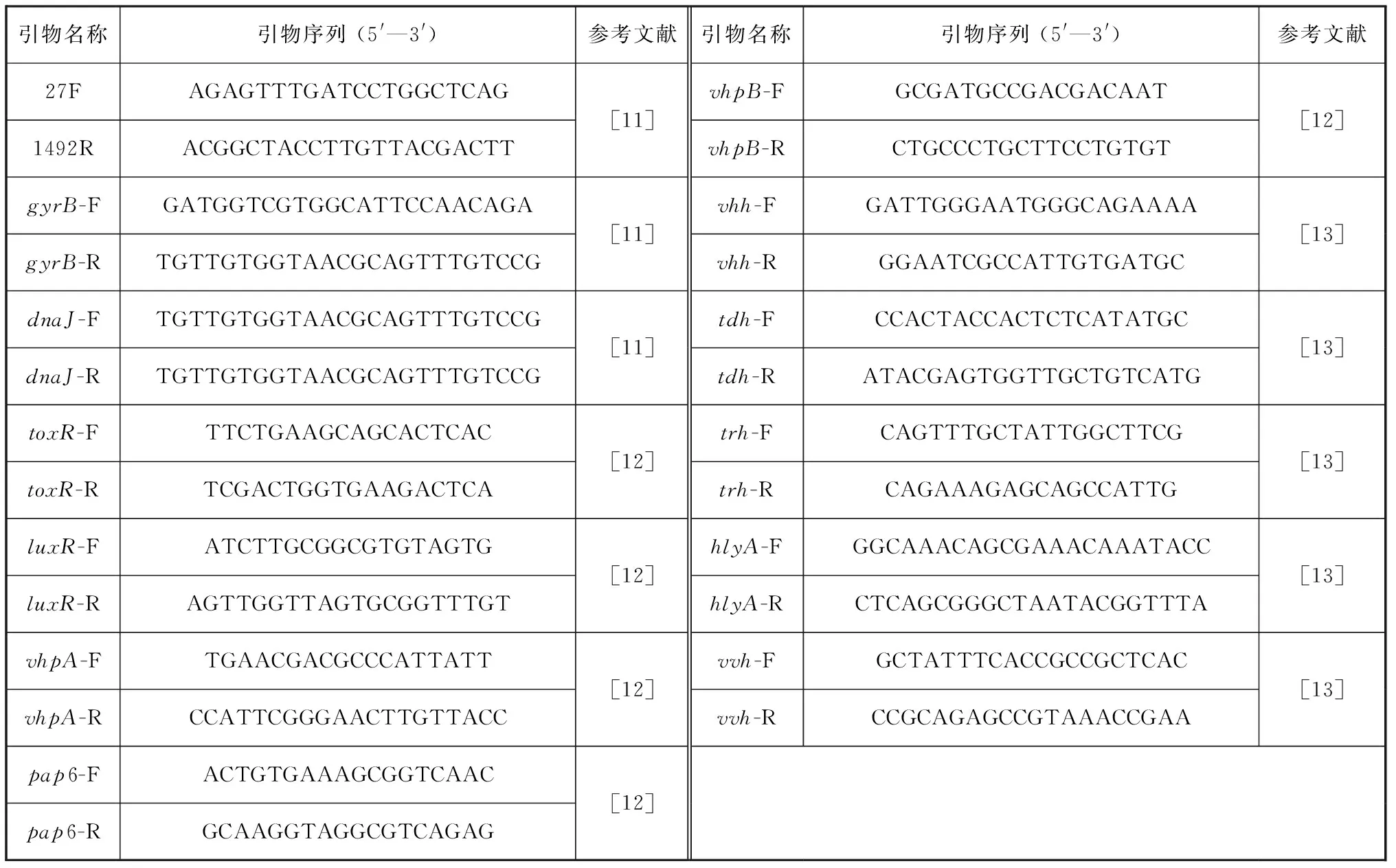
表1 PCR扩增所用引物序列Tab. 1 Primer sequences for PCR amplification
1.4 生理生化鉴定
参照Guo等[14]的方法,采用Biolog Gene III 半自动细菌鉴定系统鉴定细菌的生理生化表型。使用浊度计将含有10 mL IF-A的空白试管(Biolog目录72401,浊度计的透射率调节到100%),从过夜培养的琼脂平板上挑取单菌落添加到试管中,使悬浮液的透射率保持在95%~98%之间,然后将悬浮液添加到96孔板中(100 μL/孔,Gene III),并在28 ℃下培养18~24 h。使用MicroStationTMand OmniLog®软件对细菌的生理生化表型进行鉴定。
1.5 组织病理学
从“1.1”中同时切取厚度小于5 mm的具有典型症状的患病斜带髭鲷肝脏、脾脏、肾脏、鳃和心脏等组织器官,取健康斜带髭鲷对应样品作为对照组,使用Servicebio 通用型组织固定液在室温下固定24 h。制备组织切片并用石蜡包埋。切片用苏木精-伊红(H&E)染色后在显微镜下观察并拍照[15]。
1.6 毒力基因检测
通过PCR法检测分离菌的常见毒力基因携带情况,包括毒力调控基因toxR、群体效应调节基因luxR、金属蛋白酶基因vhpA和vhpB、锌金属蛋白酶基因pap6、哈维氏弧菌(Vibrioharveyi)溶血素基因vhh、霍乱弧菌(Vibriocholerae)溶血素基因hlyA、创伤弧菌(Vibriovulnificus)溶血素基因vvh、副溶血弧菌(Vibrioparahaemolyticus)耐热直接溶血素基因tdh和耐热直接相关溶血素基因trh,其所需的引物序列见表1[12-13]。PCR 扩增体系及程序参照“1.3”。
1.7 抗微生物药物敏感性试验
使用药敏纸片扩散法测定分离菌株对氨苄西林、阿米卡星、呋喃妥因和诺氟沙星等29种抗生素的敏感性。具体步骤为将过夜培养的分离菌菌液转接至新鲜的2216E液体培养基中,在28 ℃、200 r/min条件下,培养至OD600为0.3~0.4,取100 μL菌液均匀涂布在MH平板上,并在超净台上晾干30 min,待平板上的水分被充分吸收后,将药敏试纸(杭州滨和微生物试剂有限公司)平整的贴在涂有菌液的平板上。在28 ℃下倒置培养16~24 h,每种药物设置3个重复试验,使用游标卡尺测量抑菌圈大小,根据CLSI M100标准判定细菌对药物的敏感程度。使用动物用药敏检测分析试剂盒(南京菲恩医疗科技有限公司)测定《水产养殖用药明白纸 2022年 1、2 号》中批准使用8种常用渔药对分离菌株的最小抑菌浓度(minimal inhibit concentration, MIC),包括恩诺沙星、硫酸新霉素、甲砜霉素、氟苯尼考、盐酸多西环素、氟甲喹、磺胺间甲氧嘧啶、磺胺甲噁唑/甲氧苄啶,具体步骤按说明书要求进行。
2 结果
2.1 细菌分离培养及回归感染结果
斜带髭鲷发病时在网箱边缓游或浮在水面,濒死病鱼体表外观无溃疡、缺损,但腹部鼓胀,鳃丝有白点且轻度溃烂[图1(a)],镜检无其它寄生虫附着,卵巢肿大、肝脏呈黄白色,肝脏、脾脏、头肾和心脏上有明显的白点结节症状,其中脾脏白点症状最严重[图1(b)]。从脾脏、肝脏和头肾病灶处均可分离到外观单一的细菌菌落hn-1,菌株在2216E琼脂培养基上呈圆形,边缘整齐,菌落直径约1~2 mm,在TCBS培养基上呈黄色圆形菌落。透射电镜观察结果显示,分离菌株呈杆状,具极生单鞭毛,长度约4.6 μm[图1(c)]。经16S rRNA测序鉴定为哈维氏弧菌。回归感染实验结果显示,第5天肝脏、脾脏已经出现白点症状[图1(d)],被感染的斜带髭鲷在第5天开始出现大量死亡,第12天死亡率达到91.4%(图2),从回归感染后出现白点病症状鱼体中分离得到的菌株经鉴定与感染菌株一致。
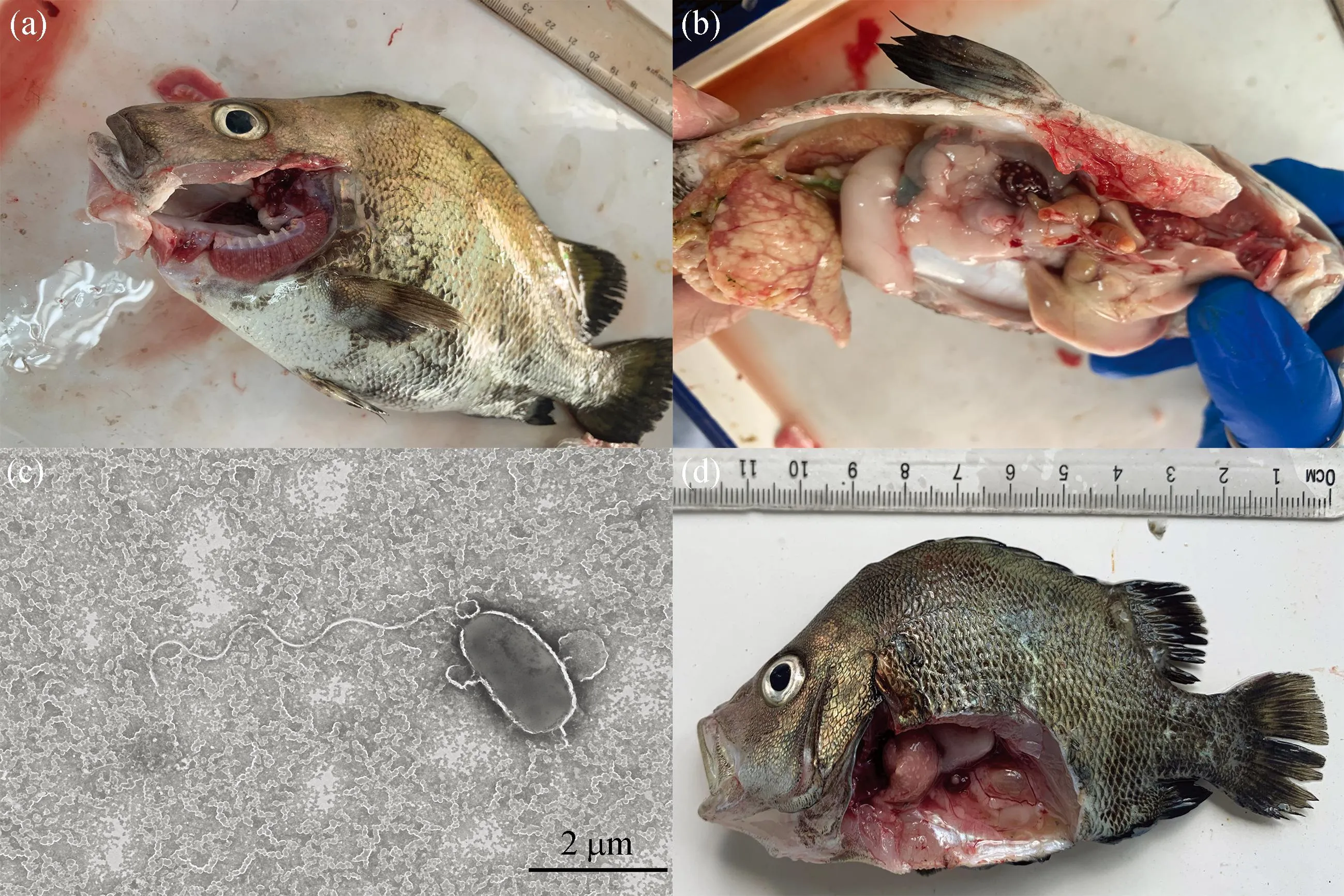
图1 斜带髭鲷白点病临床症状及分离菌株透射电镜图Fig. 1 Clinical symptom of white spot disease in Hapalogenys nitens and the transmission electron microscopy of isolated strains(a)自然感染病鱼鳃部白点,(b)自然感染病鱼脾脏白点,(c)hn-1菌株透射电镜图,(d)回归感染病鱼。
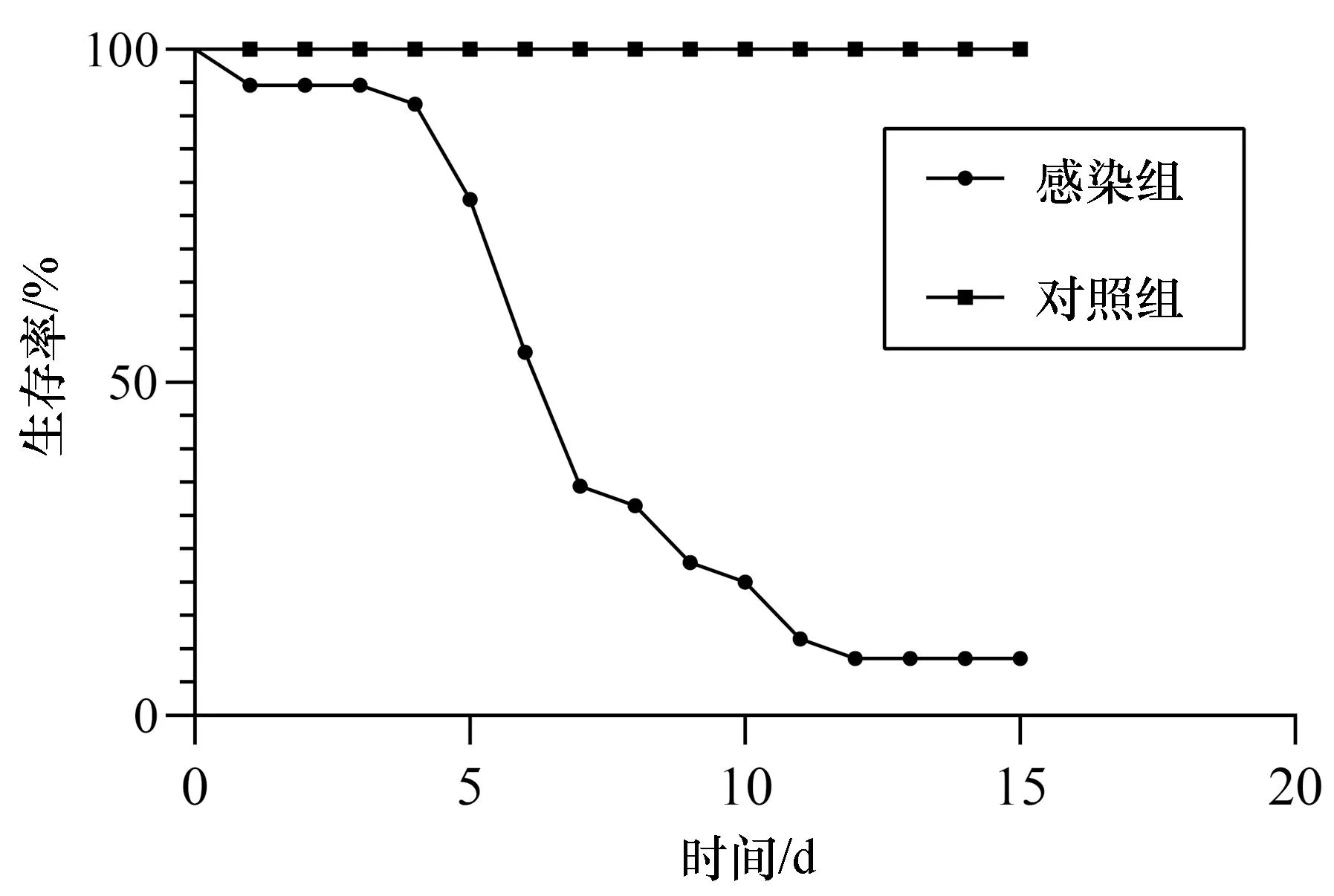
图2 哈维氏弧菌对健康斜带髭鲷回归感染试验结果Fig. 2 Results of the artificial infection test of Vibrio harveyi on healthy Hapalogenys nitens
2.2 系统发育分析
经测序获得分离菌株的16S rRNA序列,通过与NCBI数据库比对显示分离菌均为哈维氏弧菌。分离菌株的16S rRNA、dnaJ、gyrB基因序列与NCBI下载的基因序列进行系统发育分析,结果显示分离菌株与哈维氏弧菌聚为一类(图3~5)。由此可进一步表明,分离得到的hn-1菌株为哈维氏弧菌。

图3 哈维氏弧菌16S rRNA核苷酸序列的系统发育进化树Fig. 3 Phylogenetic relationship between the nucleotide sequences of 16S rRNA of Vibrio harveyi

图4 哈维氏弧菌dnaJ核苷酸序列的系统发育进化树Fig. 4 Phylogenetic relationship between the nucleotide sequences of dnaJ of Vibrio harveyi

图5 哈维氏弧菌gyrB核苷酸序列的系统发育进化树Fig. 5 Phylogenetic relationship between the nucleotide sequences of gyrB of Vibrio harveyi
2.3 生理生化鉴定
通过Biolog Gene III鉴定分离菌株,鉴定结果显示为哈维氏弧菌,菌株可分解多种糖和氨基酸,对葡萄糖、甘露糖、麦芽糖、丝氨酸、精氨酸和谷氨酸呈阳性,对肌醇呈弱阳性;耐受醋竹桃霉素、万古霉素、利福霉素等抗生素(表2)。与Biolog Gene III数据库标准菌株相比,分离株不可降解糊精和L-半乳糖醛酸内脂,对氨曲南敏感。
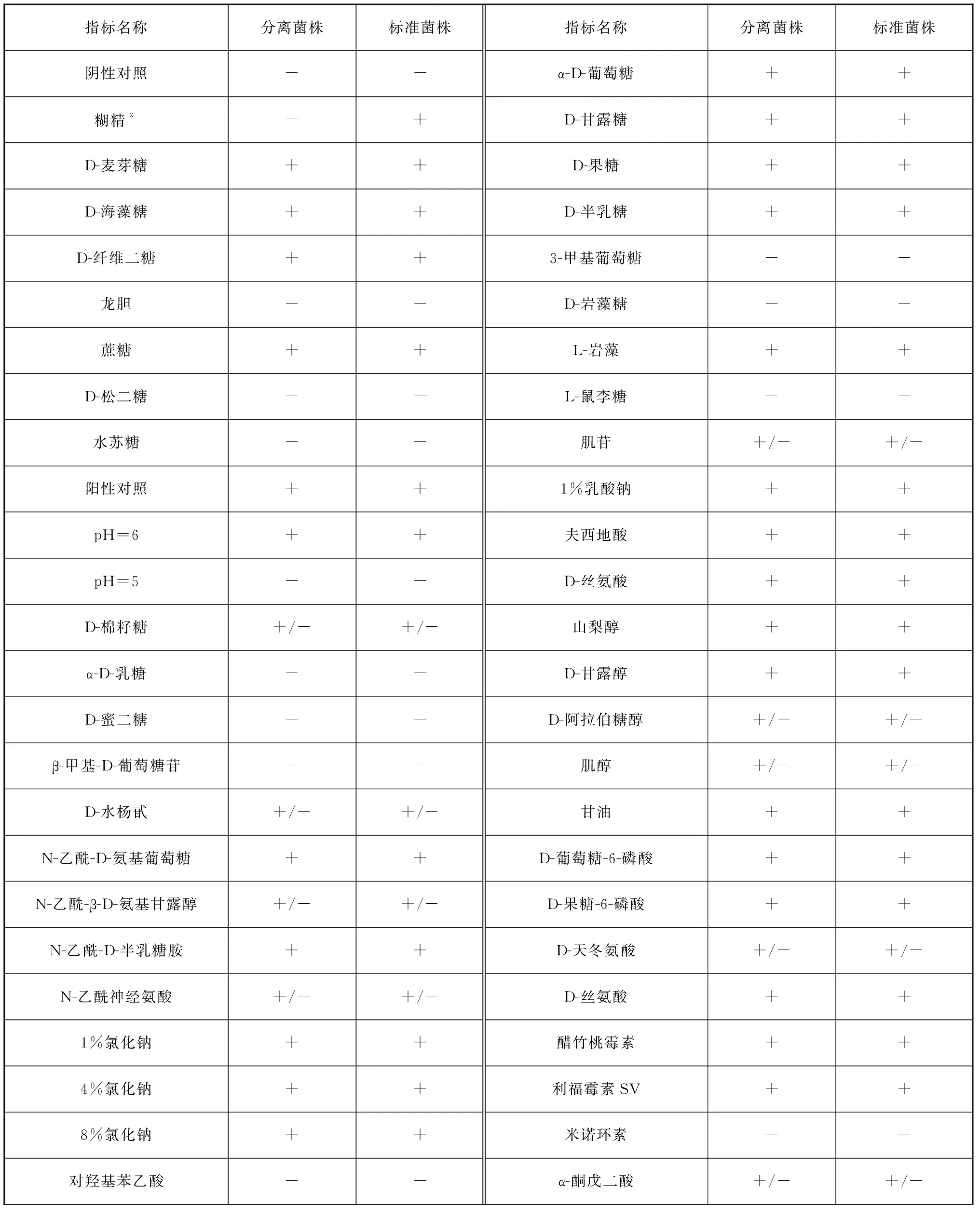
表2 分离菌株的生理生化特征Tab. 2 Physiological and biochemical characteristics of isolated strain
2.4 组织病理学变化
经组织切片观察,患内脏白点病的斜带髭鲷的肝脏、脾脏、鳃、头肾、心脏均可观察到明显炎性肉芽肿病灶部位,呈深紫色,近圆形(图6)。健康斜带髭鲷肝组织细胞形状较规则,肝细胞索清晰[图6(a)],患病鱼部分肝细胞严重坏死、萎缩成团,肝细胞界限模糊不清[图6(b)];健康鱼脾脏细胞密集相间,可见明显的髓状结构[图6(c)],患病鱼脾脏细胞结构疏松,病灶处形成致密细胞团,无髓状结构[图6(d)];健康鱼鳃丝结构清晰、排列规则[图6(e)],患病鱼鳃丝萎缩、溃烂卷曲,鳃丝末端形成细胞团[图6(f)];健康鱼头肾组织无结节,可见血管组织,血管中含红细胞[图6(g)],患病鱼头肾组织病灶处形成致密细胞团,无血管结构[图6(h)];健康鱼心脏组织结构清晰,分布规则[图6(i)],患病鱼病灶处心肌组织横纹消失,细胞坏死形成了结节[图6(j)]。
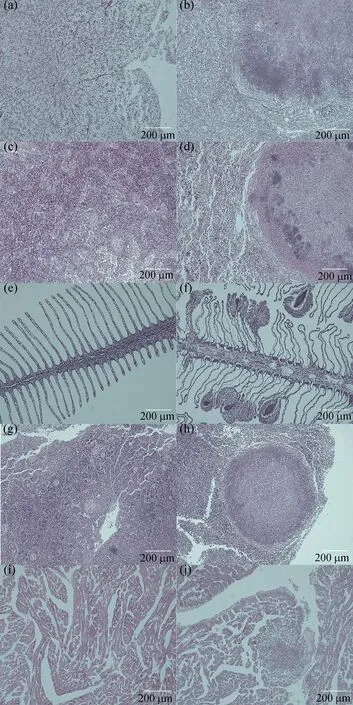
图6 斜带髭鲷组织器官病理切片图Fig. 6 Histopathological examination of Hapalogenys nitens(a)、(c)、(e)、(g)和(i)分别为健康鱼的肝、脾、鳃、头肾和心脏组织切片图,(b)、(d)、(f)、(h)和(j)分别为病鱼的肝、脾、鳃、头肾和心脏组织病理切片图。
2.5 分离菌株毒力基因携带情况
毒力基因检测结果如图7所示,hn-1菌株携带哈维氏弧菌典型毒力调控基因toxR、群体效应调节基因luxR和溶血素基因vhh,以及创伤弧菌溶血素基因vvh和副溶血弧菌耐热直接相关溶血素基因trh;不含金属蛋白酶基因vhpA和vhpB、锌金属蛋白酶基因pap6、霍乱弧菌溶血素基因hlyA和副溶血弧菌耐热直接溶血素基因tdh。
2.6 抗微生物药物敏感性试验结果
药敏纸片法测定抗生素药敏实验结果如表3所示,分离菌株对氨苄西林、青霉素、万古霉素、阿莫西林和多粘菌素B耐药,对红霉素中介,对四环素类(四环素、米诺环素、多西环素)、喹诺酮类(如诺氟沙星、恩诺沙星、左氧氟沙星等)、氨基糖苷类(如链霉素、新霉素等)等23种药物敏感。常用渔药MIC试验结果显示,盐酸多西环素对分离菌株的MIC值最低,为0.06 μg/mL,其次是氟甲喹,MIC值为0.125 μg/mL(表4)。
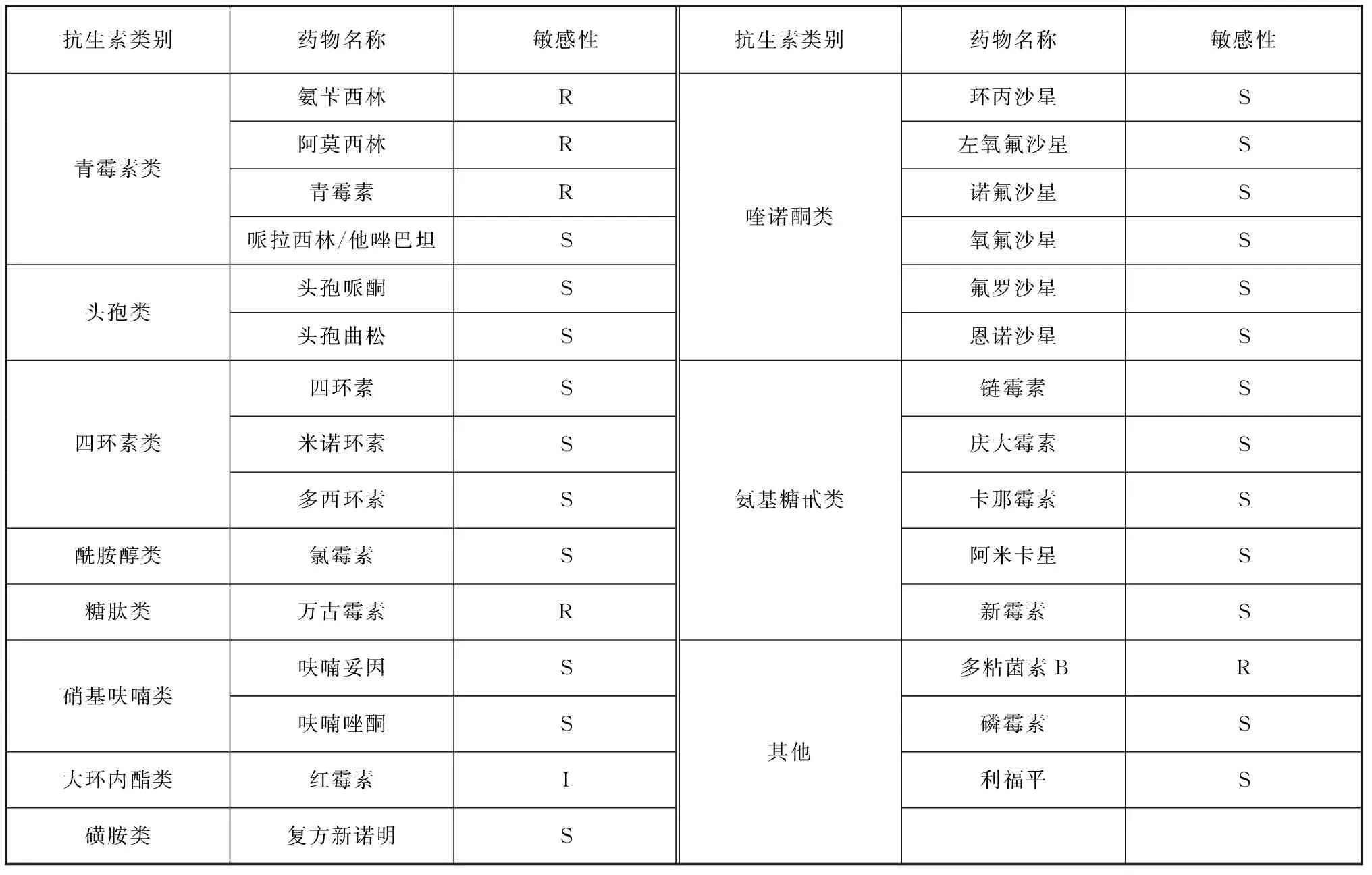
表3 纸片扩散法测定抗生素药敏结果Tab. 3 Results of antibiotic susceptibility determination by K-B method
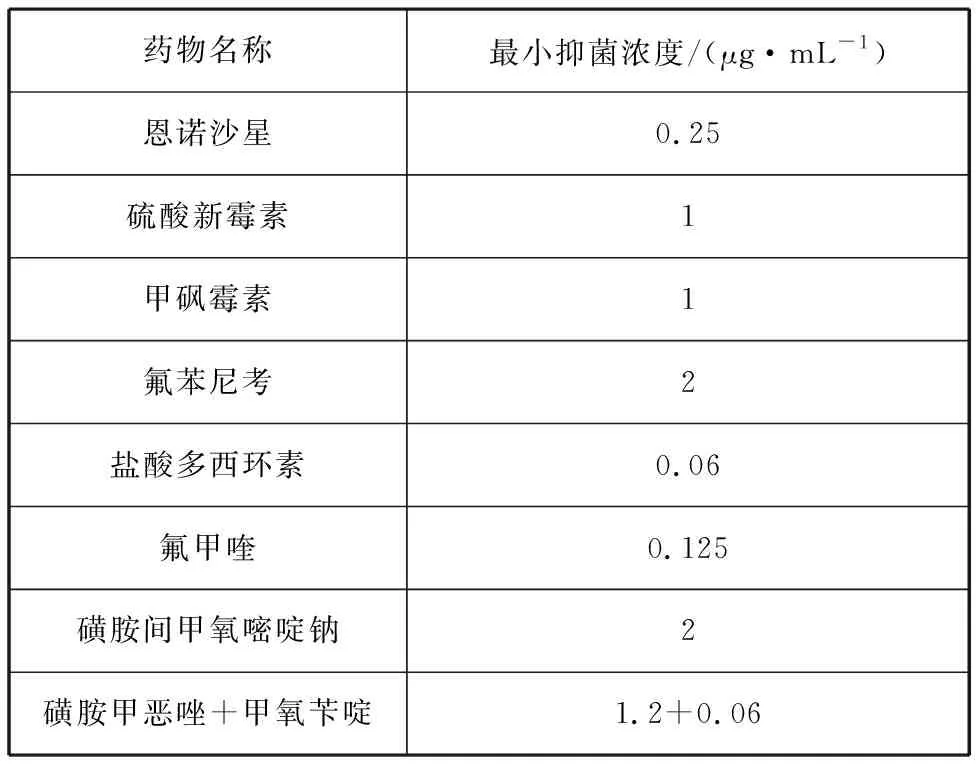
表4 常用渔药最小抑菌浓度测定结果Tab. 4 Determination results of MIC of common fishery drugs
3 讨论
哈维氏弧菌是一种常见的条件致病菌,广泛分布于养殖水体中,适盐范围较广,在淡水和海水中均可生存并感染宿主[16-17]。哈维氏弧菌的宿主范围广,可感染贝类[18]、甲壳类[17]和鱼类[19]等,在海水养殖的鱼类中,哈维氏弧菌感染可导致斜带石斑鱼(Epinepheluscoioides)、牙鲆(Paralichthysolivaceus)和军曹鱼(Rachycentroncanadum)等鱼类患病,其主要症状为肛门红肿、腹部鼓胀和腹腔积液[14]。也可感染引起双斑东方鲀(Takifugubimaculatus)、大菱鲆(Scophthalmusmaximus)、半滑舌鳎(Cynoglossussemilaevis)、线纹海马(Hippocampuserectus)、浅色黄姑鱼(Nibeacoibor)、豹纹鳃棘鲈(Plectropomusleopardus)等鱼类患病,其主要症状为皮肤溃烂[20-25]。哈维氏弧菌还可引起网箱养殖的鲈鱼发生内脏白点病,且病鱼的肝、脾和肾等多器官组织出现明显的白色结节症状[19]。可感染鮸鱼(Miichthysmiiuy)引起出血性溃疡病和内脏白点病[26]。本研究报道了哈维氏弧菌可导致斜带髭鲷患内脏白点病,扩大了哈维氏弧菌的天然宿主范围。
内脏白点病典型症状为解剖可见大量肉芽肿聚集形成的白色结节,在显微镜下可观察到病灶处有大量坏死细胞,肝、肾、脾为主要的病变组织[27]。鱼类白点病病灶组织分布广泛,本研究中患病的斜带髭鲷的肝、脾、鳃、头肾、心脏表面均有发现典型白色结节病灶,与鰤鱼诺卡氏菌(Nocardiaseriolae)感染卵形鲳鲹(Trachinotusovatus)引起的白点病患病部位相同[28]。经组织切片观察,病鱼内脏病灶部位组织坏死崩解,坏死细胞聚集成团形成白色结节,鳃丝溃烂卷曲、鳃小片细胞脱落,末端与邻近的鳃小片融合在一起呈棒状,与大黄鱼(Larimichthyscrocea)[29]、美国鲥鱼(Alosasapidissima)[27]、卵形鲳鲹[28]等鱼类白点病组织病理变化相似,是鱼类内脏白点病典型病理特征。由于不同病原菌导致发生内脏白点病病鱼发病症状和组织病理变化相似,需要进一步加强内脏白点病病原鉴定和监测。
细菌的毒力基因与其致病性密切相关,毒力基因可在不同菌株之间转移导致菌株毒力存在差异[30]。本研究中哈维氏弧菌hn-1菌株检测到3种典型毒力基因,分别为毒力调控基因toxR、群体效应调节基因luxR和溶血素基因vhh。toxR为表达调控类毒力因子,能调控多种毒力基因的表达[12];luxR是群体感应系统关键调节基因,可调节细菌的毒力因子表达、运动性和生物膜形成能力等毒力因子[31];溶血素基因可产生多种引起溶血作用的酶,是细菌的重要毒力因子之一[32]。吴立婷等对54株大黄鱼源哈维氏弧菌的毒力基因携带情况进行检测,结果显示,toxR、luxR和vhh的携带率分别达到75.9%、74.4%和64.8%[12];泥蚶(Tegillarcagranosa)源哈维氏弧菌J14和J19菌株也均携带上述3种毒力基因[30]。除了携带哈维氏弧菌溶血素基因vhh,hn-1菌株同时携带创伤弧菌溶血素基因vvh和副溶血弧菌耐热直接相关溶血素基因trh。hn-1菌株含有多种典型和外来毒力基因,其致病性可能由多种基因共同调控,毒力基因具体表达情况和调控机制有待进一步研究。
抗生素耐药性是细菌的一种自我保护机制,在抗生素的环境选择压力下,细菌可通过突变或基因水平转移等方式获得新的耐药性。抗生素的大量使用已经在全世界范围加剧了细菌耐药性的产生,积极开展细菌耐药性试验,有利于养殖过程中抗生素的合理使用,防止细菌耐药性的产生和发展[33]。本研究中分离的哈维氏弧菌菌株主要对青霉素类药物耐药,如氨苄西林、青霉素和阿莫西林;对糖肽类的万古霉素和多肽类的多粘菌素B也有耐药性;对喹诺酮类、氨基糖苷类、四环素类等药物具有较强的敏感性。分离菌株的耐药性与从许氏平鲉(Sebastesschlegelii)中分离的哈维氏弧菌P5W菌株[34]和泥蚶中分离的J14菌株[30]较为一致,但与P5W菌株对比,分离株hn-1仍保持对氨基糖苷类药物较高的敏感性。根据《水产养殖用药明白纸 2022 年 1、2 号》中批准使用的8种水产常用抗生素的MIC值检测结果,盐酸多西环素、氟甲喹和恩诺沙星的MIC值较低,生产上可采用这3种抗生素用于该病的防治。
4 结论
本研究通过对分离自患内脏白点病的斜带髭鲷的病原进行鉴定和分析,获得了如下结论:
(1)确认了哈维氏弧菌可引起斜带髭鲷内脏白点病,扩大了哈维氏弧菌的天然宿主范围。
(2)哈维氏弧菌hn-1菌株携带toxR、luxR、vhh、vvh和trh毒力基因,对喹诺酮类、氨基糖苷类、四环素类等药物具有较强的敏感性,该结果可为养殖斜带髭鲷内脏白点病的病害防治提供新的参考依据。

