一种甲壳动物血细胞分化因子性质的初步分析
李鸿钰,杨 丰,李 钫
(自然资源部第三海洋研究所,福建 厦门 361005)
甲壳动物是一个非常多样化的类群,多数生活在海洋中[1-2]。甲壳动物具有开管式循环系统[3-4],依靠天然免疫(也称“非特异性免疫”)来抵御病害。血细胞作为甲壳动物的主要免疫细胞,参与了吞噬、包囊、结节等细胞免疫过程,以及黑化、凝血和抗菌肽产生等体液免疫过程[2, 5-7]。甲壳动物血细胞根据其形态学特征通常分为3个类型,即透明细胞(hyaline cell,HCs)、半颗粒细胞(semigranular cell/small granular cell,SGCs)和颗粒细胞(granular cell/large granule cell,GCs);其中,HCs体积最小,核质比最大,胞内几乎不含颗粒;GCs体积最大,核质比最小,胞内充斥着大量颗粒;SGCs的体积大小、核质比及胞内颗粒的数量与尺寸都介于HCs和GCs之间。但红螯螯虾(Cheraxquadricarinatus)的循环血细胞主要为SGCs和GCs,HCs非常少见[8-9]。目前已知的SGCs特异性分子标记有pl-TGase1[10]、KPI[9]、hemolctin[11]、hcPcSPI2[12]、MjVRP[13]、CHF[14];GCs特异性分子标记有pl-TGase2[10]、SOD[9]、MBL[15]、Crustin1[11]、Peroxinectin[16]和MBP[16]。这些已知的特异性分子标记为研究血细胞的功能和分化提供了便利。
血细胞在免疫反应中会被消耗,需要及时补充。因此,活跃的造血能力对甲壳动物的生存至关重要。但与脊椎动物相比,人们对无脊椎动物的造血机制知之甚少。对十足目甲壳动物的研究显示,其造血组织(hematopoietic tissue,HPT)位于胃的背侧,是一层薄片状的组织,里面包裹着造血干细胞/前体血细胞[2,17-19]。有研究根据形态特征将螯虾HPT中的细胞分为了5种类型,其中1型细胞和2型细胞是增殖细胞,它们可以分化为SGCs和GCs;而3型、4型及5型细胞不具备分裂的能力,其中3型和4型细胞可能是GCs的前体细胞,而5型细胞可能是SGCs的前体细胞[20-21];该研究认为前体细胞在HPT中发育,随着被释放而变得成熟。但上述推论主要是基于细胞的形态学特征,并没有直接证据证明HPT细胞之间及它们与循环血细胞之间的关系。前期研究利用荧光标记和异体移植技术在螯虾体内追踪了血细胞的分化过程。结果发现几乎所有的血细胞都沿着GCs谱系发育分化,而SGCs只是代表了血细胞的未成熟阶段。前体血细胞在HPT中先经过3天左右的增殖和分化,随后以SGCs的形式被释放到循环中并继续其分化过程。循环中的幼稚血细胞最快可在一个月左右发育为GCs[16]。目前,已有几种蛋白被证明可能参与甲壳动物造血的调控。其中较为重要的是Astakine,该细胞因子在甲壳动物中存在两种亚型,分别是Astakine1和Astakine2。有研究者认为Astakine1具有诱导HPT细胞分化为SGCs的能力;而Astakine2与GCs分化成熟相关[14]。但在上述研究中,研究者主要是根据原代造血组织细胞的贴壁铺展和迁移情况来判断其是否分化,缺乏Astakine诱导细胞分化的直接证据。因此,究竟哪些因子在血细胞形成过程中起到调控作用还未可知。研究发现红螯螯虾的肌肉提取液(muscle extract, ME)可诱导体外培养的HPT细胞分化为成熟GCs[22],这一结果说明红螯螯虾的肌肉提取液中存在一种可诱导血细胞分化的因子。
为了探究螯虾体内血细胞分化因子的基本性质,为后期分离鉴定奠定基础,本研究以原代培养的螯虾HPT细胞作为测试诱导分化活性的体外模型,分析了该因子在不同动物体内的分布,并对其热稳定性、溶解性、带电性、对蛋白酶的耐受性及分子量大小范围进行了检测。
1 材料与方法
1.1 实验动物
红螯螯虾购自漳州原生态农业养殖场,饲养于25 ℃左右的环境,隔天换水喂食,检测无螯虾常见病原白斑综合症病毒(white spot syndrome virus, WSSV)和十足目虹彩病毒1(decapod iridescent virus 1, DIV1)。暂养一月再用于实验。
中华绒螯蟹(Eriocheirsinensis)、凡纳滨对虾(Litopenaeusvannamei)、红石斑鱼(Epinephelusgoreensis)及疣荔枝螺(Reishiaclavigera)均购自厦门市第八菜市场;东亚飞蝗(Locustamigratoriamanilensis)购自于淘宝。
1.2 肌肉提取液的制备
分别取5 g红螯螯虾、中华绒螯蟹、凡纳滨对虾、东亚飞蝗、疣荔枝螺或红石斑鱼的肌肉组织置于50 mL Leibovitz’s-15(L-15)培养基(Gibco公司)中冰浴匀浆;4 ℃,11 172 r/min,离心20 min;取上清液于56 ℃加热40 min;4 ℃,17 956 r/min,离心20 min;上清液用0.22 μm过滤器过滤除菌后保存在-20 ℃冰箱中。上述提取液将用于不同动物肌肉提取液诱导HPT细胞分化的实验。
取10 g红螯螯虾的肌肉组织置于100 mL超纯水中冰浴匀浆;4 ℃,11 172 r/min,离心20 min;取上清液于56 ℃加热40 min;4 ℃,17 956 r/min,离心20 min;上清液用0.22 μm过滤器过滤除菌后保存在-20 ℃冰箱中,上述提取液用于目标血细胞分化因子的热稳定性、溶解性、带电性等性质的分析。
1.3 红螯螯虾HPT细胞原代培养及诱导
按文献所述方法分离HPT细胞[23-24]:解剖取出HPT,用含双抗的CPBS(10 mmol/L Na2HPO4、10 mmol/L KH2PO4、0.15 mol/L NaCl、10 μmol/L CaCl2、10 μmol/L MnCl2、2.7 μmol/L KCl、pH 6.8)的溶液清洗5次;将HPT在0.2%的胶原酶溶液(用CPBS配制)中30 ℃消化30 min,期间每10 min轻轻摇晃30次;消化完毕用枪头轻吹HPT 30次,去掉大块组织;于室温2 000 r/min离心2 min,弃上清液;加入L-15培养基1 mL清洗一次;2 000 r/min离心2 min,弃上清后加入L-15重悬,用孔径为70 μm的细胞滤网过滤去除组织碎片;将游离的细胞以4×105个/孔的密度接种于48孔板中,27 ℃培养24 h后将培养基替换为诱导培养基或者阴性对照培养基。诱导培养基为:L-15+1% FBS + 1%双抗+不同动物的肌肉提取液(肌肉组织提取液按10%的比例加入培养基)或经不同处理过后的螯虾肌肉提取液;阴性对照培养基:L-15+1% FBS+1%双抗。每天观察细胞的状态,每7天更换一半培养液,分别在诱导后第0天(d)、7 d、14 d及21 d拍照记录细胞状态。每个实验重复3次,每次3组平行样。
1.4 GCs和SGCs的纯化
利用Percoll(GE Healthcare公司)密度梯度离心法纯化SGCs和GCs[25]。首先配制Percoll不连续密度梯度:以1∶10的比例向Percoll中加入1.5 mol/L NaCl即为100% Percoll;用50%抗凝剂将100% Percoll分别稀释成70% Percoll和20% Percoll;然后向流式管中依次加入270 μL 100% Percoll、2 mL 70% Percoll和1 mL 20% Percoll得到最终的密度梯度。用预冷的等体积抗凝剂抽取红螯螯虾血淋巴;在4 ℃下以1 727 r/min离心5 min收集血细胞,将血细胞以1×107个/mL的浓度重悬于抗凝剂当中。得到的细胞悬液(200 μL)缓慢加在预冷的Percoll密度梯度上,在4 ℃下以1 810 r/min离心30 min来分离细胞。离心之后,SGCs分布在20%和70% Percoll的分界面上,而GCs分布在70%和100% Percoll的分界面上。分别收集每个分界面上的细胞并用6~10倍体积的抗凝溶液稀释,4 ℃下2 064 r/min离心5 min收获细胞。通过流式细胞仪与光学显微镜检测纯度。
1.5 总RNA的提取和qRT-PCR分析
1.5.1 总RNA的提取
用Eastep®Super总RNA提取试剂盒(上海普洛麦格生物产品有限公司)提取RNA。离心收集纯化的SGCs和GCs,加入试剂盒中的RNA裂解液进行裂解。体外诱导培养的细胞分别在诱导后第0 d、7 d、21 d取样,每个时间点取3组平行样。移除培养基后直接在孔内加入RNA裂解液裂解细胞。最后均取8×105个裂解的SGCs、GCs及体外诱导培养的细胞,按试剂盒说明书提取总RNA,并通过DNase处理消除DNA污染。
1.5.2 qRT-PCR分析
以提取的总RNA为模板,使用HiScript®Ⅱ One Step qRT-PCR SYBR Green Kit (Vazyme)对目标基因的转录进行定量PCR检测,引物序列如表1所示。PCR程序为:50 ℃逆转录3 min;95 ℃预变性30 s;随后95 ℃/10 s,60 ℃/30 s扩增40个循环。反应完成后进行熔解曲线分析。以红螯螯虾β-actin作内参基因,以诱导后第0 d的表达量为1,根据2-ΔΔCt分析目标基因的相对表达量,用双尾检测进行组间差异的显著性分析。相对表达量以平均值±标准差表示,n=3。星号“*”表示两组相比具有显著性差异(“*”表示P<0.05,“**”表示P<0.01, “***”表示P<0.001)。
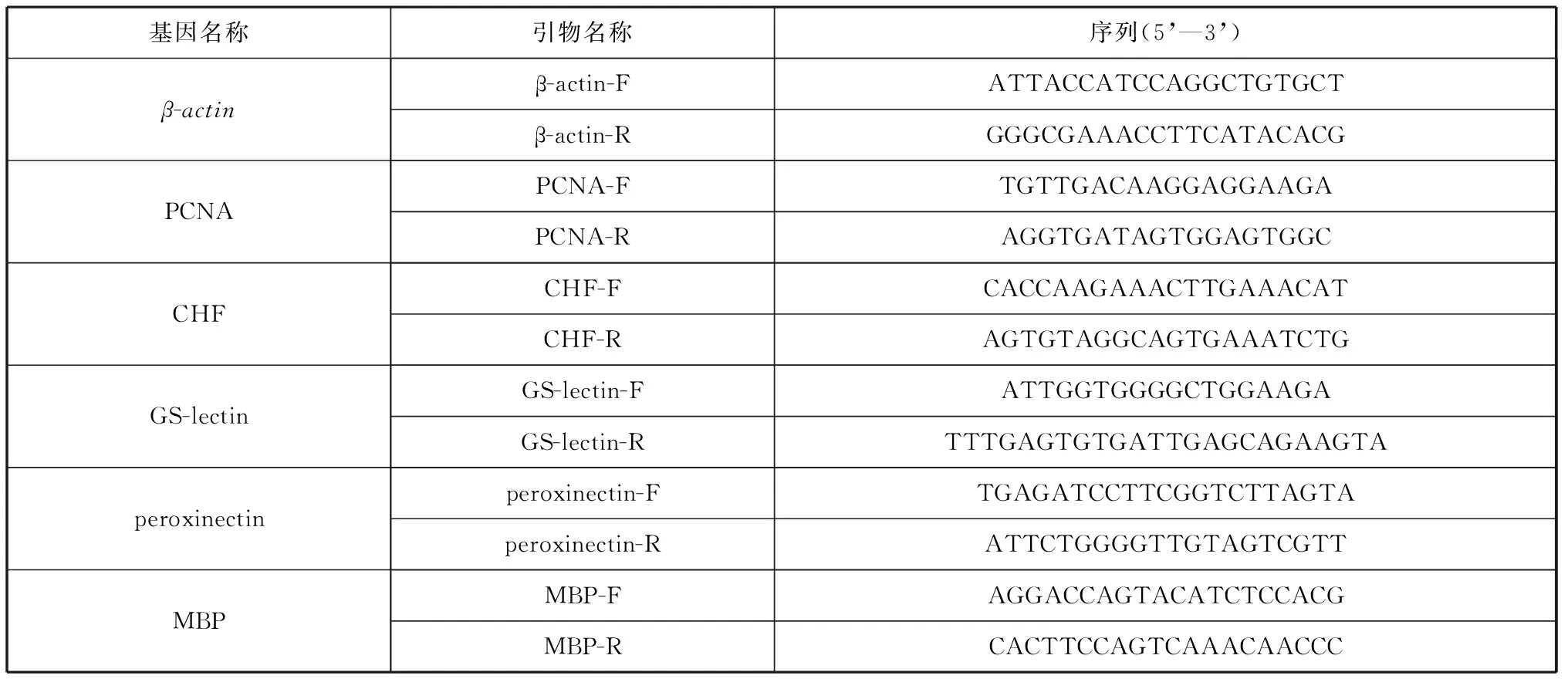
表1 qRT-PCR中使用的引物序列Tab. 1 Primer sequences used in qRT-PCR
1.6 血细胞分化因子的热稳定性分析
将用超纯水提取的红螯螯虾肌肉提取液在100 ℃水浴加热40 min;4 ℃,19 903 r/min,离心20 min;上清液过滤除菌后,作为添加剂加入培养基用来培养细胞,进行诱导分化活性测定。以未经高温处理的红螯螯虾肌肉提取液为阳性对照,仅添加1% FBS的L-15为阴性对照。实验重复3次,每次3组平行样。
1.7 血细胞分化因子的溶解性分析
将用超纯水提取的红螯螯虾肌肉提取液在49 ℃干燥;分别用500 mL甲醇、乙腈、丙酮对其进行萃取,然后过滤萃取液;过滤液在49 ℃蒸干,得到萃取物,用纯水溶解后作为添加剂加入培养基进行诱导活性检测。我们将添加了10%的肌肉提取液的细胞培养基中目标因子的浓度设为1×浓度。假设肌肉提取液中所有具有目标因子均被萃取到相应的有机溶剂中,据此对萃取物的使用浓度进行换算。将与添加10%的肌肉提取液培养基所对应的萃取物浓度设为1×浓度,设置1×、2×、5×、10×浓度梯度。以未经处理的红螯螯虾肌肉提取液为阳性对照,仅添加1% FBS的L-15为阴性对照。实验重复3次,每次3组平行样。
1.8 血细胞分化因子的带电性特性分析
取阴离子吸附介质Q Sepharose®High Perfor-mance (Pharmacia Biotech) 2 mL于吸附柱中并用纯水洗涤3次;取甲醇萃取物溶液10 mL,缓慢加入柱中;将流出液反复加入柱中3次,保留流出液继续进行阳离子吸附。
取2 g阳离子吸附介质Bio-Rex®70 Resin (Bio-Rad)放入吸附柱中并用纯水洗涤3次,将已过阴离子吸附柱的流出液缓慢加入柱中。重复3次,将保留流出液作为添加剂加入培养基培养细胞以检测活性。
如“1.7”所述,设置浓度梯度并设置阴性对照与阳性对照。实验重复3次,每次3组平行样。
1.9 血细胞分化因子的蛋白酶耐受性分析
羧肽酶A(Carboxypeptidase A, CPA,上海源叶生物科技公司)处理:取0.5 mL 50 mg/mL已过离子交换柱的甲醇萃取液置于1.5 mL离心管中,向内加入终浓度为5.7 U/mL CPA溶液,涡旋混匀,50 ℃孵育4 h;再次加入终浓度为11 U/mL CPA溶液,涡旋混匀,50 ℃孵育2 h后100 ℃加热15 min对CPA灭活;处理液放入-20 ℃保存,作为添加剂加入培养基用于诱导活性检测。
胰蛋白酶(Trypsin,上海生工生物工程有限公司)处理:取0.5 mL 50 mg/mL已过离子交换柱的甲醇萃取液置于1.5 mL离心管中,向内加入终浓度为0.6 mg/mL胰蛋白酶溶液,涡旋混匀,50 ℃孵育4 h;再次加入终浓度为1.2 mg/mL胰蛋白酶溶液,涡旋混匀,50 ℃孵育4 h后100 ℃加热15 min对胰蛋白酶灭活;处理液放入-20 ℃保存,作为添加剂加入培养基用来培养细胞用于诱导活性检测。
蛋白酶K(Proteinase K, PK, Amresco)处理方法:取1 mL 50 mg/mL已过离子交换柱的肌肉提取液置于1.5 mL离心管中,向内加入终浓度为0.1 mg/mL PK溶液,涡旋混匀,60 ℃孵育3 h;再次加入终浓度为0.2 mg/mL PK溶液涡旋混匀,60 ℃孵育2 h后100 ℃加热15 min,对PK灭活;处理液放入-20 ℃保存,作为添加剂加入培养基用于诱导活性检测。
如“1.7”所述,设置浓度梯度并设置阴性对照与阳性对照。实验重复3次,每次3组平行样。
1.10 血细胞分化因子分子量范围的确定
取4 mL 50 mg/mL已过离子交换柱的甲醇萃取液置于10 kDa超滤管(Milipore公司)中,4 ℃,7 498 r/min,离心30 min;将第一次滤出液的体积补足到4 mL,继续将其加入3 kDa超滤管(Milipore公司)中,4 ℃,6 526 r/min,离心30 min;将得到的第二次滤出液的体积补足到4 mL,继续将其加入1 kDa超滤管(Milipore公司)中,4 ℃,6 526 r/min,离心1 h;最后将得到的所有截流液和滤出液的体积都补足到4 mL后置于-20 ℃保存,后面作为添加剂加入培养基用于诱导活性检测。
如“1.7”所述,设置浓度梯度并设置阴性对照与阳性对照。实验重复3次,每次3组平行样。
2 结果与讨论
2.1 血细胞分化因子存在于多种动物的肌肉组织中
为了探究螯虾肌肉提取液中所含的血细胞分化因子是否也存在于其他动物体内,我们选择了节肢动物门中十足目的红螯螯虾、中华绒螯蟹和凡纳滨对虾,节肢动物门中直翅目的东亚飞蝗,软体动物门中新腹足目的疣荔枝螺和脊索动物门中鲈形目的红石斑鱼这6种动物,制备肌肉组织提取液,再以10%的比例加入培养基中对HPT细胞进行诱导。
结果(图1)显示,红螯螯虾肌肉提取液[图1(b)]、中华绒螯蟹[图1(c)]、东亚飞蝗[图1(d)]、红石斑鱼[图1(e)]、疣荔枝螺[图1(g)]、凡纳滨对虾[图1(f)]的肌肉提取液与均能诱导HPT细胞向着GCs分化,但不同动物肌肉提取液诱导分化的能力有差异。如图1所示,中华绒螯蟹、东亚飞蝗红螯螯虾的肌肉提取液的诱导能力较强。在以上3个诱导组中,HPT细胞在诱导后第7 d,细胞形态由最初的卵圆形变为梭形,细胞质中出现了一些细小的颗粒;诱导后第14 d,细胞内的颗粒数量增多体积变大,细胞形变程度加大;诱导后第21 d,细胞形态与GCs类似,呈梭形,细胞质内充满体积较大的颗粒。
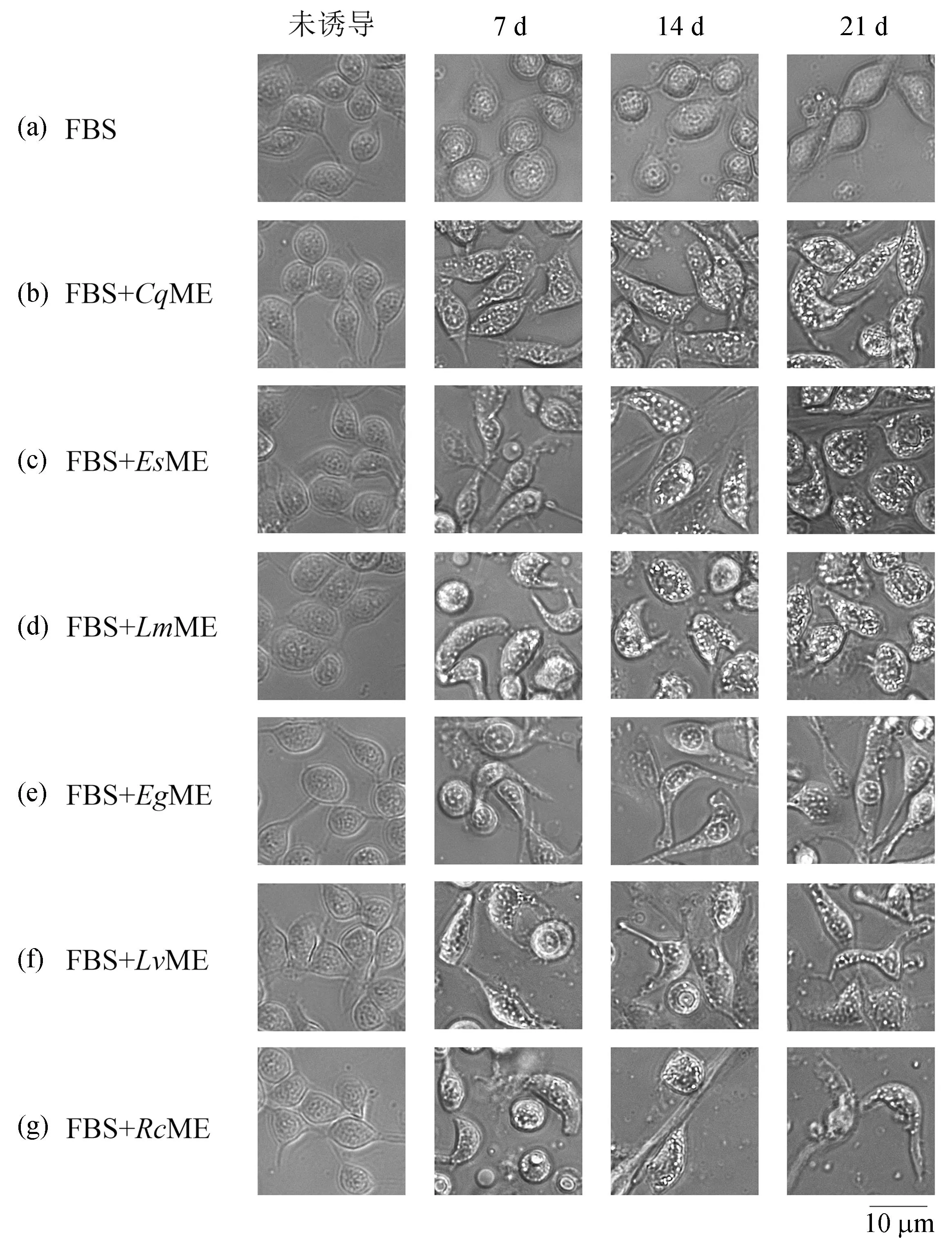
图1 红螯螯虾HPT细胞在被不同动物肌肉提取液诱导后细胞形态的改变Fig. 1 Morphology of C. quadricarinatus HPT cells induced by muscle extracts different animals图片自左至右分别是诱导前、诱导后第7 d、诱导后第14 d及诱导后第21 d的细胞形态;(a)未添加诱导剂培养的细胞;(b)至(g)为添加了不同肌肉提取液(分别为红螯螯虾、中华绒螯蟹、东亚飞蝗、红石斑鱼、凡纳滨对虾、疣荔枝螺)诱导培养的细胞,标尺为10 μm。
虽然疣荔枝螺和凡纳滨对虾的肌肉提取液也能诱导HPT细胞向GCs分化,但其诱导能力不及上述3种肌肉提取液。在诱导后的前7天,用疣荔枝螺和凡纳滨对虾的肌肉提取液诱导的HPT细胞的分化速度与用上述3种肌肉提取液诱导的HPT细胞分化速度类似,但在诱导后期分化速度变慢。诱导后第21 d细胞内的颗粒并不多。红石斑鱼肌肉提取液的诱导能力最弱,直至诱导后第21 d,细胞中的颗粒仍未充分发育。阴性对照组细胞在实验过程中无明显形态变化。
上述结果说明目标血细胞分化因子并不仅仅存在于红螯螯虾的肌肉组织当中,也存在于以上5种动物的肌肉组织中,是一种普遍存在的物质。根据细胞形态的改变速度推测这6种动物肌肉提取液诱导能力的强弱为:东亚飞蝗、中华绒螯蟹和红螯螯虾>凡纳滨对虾和疣荔枝螺>红石斑鱼。
2.2 血细胞诱导分化过程中标记基因的表达
为了确认细胞分化的情况,我们通过qRT-PCR分析了GCs、SGCs和HPT细胞标记基因在诱导过程中的表达。所用的分子标记有:HPT细胞分子标记(PCNA)[9],SGCs分子标记甲壳动物造血因子(crustacean hematopoietic factor,CHF)[14]、半乳糖特异性凝集素(galactose-specific lectin nattectin-like protein GS-lectin,数据未发表)和GCs特异性分子标记粘附因子(Peroxinectin)[16]、甘露糖结合蛋白(mannose-binding protein, MBP)[16]。实验中以纯化的SGCs和GCs作为对照。
PCNA作为HPT细胞的分子标记,在HPT细胞中的表达远高于SGCs和GCs。加入不同动物的肌肉提取液诱导后第7 d PCNA的表达量比诱导后第0天上升了2~3倍。随着诱导时间的增加,PCNA表达量逐渐下降(图2)。我们推测血细胞分化因子可能对HPT细胞的增殖具有一定的促进作用,因而PCNA表达量在诱导后有所上升;但随着诱导时间的增加,细胞逐渐走向分化,PCNA的表达量也随之逐步降低。
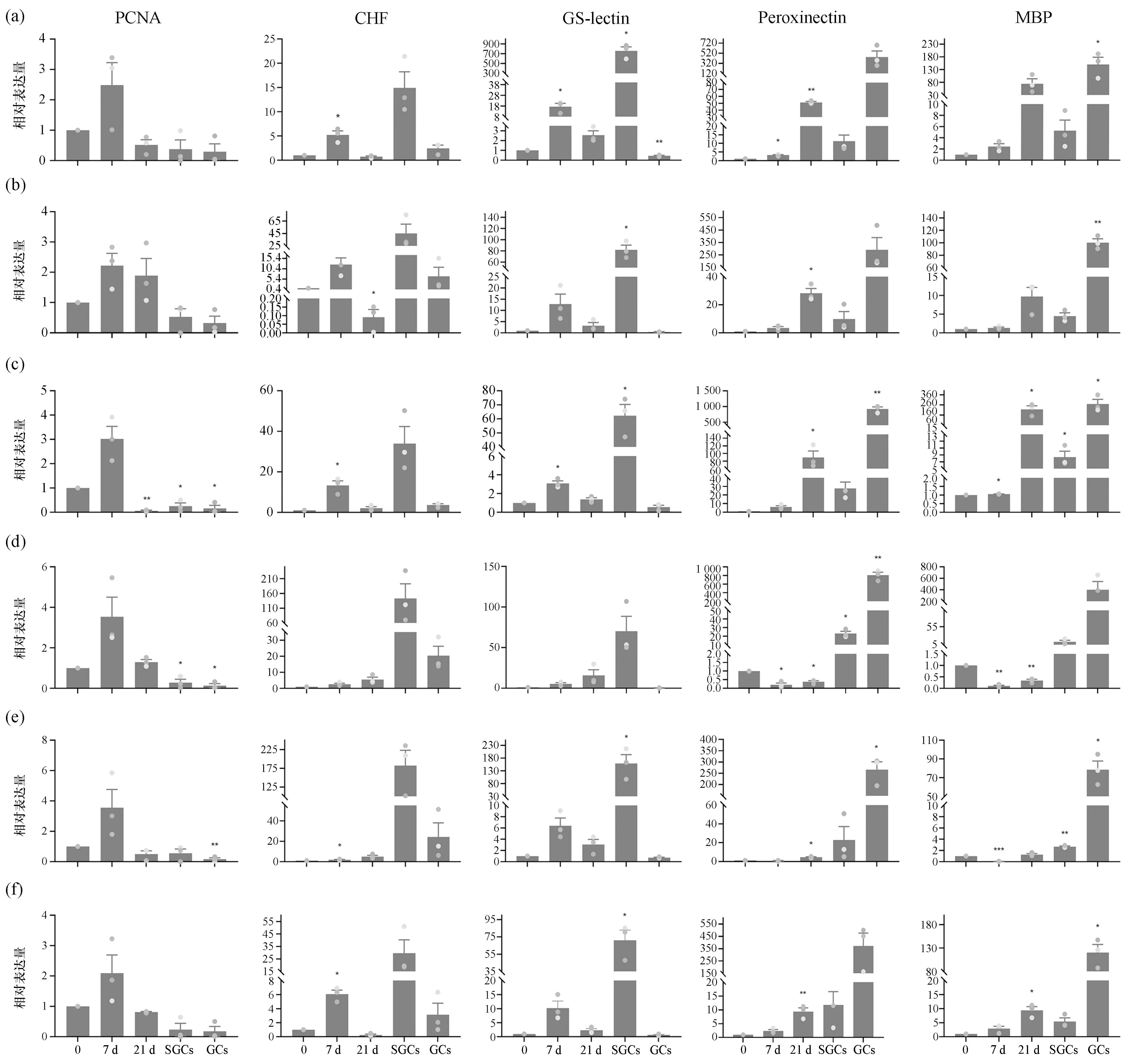
图2 qRT-PCR分析血细胞标记基因在诱导分化过程中的表达Fig. 2 qRT-PCR analysis of hemocyte marker gene expression in the cells induced by muscle extracts(a)红螯螯虾肌肉提取液;(b)中华绒螯蟹肌肉提取液;(c)东亚飞蝗肌肉提取液;(d)红石斑鱼肌肉提取液;(e)凡纳滨对虾肌肉提取液;(f)疣荔枝螺肌肉提取液。7 d:诱导后第7 d;21 d:诱导后第21 d。
在添加了红螯螯虾、中华绒螯蟹、东亚飞蝗的肌肉提取液的实验组中,CHF和GS-lectin的表达量基本在诱导后第7 d达到最高值,然后逐渐下降;CHF的表达量比诱导后第0 d分别上升了5倍、12倍和13倍;GS-lectin的表达量较诱导后第0 d分别上升了17倍、13倍和3倍。随着诱导时间的增长,Peroxinectin和MBP的表达量逐渐增加,到诱导后第21 d达到最高;Peroxinectin的表达量相较于诱导后第0 d分别上升了51倍、28倍和89倍;MBP的表达量相较于诱导后第0 d分别上升了74倍、11倍和216倍[图2(a)、(b)、(c)]。
在添加了疣荔枝螺肌肉提取液的实验组中,CHF、GS-lectin、Peroxinectin和MBP的变化趋势与上述3个实验组类似;但在诱导后第21 d Peroxinectin和MBP的表达量均不及上述3个实验组细胞内的表达量高[图2(f)]。
而在添加了红石斑鱼和凡纳滨对虾的肌肉提取液的实验组中,不论是SGCs的标记基因还是GCs的标记基因的表达时间均延后且表达水平低[图2(d)、(e)]。
根据上述结果,我们认为红螯螯虾、中华绒螯蟹、东亚飞蝗的肌肉提取液的诱导能力>疣荔枝螺肌肉提取液>凡纳滨对虾和红石斑鱼的肌肉提取液。这一结果与形态学特征的变化情况基本一致。综上所述,我们认为血细胞分化因子普遍存在于上述6种动物的肌肉组织中,但含量可能有所不同。
2.3 血细胞分化因子的热稳定性
根据上述实验,目标血细胞分化因子在螯虾肌肉提取液中含量较高,我们以螯虾肌肉提取液为实验材料,对目标血细胞分化因子的理化性质进行初步的分析。首先我们对目标物质进行了热稳定性分析:将红螯螯虾肌肉提取液100 ℃加热40 min后作为添加剂加入培养基进行分化诱导;以56 ℃处理的肌肉匀浆液作为阳性对照[22],以未添加诱导剂的培养基作为阴性对照。结果发现(图3),100 ℃加热并不能使目标血细胞分化因子失活。随着诱导时间的增长,高温处理组细胞与阳性对照细胞发生了类似的变化,细胞形态由最初的卵圆形逐渐呈现梭形,细胞质中逐渐出现颗粒,且颗粒的数量逐渐增多,尺寸也逐渐增大;阴性细胞几乎无变化。由此,目标血细胞分化因子是一种耐热性良好的物质。由于高温处理能使绝大部分蛋白质变性,因此我们基本排除了血细胞分化因子是蛋白质的可能性。
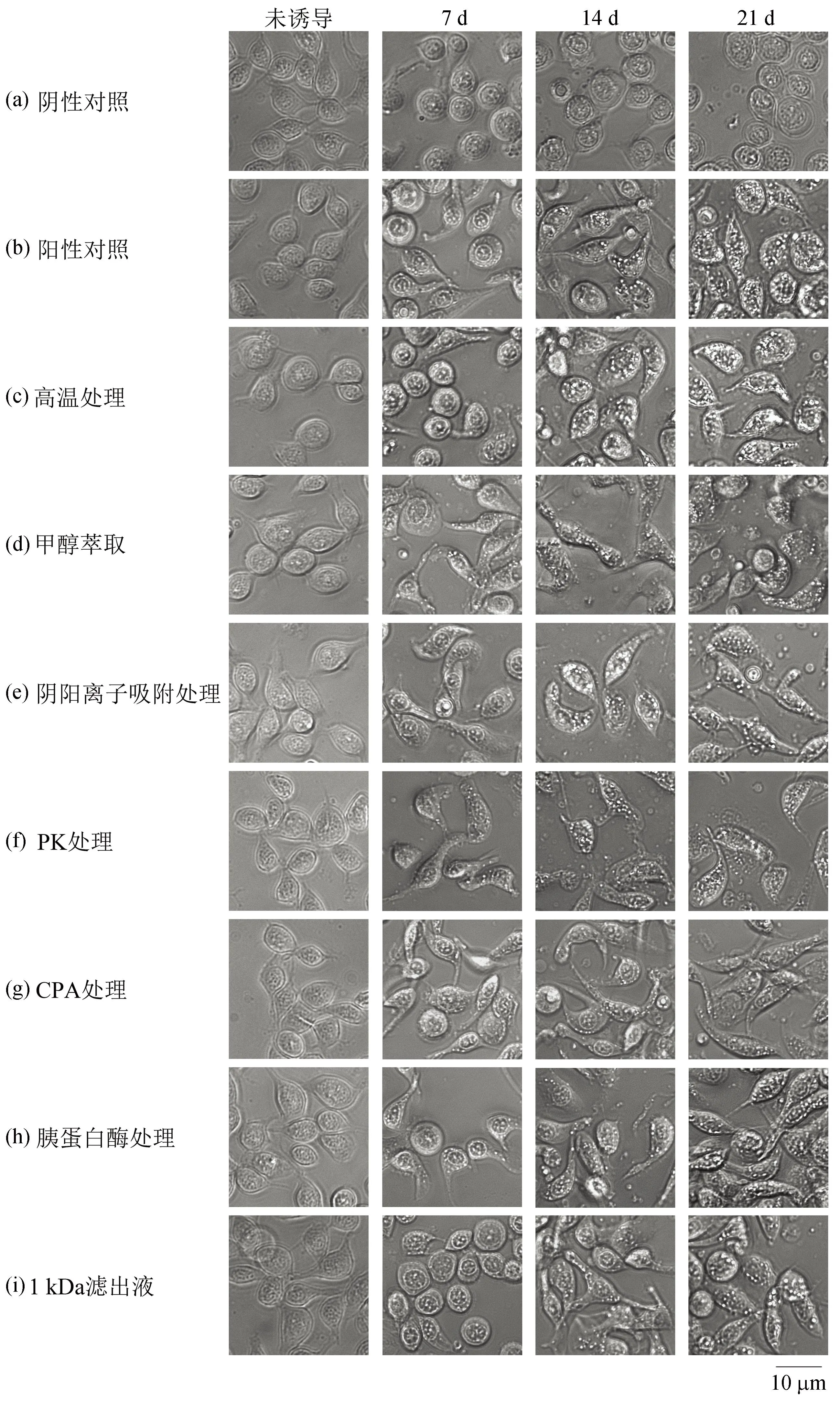
图3 红螯螯虾肌肉提取液经不同处理再诱导HPT细胞后细胞的形态改变Fig. 3 Morphological changes of HPT cells induced by muscle extract of C. quadricarinatus after different treatments图片自左至右分别是诱导前、诱导后第7 d、诱导后第14 d及诱导后第21 d的细胞形态;(a)仅添加1% FBS 培养的细胞;(b)添加56 ℃制备的红螯螯虾肌肉提取液培养的细胞;(c)至(i)为添加经不同处理后得到的提取液培养的细胞,标尺为10 μm。
2.4 血细胞分化因子的溶解性
了解血细胞分化因子在有机溶剂中的溶解情况,有助于后期分离纯化该因子时选择合适的萃取溶剂。我们将制备好的肌肉提取液干燥后分别用甲醇、乙腈和丙酮进行萃取;经处理后得到了有机溶剂萃取物的水溶液,并测试其诱导HPT细胞分化的活性。结果发现,添加甲醇萃取物的细胞出现了类似阳性对照组细胞的变化,即到诱导后第21 d时细胞的形态呈梭形且胞质中有许多较大的颗粒[图3(d),图片所示为甲醇萃取液培养的HPT细胞,其浓度为5×浓度];且HPT细胞分化的速度会随着甲醇萃取物浓度升高而加快(表2)。而添加乙腈萃取物、丙酮萃取物的细胞和阴性细胞均未发生明显改变(结果未显示)。这证明了该血细胞分化因子易溶于甲醇,不易溶于乙腈和丙酮。
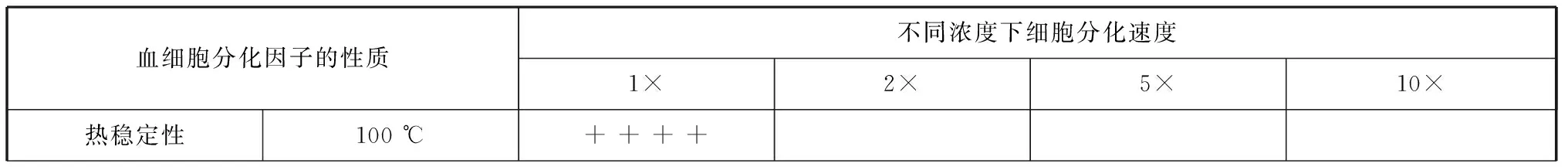
表2 血细胞分化因子的基本理化性质Tab. 2 Physiochemical properties of hemocytes differentiation factor
2.5 血细胞分化因子的带电性
为了解目标血细胞分化因子的带电性,我们将肌肉提取液的甲醇萃取物依次经阴离子交换柱和阳离子交换柱吸附,收集流出液及两个离子交换柱的洗脱液,并测试其诱导分化活性。设置浓度梯度,以10%肌肉提取液培养的细胞作为阳性细胞,以未添加诱导剂的培养基作为阴性对照。结果发现[图3(e),图片所示为5×浓度诱导的HPT细胞],添加流出液进行培养的细胞与阳性细胞在诱导培养的过程中细胞形态发生类似的变化;它们逐渐向着GCs分化。诱导速度随浓度上升(表2)。而阴性细胞与添加两种洗脱液培养的细胞均无明显变化。这说明了目标血细胞分化因子在水溶液中呈电中性。
2.6 血细胞分化因子对蛋白酶的耐受性
为了确定血细胞分化因子对蛋白酶的耐受性,我们分别用PK、CPA及胰蛋白酶对肌肉提取液进行处理。用蛋白酶处理后的肌肉提取液诱导HPT细胞,以未处理的肌肉提取液培养的细胞作为阳性对照,以未添加诱导剂的培养基作为阴性对照。结果发现[图3(f)、(g)、(h)],图片所示为5×浓度诱导的HPT细胞),添加经3种不同蛋白酶处理后的肌肉提取液仍然可以诱导HPT细胞向着GCs分化,即细胞发生形变且在胞内产生了大量颗粒,这一结果与阳性细胞的变化情况一致。诱导速度随浓度加快(表2)。阴性组细胞未发生明显变化。这表明血细胞分化因子可耐受蛋白酶处理。
2.7 血细胞分化因子的分子量
为了确定血细胞分化因子分子量的范围,我们分别使用大小为10、3、1 kDa的超滤管将肌肉提取液进行分离。分成分子量范围>10 kDa、>3~10 kDa、1~3 kDa、<1 kDa的4组添加剂用于培养HPT细胞并设置浓度梯度,同时设置阴性对照与阳性对照。结果发现[图3(i),图片所示为添加了经1 kDa超滤管离心后得到的滤出液培养的HPT细胞,其浓度为5×浓度],添加分子量<1 kDa培养液培养的细胞出现了与阳性细胞相似的变化;且细胞分化的速度随着浓度升高而加快(表2)。阴性细胞、添加分子量>10 kDa与分子量>3~10 kDa培养液培养的细胞中几乎未发生变化。虽然用添加了分子量1~3 kDa培养液培养的细胞有分化的迹象,但细胞分化速度和程度远不如前者(结果未显示)。以上结果表明,目标血细胞分化因子的分子量<1 kDa。
由上述实验分析获得的这些基本的理化性质(表2),我们可以确定目标血细胞分化因子易溶于甲醇,呈电中性,分子量小于1 kDa,具有良好的热稳定性,且可耐受蛋白酶处理。由此,我们推测目标血细胞分化因子可能并非蛋白质或者直链小肽,更可能是某种小分子不带电的物质。上述结果为目标血细胞分化因子的分离鉴定提供了参考。根据上述性质,在对目标血细胞分化因子的分离纯化中,可采用100 ℃加热或者酶处理法除去肌肉提取液中绝大多数的蛋白质。然后通过甲醇萃取、阴阳离子交换柱层析和凝胶过滤法进一步纯化目标物质。
已被报道具有诱导细胞分化的效应因子有外泌体[26]、血小板衍生生长因子BB[27]、肝细胞生长因子[28]与成纤维生长因子[29]等。但这些效应物的实质大多为蛋白质,并不符合血细胞分化因子具有良好的耐热性且耐受蛋白酶处理这些特质。值得注意的是,近些年关于氨基酸代谢的研究越来越多,有研究表明苏氨酸和蛋氨酸的分解代谢是胚胎干细胞(ESC)生长和分化所必需的[30]。非必需氨基酸会促进人诱导多能干细胞(hiPSCs)向神经谱系的分化[31]。氨基酸等小分子物质基本符合血细胞分化因子的性质,有可能是我们寻找的血细胞分化因子。
3 结论
在本研究中,我们通过向体外培养的HPT细胞中添加不同动物的肌肉提取液观察细胞的分化情况及检测细胞分化过程中HPT细胞标记基因、SGCs标记基因和GCs标记基因的表达量,发现血细胞分化因子存在于红螯螯虾、中华绒螯蟹、东亚飞蝗、凡纳滨对虾、疣荔枝螺和红石斑鱼的肌肉组织中,但该血细胞分化因子的含量在不同动物体内有所差异。进一步我们以螯虾肌肉提取液为实验对象,分析了血细胞分化因子的理化特性,结果发现该血细胞分化因子易溶于甲醇,呈电中性,具有良好的热稳定性,且可耐受蛋白酶处理,分子量小于1 kDa。由此,我们推测血细胞分化因子是一种广泛存在的小分子类物质。我们的研究为将来分离和鉴定该血细胞分化因子奠定了基础。

