多交叉置换扩增联合纳米生物传感器技术对低病毒载量慢性乙型肝炎人群快速诊断价值
贺潇瑾, 周 娟, 龙云铸, 李 丹, 欧阳静, 袁 婷, 卿 玲, 谭英征
中南大学湘雅医学院附属株洲医院 感染内科,湖南 株洲 412006
慢性乙型肝炎病毒(hepatitis B virus,HBV)感染是一个重大的全球公共卫生问题,可导致病毒性肝炎、肝纤维化、肝硬化乃至原发性肝细胞癌的发生[1]。明确诊断后积极抗病毒治疗可有效抑制HBV DNA的复制,并最大程度减轻肝细胞坏死、炎症及纤维化、肝小叶增生等,是延缓疾病进展及改善预后的有效手段[2]。但有临床研究发现,20%~40%长期规律接受一线核苷(酸)类似物治疗的患者仍处于低病毒血症状态(low level viremia,LLV)[3],即采用灵敏的定量聚合酶链反应法(quantitave polymerase chain reaction,qPCR)检测血清HBV DNA持续或间歇大于检测下限但低于2 000 IU/ml[4]。LLV可导致耐药风险增加、病毒学突破、肝纤维化进展、肝硬化进展、肝癌风险增加等一系列临床危害[5],因此,开发新的技术以提高检测HBV的灵敏度和特异性对于指导低病毒载量慢性乙型肝炎人群的临床管理至关重要,也有助于实现最终达到治愈乙型肝炎的目标。多交叉置换扩增(multiple cross displacement amplification,MCDA)是一种新型扩增技术,能够在恒温条件下快速、敏感、特异地扩增核酸,明显提高检测效率[6]。近年来,MCDA已被用于检测许多病原体,如结核分支杆菌[7]、脓肿分枝杆菌[8]、李斯特菌[9-10]、脑膜炎奈瑟菌[11]、布鲁氏菌[12]、白色念珠菌[13]等。MCDA产物可以通过多种技术进行分析,包括琼脂糖凝胶、浊度法、比色法及纳米生物传感器(nanoparticle-based lateral biosensor,LFB)等。其中,LFB是一种特异的核酸检测装置,其根据MCDA的阳性产物可以在1~2 min内显示结果,阴性表现为一条线,阳性为两条线,直接肉眼观察即可判断。既往研究表明,MCDA联合LFB具有相对特异、敏感、经济、快速、简单等特点[7,9-13]。本研究以HBV S基因为靶标,拟应用MCDA-LBF技术建立一种针对HBV的简单、快速、经济、有效的诊断方法,同时比较MCDA-LBF与qPCR对临床实际样本的检测能力,以评估MCDA-LFB检测HBV的应用价值。现报道如下。
1 对象与方法
1.1 研究对象 选取株洲市中心医院自2020年4月至2022年4月收治的42例拟联合聚乙二醇干扰素α-2b(pegylated interferon alpha-2b,Peg-IFNα-2b)抗病毒治疗的核苷(酸)类似物经治低病毒载量慢性乙型肝炎患者和同期的15例健康受试者为研究对象。慢性乙型肝炎符合《慢性乙型肝炎防治指南(2019年版)》[1]诊断标准,排除合并其他嗜肝病毒感染和人类免疫缺陷病毒感染。所有研究对象均签署知情同意书。本研究经医院伦理委员会批准。
1.2 检查方法 所有研究对象分别于联用Peg-IFNα-2b抗病毒治疗前、治疗24周后、治疗48周后空腹采集静脉血5 ml,分离血清后-80℃低温保存备用。所有血样标本分别采用MCDA-LFB和qPCR两种方法进行HBV DNA平行检测。
1.3 主要试剂及仪器 HBV和丙型肝炎病毒(hepatitis C virus,HCV)核酸标准物质(北京擎科生物科技有限公司);DNA核酸提取试剂盒(西安天隆科技有限公司);超敏HBV DNA荧光定量试剂盒(湖南圣湘生物科技有限公司);MCDA核糖核酸扩增试剂盒和纳米生物传感检测条(天津捷易特生物科技有限公司);孔雀石绿(malachite green,MG)比色指示剂(北京海泰正元科技有限公司);引物合成(北京擎科生物科技公司);实时荧光聚合酶链反应(polymerase chain reaction,PCR)扩增仪(美国ABI公司);实时浊度仪和Nano drop 2000分光光度计(美国Bio-Rad公司)。
1.4 MCDA-LFB 严格按照操作说明书进行实验,采用DNA核酸提取试剂盒提取DNA模板,通过Nano drop 2000进行定量后,保存于-20℃冰箱待检。参考相关资料,采用PRIMER PRIMER 5.0软件设计10条引物(表1),采用BLAST分析工具验证HBV-MCDA引物的特异性,引物合成后用高效液相色普级别纯化。HBV-MCDA反应体系为25.0 μl,其中包含反应缓冲液12.5 μl,1.0 μl BstDNA聚合酶(8 U),扩增引物CP1和CP2各40.0 pmol,C1、D1、R1、C2、D2、R2各20.0 pmol,F1和F2各10.0 pmol,以及1.0 μl DNA模板。将以上混合物置于实时浊度仪中,65℃恒温扩增30 min,阈值>0.1视为阳性扩增。实验中用HBV核酸标准品为阳性对照,HCV核酸标准品为阴性对照,蒸馏水为空白对照。为验证HBV-MCDA的敏感性,将HBV核酸标准物质分别稀释为5.0 IU/ml、0.5 IU/ml。扩增产物采用比色指示剂(MG)和LFB两种方法进行检测及验证。对于MG检测,反应体系的颜色由无色变为浅绿色表明阳性扩增,颜色保持无色为阴性扩增。在LFB检测中,对照线和检测线同时出现为阳性扩增,仅出现对照线为阴性扩增。上述实验均重复进行3次。

表1 HBV-MCDA引物信息
1.5 统计学方法 采用SPSS 26.0统计学软件对数据进行处理。计数资料以例(百分率)表示,组间比较采用χ2检验。一致性分析采用Kappa检验。以P<0.05为差异有统计学意义。
2 结果
2.1 HBV-MCDA产物检测及验证 稀释为5.0 IU/ml的HBV核酸标准物质为阳性扩增结果,而稀释为0.5 IU/ml的HBV核酸标准物质、HCV核酸标准物质、蒸馏水为阴性结果。见图1。本研究用于HBV S基因检测的HBV-MCDA引物对于建立HBV-MCDA检测方法的特异性良好,HBV-MCDA的最低检测下限为5.0 IU/ml。
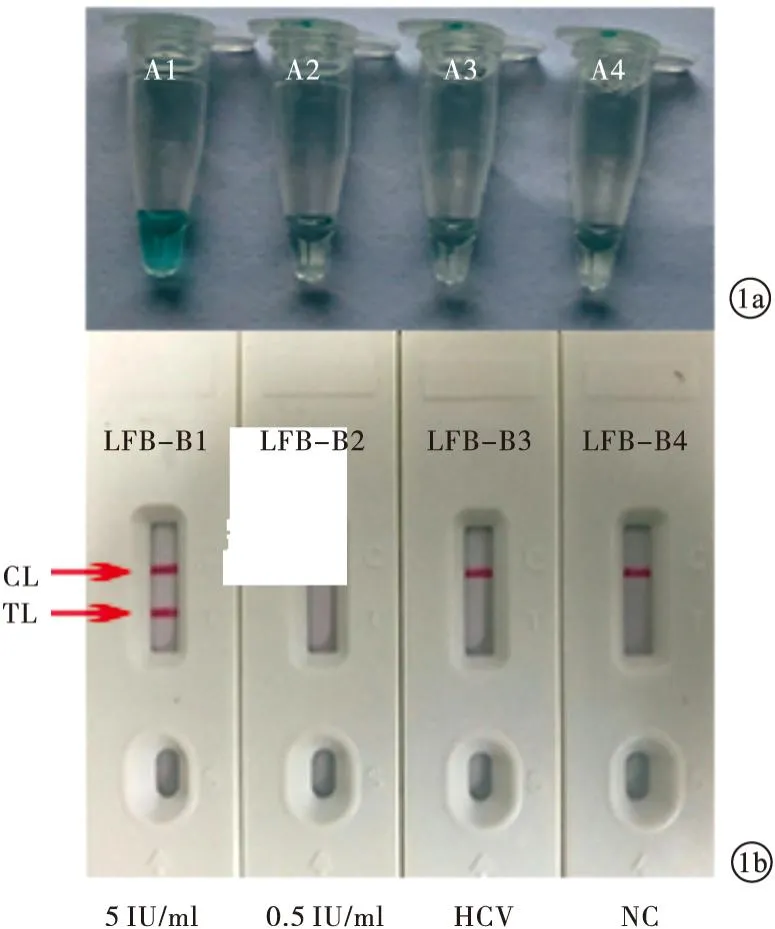
图1 HBV-MCDA产物检测及验证[a.HBV-MCDA扩增产物采用比色指示剂(MG)肉眼观察颜色变化进行分析:A1管为HBV核酸标准物质阳性扩增(稀释为5.0 IU/ml),A2管为HBV核酸标准物质阴性扩增(稀释为0.5 IU/ml),A3管为HCV核酸标准物质阴性对照(稀释为0.5 IU/ml),A4管为蒸馏水空白对照(稀释为0.5 IU/ml);b.LFB对HBV-MCDA扩增产物的可视化检测:LFB-B1为HBV核酸标准物质阳性扩增(稀释为5.0 IU/ml),LFB-B2为HBV核酸标准物质阴性扩增(稀释为0.5 IU/ml),LFB-B3为HCV核酸标准物质阴性对照(稀释为0.5 IU/ml),LFB-B4为蒸馏水空白对照(稀释为0.5 IU/ml)]
2.2 联合Peg-IFNα-2b治疗前病毒载量检测结果比较及一致性分析 MCDA-LFB、qPCR两种方法检测的HBV DNA下限分别为5 IU/ml、20 IU/ml。因此,本实验规定HBV DNA>20 IU/ml为检测结果阳性,反之为阴性。在57例样本的基线HBV DNA平行检测中:MCDA-LFB检出阳性标本42例,阳性检出率为73.7%(42/57),阴性检出率为26.3%(15/57);qPCR检出阳性标本38例,阳性检出率为66.7%(38/57),阴性检出率为33.3%(19/57)。见表2。两种方法的阳性检出率比较,差异无统计学意义(P=0.125)。进一步行一致性分析,结果显示,Kappa=0.833,P<0.001,说明两种方法的诊断结果存在较好的一致性。

表2 MCDA-LFB、qPCR检测临床样本的基线HBV DNA结果比较/例
2.3 联合Peg-IFNα-2b治疗不同阶段病毒载量检测结果比较及一致性分析 在治疗24周后,MCDA-LFB阳性检出率为49.1%(28/57),qPCR阳性检出率为7.0%(4/57),MCDA-LFB阳性检出率高于qPCR,差异有统计学意义(P<0.001);Kappa=0.295,P=0.035,提示两种方法存在一致性,但一致性情况较基线水平(Kappa=0.833,P<0.001)明显下降。在治疗48周后,MCDA-LFB阳性检出率为33.3%(19/57),qPCR阳性检出率为3.5%(2/57),MCDA-LFB阳性检出率高于qPCR,差异有统计学意义(P<0.001);Kappa=0.136,P=0.042,提示两种方法一致性成立,但一致性情况较差。
3 讨论
虽然乙型肝炎疫苗已在全球普及,但HBV感染及其所致的相关肝病仍是我国乃至全世界需要攻克的一大难题。HBV感染肝后,病毒的持续复制是导致疾病进展的重要原因,因此,HBV的检测对于抗病毒治疗的决策及长期疾病进展的监测至关重要。目前,酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)和PCR相关技术是临床上应用广泛的HBV鉴定方法[14]。ELISA是基于针对HBV抗原或抗体的血清学反应,只能反映HBV的免疫应答状态,且在感染的早期阶段敏感性较低;qPCR检测HBV DNA具有灵敏度高、特异性好的特点,现已成为监测HBV复制最常用的检测手段之一[15]。但qPCR需要依赖昂贵的热循环仪器来扩增靶基因,且检测繁琐、耗时,在许多资源有限的地区无法广泛开展。本研究建立了一种简单、低成本、敏感性和特异性均较好的MCDA-LFB方法来检测HBV。
MCDA技术根据目标基因序列保守区域设计10条引物特异性识别靶序列上的10个独立区域,在恒温条件下(约58℃~69℃),在一种置换酶聚合酶的作用下,短时间内(15~40 min)引起多循环链置换反应,大量合成目标DNA[16],因此,反应特异性强,且快速、敏感。LFB具有较高的生物相容性、吸附性及反应活性,被广泛用于检测一些病原体的MCDA产物[17]。相较于琼脂凝胶电泳、浊度分析和比色指示剂检测,LFB可以更加客观、准确且快速地判断出结果。本研究参考了相关文献及设备[18],根据MCDA作用机制设计了10条HBV-MCDA引物,特异性识别HBV S基因10个区域,在65℃恒温扩增30 min,通过比色法及LFB分析扩增结果。结果显示:稀释为5.0 IU/ml的HBV核酸标准物质为阳性扩增结果,而稀释为0.5 IU/ml的HBV核酸标准物质、HCV核酸标准物质、蒸馏水为阴性结果;本研究用于HBV S基因检测的HBV-MCDA引物对于建立HBV-MCDA检测方法的特异性良好,HBV-MCDA的最低检测下限为5.0 IU/ml。目前,我院已开展的高敏qPCR检测HBV DNA最低下限是 20 IU/ml,检测时间约2~3 h,费用较高。相比之下,HBV的MCDA-LFB检测方法不仅操作时间短,所有流程在1 h内能够实现,而且所需的设备较为简单,提供恒温设备即可实现此项技术的应用,成本相对较低,同时,该项检测具备较高的特异性和更高的敏感性,因此,对于临床上提高HBV感染的诊断率、降低漏诊率具有极大的辅助作用。
在慢性乙型肝炎患者抗病毒治疗过程中,每个个体治疗应答情况不尽相同,有临床研究证实,部分慢性乙型肝炎患者长期接受核苷(酸)类似物治疗后仍持续或间接存在LLV,且其与多种临床不良结局相关[19]。由于检测下限的不同,LLV的检出率也存在较大差异。目前,国内针对HBV DNA的高敏qPCR检测下限多为20 IU/ml,随着检测技术的进步,当采用更高灵敏的检测方法时,既往认为持续完全病毒学应答的患者可能会被归类为LLV。因此,近期有学者提出极低水平病毒血症(very low-level viremia,VLLV)的概念,即定义为HBV DNA<20 IU/ml但大于更高灵敏PCR的检测下限(5~10 IU/ml),在部分VLLV患者中可以观察到有肝硬化、肝癌等不良事件发生[20]。在本研究中:联合Peg-IFNα-2b治疗前,MCDA-LFB阳性检出率为73.7%(42/57),qPCR阳性检出率为66.7%(38/57),两种方法的阳性检出率比较,差异无统计学意义(P=0.125);一致性分析结果显示,Kappa=0.833,P<0.001,两种方法的诊断结果存在较好的一致性。但随着联用Peg-IFNα-2b抗病毒治疗后,出现病毒学应答的患者增加,在治疗24周、48周后,两种方法的检出率一致性明显下降,MCDA-LBF的阳性检出率高于qPCR。
本研究存在一定的局限性。首先,MCDA-LFB是对HBV DNA的定性测定,不能确定样本中的病原体数量,因此,需要设计一个更精确的研究实现定量测定。其次,尽管MCDA-LFB具有较高的特异性和敏感性,但仍需要控制实验室污染造成假阳性结果的可能,通过第三方试剂帮助验证。最后,本研究中的研究对象选择并非完全随机,还需要通过大样本、多中心的数据来验证检测方法的适用性。
综上所述,MCDA-LFB是一种敏感、特异、经济、简单、快速的检测方法,可用于低病毒载量慢性乙型肝炎人群的诊断,尤其对于抗HBV治疗后的极低病毒水平检测,MCDA-LFB比qPCR更敏感。HBV MCDA-LFB扩增效率高,操作过程简单,更节省时间和成本,且具有更高的敏感性,有成为经济欠发达且缺少检测设备地区进行HBV快速检测及指导慢性乙型肝炎患者临床管理新方法的巨大潜力。

