结直肠癌组织中错配修复蛋白及肿瘤相关巨噬细胞与临床病理特征相关性
惠 虹, 胡亚翎, 蔡 堃, 钟抒宇, 李 飞, 姚春梅
淮北矿工总医院1.病理科;2.胃肠外科;3.肿瘤放疗科,安徽 淮北 235000
结直肠癌(colorectal cancer,CRC)是消化系统常见的恶性肿瘤,早期症状不明显,随着肿瘤生长而逐渐出现排便习性改变、便血和腹泻等症状,严重影响患者生活质量[1-3]。错配修复(mismatch repair,MMR)是细胞间相互作用的重要纽带,通过在DNA复制、基因重组及外源损伤等过程中纠正DNA双螺旋上错配的碱基对,以维持和保障靶细胞基因组的稳定,从而降低基因突变概率[4-6]。MMR的缺失加速正常突变,诱发原癌基因和抑癌基因的聚集或失活,从而引发癌变[7-8]。多项研究证实,CRC与MMR蛋白表达相关,其中约15%的CRC由MMR蛋白表达缺失所引起[9-11]。本研究旨在探讨CRC组织中MMR蛋白及肿瘤相关巨噬细胞与临床病理特征的相关性。现报道如下。
1 对象与方法
1.1 研究对象 选取淮北矿工总医院自2020年1月至2023年8月收治的81例CRC患者的癌组织及癌旁组织为研究对象。纳入标准:确诊为CRC,且术后病理检测再次证实为CRC;肿瘤分期(tumor node metastasis,TNM)为Ⅰ~Ⅳ期[12];术后均接受辅助化疗。排除标准:合并其他部位恶性肿瘤或严重器官功能衰竭者;无法提供完整病理组织样本或临床数据不全者;合并免疫系统疾病或正在接受免疫抑制治疗者。其中,男性48例,女性33例;平均年龄(69.98±10.13)岁;直肠癌38例;结肠癌43例。本研究经医院伦理委员会批准。所有患者均签署知情同意书。
1.2 免疫组化染色 癌组织及癌旁组织均浸泡至10%中性缓冲甲醛溶液中24 h,通过取材、脱水、透明、浸蜡、包埋和切片处理后,得到组织蜡片。采用全自动免疫组化染色仪(德国Leica公司)将处理好的组织蜡片进行免疫组化染色。一抗为鼠抗人单克隆抗体、错配修复系统同源蛋白2(muts homolog 2,MSH2)抗体(克隆号RED2)、错配修复系统同源蛋白6(muts homolog 6,MSH6)抗体(克隆号EP49)、错配修复系统蛋白2(postmeiotic segregation increased 2,PMS2)抗体(克隆号EP51)及错配修复系统同源物1(mutl homolog 1,MLH1)抗体(克隆号GM002)。巨噬细胞标志蛋白163(cluster of differentiation 163,CD163)(克隆号10D6),巨噬细胞标志蛋白68(cluster of differentiation 68,CD68)(克隆号KP1)等均购自上海基因科技股份有限公司。免疫组化试剂盒与二氨基联苯胺显色液均购自徕卡生物系统(纽卡斯尔)有限公司。
1.3 染色结果判定 采用徕卡光学显微镜[型号DM2500,徕卡生物系统(纽卡斯尔)有限公司]进行染色结果判定。如果目标细胞的目标区域出现黄褐色或棕黄色颗粒,判定为阳性细胞。无颜色标记定为0分,淡黄色标记定为1分,棕黄色标记定为2分,深褐色标记定为3分。视野内无阳性细胞定为0分,0<阳性细胞占比<10%定为1分,10%≤阳性细胞占比≤50%定为2分,50%<阳性细胞占比<75%定为3分,阳性细胞占比≥75%定为4分。两项评分相加定为最终的染色结果。分数>3分为蛋白表达正常,分数≤3分为蛋白表达缺失。MLH1、MSH2、MSH6和PMS2均正常表达判定为蛋白表达正常,蛋白表达缺失≥1种判定为蛋白表达缺失。先于低倍镜下确定阳性染色数量高密度区域,后于高倍镜下对阳性细胞进行计数。当CD68阳性细胞<22个、CD163阳性细胞<19个时判定为低表达,反之判定为高表达。
1.4 统计学方法 采用SPSS 17.0统计学软件对数据进行处理。计数资料用例(百分率)表示,组间比较采用χ2检验。采用多因素Logistic回归分析筛选CRC组织中MMR蛋白缺失、肿瘤相关巨噬细胞标志物高表达的危险因素。以P<0.05为差异有统计学意义。
2 结果
2.1 CRC患者MMR蛋白表达情况 81例CRC患者中, MMR蛋白表达正常69例(85.19%),MMR蛋白表达缺失12例(14.81%)。其中,仅MSH6缺失1例(1.23%),仅PMS2缺失2例(2.47%),MSH6和PMS2缺失2例(2.47%),MSH2和MSH6缺失2例(2.47%),MLH1和PMS2缺失5例(6.17%)。
2.2 CRC患者肿瘤相关巨噬细胞标志物表达情况 81例患者中,CD68低表达42例(51.85%),高表达39例(48.15%);CD163低表达46例(56.79%),高表达35例(43.21%)。
2.3 MMR蛋白、肿瘤相关巨噬细胞标志物表达与临床病理特征相关性 CRC患者MMR蛋白表达与肿瘤直径、肿瘤部位、TNM分期、组织分化相关(P<0.05),与性别、肿瘤形态、病理类型无关(P>0.05)。肿瘤相关巨噬细胞标志物CD68、CD163与肿瘤直径、TNM分期、组织分化相关(P<0.05),与性别、肿瘤形态、肿瘤部位、病理类型无关(P>0.05)。见表1。

表1 CRC患者MMR蛋白表达、肿瘤相关巨噬细胞标志物与临床病理特征相关性/例(百分率/%)
2.4 MMR蛋白缺失、肿瘤相关巨噬细胞标志物高表达危险因素的多因素Logistic回归分析 肿瘤直径≥5 cm、肿瘤位于右半结肠、TNM分期为Ⅲ~Ⅳ期和中至中-低分化均为MMR蛋白缺陷高表达的独立危险因素(P<0.05);肿瘤直径≥5 cm、TNM分期为Ⅲ~Ⅳ期和中至中-低分化均为肿瘤相关巨噬细胞标志物高表达的独立危险因素(P<0.05)。见表2~4。
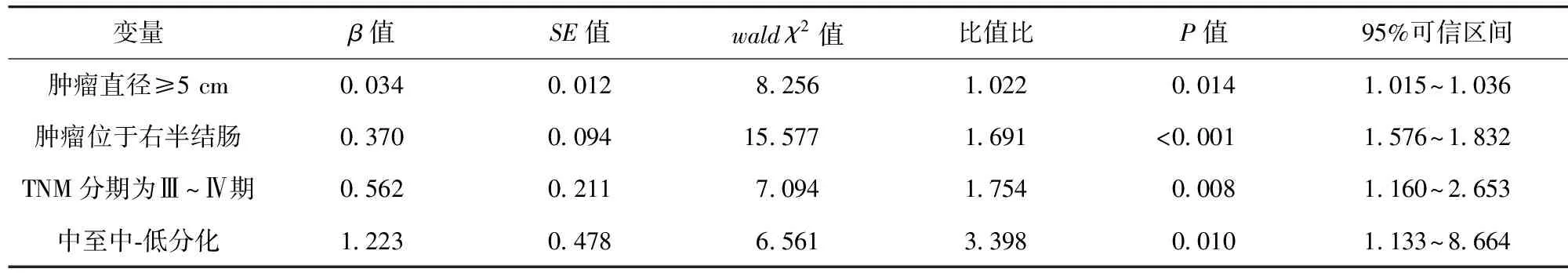
表2 MMR蛋白缺失危险因素的多因素Logistic回归分析

表3 CD68高表达危险因素的多因素Logistic回归分析

表4 CD163高表达危险因素的多因素Logistic回归分析
3 讨论
CRC来源于致癌基因的激活和抑癌基因的失活,这些变化均导致基因微结构改变,从而致使基因组突变,促进恶性细胞增殖和转移[10]。MMR通过修复碱基和插入/缺失错配来防止积累的突变DNA复制错误,以确保遗传信息的稳定性[11]。MMR蛋白缺失直接导致MMR系统功能缺失,从而使得错配的碱基DNA片段不能被切除,致使DNA损伤并产生基因突变,促使突变聚集继而形成肿瘤。有研究报道,12种MMR基因/蛋白比较容易发生突变,主要的家族成员包括MLH1、PMS2、MSH2和MSH6[12]。有研究报道,恶性肿瘤病理特征与MMR表达缺失明显相关[13]。与蛋白表达正常的CRC患者比较,蛋白表达缺失的CRC患者更容易出现直径>5 cm的肿瘤、肿瘤更易出现在右半结肠和分化程度更差。MMR蛋白缺失具有显著的特征,包括分化程度差、肿瘤膨胀性增长,少见淋巴细胞反应。这可能是MMR蛋白缺失引发微卫星不稳定性,诱导肿瘤发生和发展的结果。因此,MMR可为早期诊断和抗肿瘤治疗提供思路。巨噬细胞是免疫反应的重要组成部分,在各种疾病微环境中发挥不同的作用[14]。CD68特异性表达于巨噬细胞中,并在细胞碎片清除中发挥作用[15]。CD163是一种I型膜蛋白,参与免疫细胞的内吞作用,保护目标组织免受氧化损伤[16]。
本研究结果显示,CRC患者MMR蛋白表达与肿瘤直径、肿瘤部位、TNM分期、组织分化相关(P<0.05),与性别、肿瘤形态、病理类型无关(P>0.05)。肿瘤相关巨噬细胞标志物CD68、CD163与肿瘤直径、TNM分期、组织分化相关(P<0.05),与性别、肿瘤形态、肿瘤部位、病理类型无关(P>0.05)。MMR蛋白的表达与肿瘤的侵袭性特征如肿瘤直径和组织分化程度相关,可能反映出MMR系统在肿瘤细胞的遗传稳定性中的重要角色;而肿瘤部位的相关性可能暗示了肠道不同区域的微环境因素对MMR蛋白表达的潜在影响[17]。CD68与CD163的表达与晚期肿瘤特征相关,可能反映出肿瘤微环境中巨噬细胞在肿瘤进展和恶化中的促进作用[18]。本研究中多因素Logistic回归分析结果显示,肿瘤直径≥5 cm、肿瘤位于右半结肠、TNM分期为Ⅲ~Ⅳ期和中至中-低分化均为MMR蛋白缺陷高表达的独立危险因素(P<0.05);肿瘤直径≥5 cm、TNM分期为Ⅲ~Ⅳ期和中至中-低分化均为肿瘤相关巨噬细胞标志物高表达的独立危险因素(P<0.05)。这提示,MMR蛋白缺失在大直径肿瘤和右半结肠的CRC患者中更为常见,可能反映了肠道不同部位的肿瘤生物学行为差异[19-21]。高表达的CD68和CD163与晚期、低分化肿瘤显著相关,进一步证实其在肿瘤免疫逃逸和侵袭性增加中的重要作用[22]。
综上所述,CRC组织中MMR蛋白表达与肿瘤直径、肿瘤部位、TNM分期和组织分化相关,肿瘤相关巨噬细胞标志物表达与肿瘤直径、TNM分期和组织分化相关。

