木犀草素抑制丙酮酸铁氧还蛋白氧化还原酶及其抗艰难梭菌作用研究
肖丽君,赵文静,齐晓怡,吕沐瀚,梁思成(.西南医科大学附属医院消化内科,四川泸州 646000;. 西南医科大学附属医院皮肤科,四川泸州 646000)
艰难梭菌(Clostridiumdifficile,CD)是一种革兰阳性、产毒厌氧芽孢杆菌,可引起抗菌药物相关性腹泻及假膜性肠炎(Pseudomembmous colitis,PMC),统称为艰难梭菌相关性腹泻(Clostridium difficile associated diarrhea,CDAD),严重时可伴有巨结肠和/或爆发性感染等并发症[1]。近年来,由于艰难梭菌毒力的改变和流行菌株的出现,一线抗生素治疗艰难梭菌感染(Clostridium difficile infection,CDI)的失败率高达38%,其发病率和死亡率逐年上升[2]。传统抗生素的使用破坏了肠道微生物群,阻止了共生微生物群在肠道内的重新繁殖,使艰难梭菌再次增殖,最终导致艰难梭菌感染复发。艰难梭菌感染通常是复发恶性循环的开始,高达35%的艰难梭菌感染病例在初次诊断后会复发。据估计,艰难梭菌感染首次复发后,高达60%的患者可能再次复发[3],给患者和医疗系统带来沉重负担。
粪菌移植(Fecal microbiota transplantation,FMT)是一种有效的治疗方法,它可以通过改变肠道微生物组来解决复发性/难治性艰难梭菌感染等问题。然而,约20%的艰难梭菌感染患者在接受初始粪菌移植后仍会出现复发[4]。本课题组前期研究表明,基于艰难梭菌的关键代谢酶PFOR 酶对粪菌移植供体进行筛选,可以提高粪菌移植治疗艰难梭菌感染的临床疗效(专利申请公布号:CN 114480562 A,公布日期:2022-05-13)。PFOR 酶在艰难梭菌的丙酮酸代谢中发挥着重要的作用,它只存在于一些厌氧病原微生物中,而在哺乳动物体内和一些厌氧革兰阳性、非孢子形成细菌以及严格的需氧菌中都不表达[5-7]。因此,PFOR 酶可能是粪菌移植治疗艰难梭菌感染过程中的一项关键生物标记物。
最近的研究表明,FMT联合饮食调节是一种有效的治疗策略,蔬菜和水果的摄入被认为发挥了重要作用[8]。黄酮类化合物是植物中含量最多的一类多酚,它是以C6-C3-C6 骨架为特征的植物次级代谢物,广泛分布于浆果、欧芹、羽衣甘蓝等蔬菜水果中[9]。类黄酮不仅可以作为肠道菌群的营养物质,促进肠道菌群的生长和繁殖;还可以改善肠道环境,从而促进良性菌群的形成,增加肠道微生物的多样性和稳定性[10]。除此之外,类黄酮还表现出潜在的天然抗菌活性,类黄酮已被证明是低毒性且对耐药菌具有高活性的天然抗菌剂。已知的类黄酮分子已超过8 000 种,其中具有抗菌活性的结构主要包括黄酮、黄烷醇、黄烷酮等[11]。因此,含有黄酮类化合物的食品或药食同源植物有利于调节肠道微生物组的平衡,可以作为粪菌移植治疗艰难梭菌感染的一种辅助方法,降低艰难梭菌复发的风险。针对这一点,我们选取了一些具有代表结构的黄酮、黄烷醇、黄烷酮化合物(图1),旨在寻找具有强PFOR 酶抑制活性的天然类黄酮化合物,并考察其对艰难梭菌的抗菌作用。这些研究结果将为粪菌移植联合饮食治疗提供理论基础和新思路。

图1 三种类黄酮化合物的结构Figure 1 The structures of three subtype of flavonoids
1 材料与方法
1.1 菌株 艰难梭菌ATCC BAA 1382 和ATCC BBA 1870来自美国微生物菌株保存中心。
1.2 药物及试剂 儿茶素、表儿茶素、没食子儿茶素、表没食子儿茶素、橙皮苷、新橙皮苷,成都瑞芬思生物科技有限公司,批号分别为:E-011-120416、 B-020-120723、 E-023-120316、B-022-120719、 C-006-120321、X-010-101214;黄芩素、汉黄芩素、木犀草素,成都曼思特生物科技有限公司,批号分别为:A0018、A0502、MUST-19090414;丙酮酸钠,上海阿拉丁生化科技股份有限公司,批号:F2103284;辅酶A,上海吉至生化科技有限公司,批号:C270337DA;1,1’-二苄基-4,4’-二吡啶二氯化物(Benzyl Viologen,BV),上海迈瑞尔化学技术有限公司,批号:F69907056;六水氯化镁,成都市科隆化学品有限公司,批号:2021020101;磷酸二氢钾,天津市致远化学试剂有限公司,批号:20180301101;磷酸氢二钾,上海泰坦科技股份有限公司,批号:P1612692;氨苄青霉素、硝唑尼特和异丙基-β-D-硫代半乳糖苷,上海麦克林生化科技股份有限公司,批号分别为C12916820、C12161817;LB 肉汤培养基和LB 琼脂培养基,青岛海博生物技术有限公司,批号分别为HB0128 和HB0129-2;强化梭菌增殖培养基RCM,百盈利创生物科技(北京)有限公司,批号:20210854;琼脂粉,北京索莱宝科技有限公司,批号:1215T025;厌氧盒和厌氧产气袋,日本三菱瓦斯化学股份有限公司,批号分别为2272LH-2和2272LH-1;甲硝唑和万古霉素,上海麦克林生化科技股份有限公司,批号分别为C11185584和C15030877。
1.3 仪器 Milli-Q IQ 7000 型纯水仪,默克化工技术(上海)有限公司;Eppendorf msc-100 恒温震荡性恒温金属浴,德国eppendorf公司;上海齐欣GHP-9080隔水式恒温培养箱,上海齐欣科学仪器有限公司;ZAI-350-II 厌氧培养箱,上海喆图科学仪器有限公司;1300 系列II 级A2 型生物安全柜,赛默飞世尔(苏州)仪器有限公司;立式GR 高温灭菌器,致微(厦门)仪器有限公司。
1.4 PFOR 酶的异位表达及活性测定 PFOR 粗酶的提取及活性测定方法与前述研究[5]一致,即在厌氧条件,25 ℃下,用100 mmol·L-1磷酸钾(pH7.4)、10 mmol·L-1丙酮酸钠、5 mmol·L-1BV、0.18 mmol·L-1、CoA和1 mmol·L-1MgCl2测定PFOR。在存在或不存在抑制剂(浓度为40 μmol·L-1的硝唑尼特)的情况下,通过添加酶开始反应,并在546 nm 处监测氧化还原活性BV染料的还原。PFOR的抑制以百分比表示。
1.5 艰难梭菌的生长曲线、生长抑制及最小抑菌浓度(MIC)测定 实验选取ATCC BBA 1382、ATCC BBA 1870 艰难梭菌菌株。-80 ℃甘油冻存的菌株复苏后,吸取适量菌液接种至液体培养基后,放置于37 ℃培养箱厌氧培养24~48 h。复苏后的细菌传代两次后,吸取适量菌液在新的液体培养基中,放入厌氧箱进行培养。每隔2 h 吸取少量菌液,测定600 nm 处的吸光度(OD600)值,以此检测艰难梭菌的生长,并判断其对数生长期。根据CLSI M11 A7标准,采用琼脂稀释法测定化合物的MIC,将不同浓度的化合物与RCM 熔融固体培养基混匀,使浓度为0.062 5~256 μg·mL-1不等。待其凝固后,挑取适量单菌落悬浮于生理盐水,将菌液浊度调节至OD600=0.2,此时菌液浓度约为1×108CFU·mL-1。将此2 μL 菌液直接点种在化合物固体稀释琼脂板中,使琼脂板上的接种量约为105GFU/点。同时设置空白组,将准备好的所有六孔板置于37 ℃厌氧培养48 h 后,通过肉眼观察,完全或显著抑制菌体生长的最低药物浓度为MIC。
1.6 不同药物浓度时间-抑菌作用曲线 根据测定出来的MIC 值,选取1/2 MIC、1 MIC、2 MIC 浓度药物与两株艰难梭菌共同孵育,分别在0、4、8、12、24、48 h测定菌液的600 nm处吸光度,绘制浓度-时间抑菌曲线。
1.7 分子对接模拟 通过AutoDockTools 4.2 软件进行分子对接,探索木犀草素与非洲脱硫弧菌PFOR 酶(蛋白质数据库[PDB]1B0P)之间的相互作用。使用AlloSite 服务器和AlloSitePro 方法分析PFOR 中木犀草素的优选结合位点。创建网格盒并准备PDBQT 文件和配体后,使用蛋白质和配体信息以及配置文件中的网格盒属性(60×60×60 xyz 点,网格间距0.375Å)使用AutoDockTools 进行对接。使用PyMOL 2.5 和LigPlot 2.2软件对对接结果进行可视化和分析。
1.8 统计学处理方法 使用Graphpad prism 9.0 软件对数据进行统计分析并绘图,计量资料结果以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两两比较用LSD 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 硝唑尼特对PFOR 的抑制作用 有研究[12]报道,阳性抑制剂硝唑尼特(NTZ)在40 μmol·L-1的浓度下,对PFOR的抑制率约为40%。提取PFOR酶[5]后,考马斯亮蓝法测定所提取粗酶液的蛋白浓度,约为3.22 mg·mL-1。为确定最佳反应时间和浓度,以硝唑尼特对PFOR 的抑制率作为参照,设置不同的反应时间和浓度。如图2-A 所示,在厌氧条件下,酶浓度为64 μg·mL-1时,反应约8 h 后,40 μmol·L-1的硝唑尼特对所提取的PFOR 的抑制率约为40%,由此确定反应时间和浓度。同时,设置不同的硝唑尼特浓度,按照上述反应体系,测定硝唑尼特对PFOR 的半数抑制浓度(IC50)约为23 μmol·L-1,见图2-B,与既往报道[13]的24 μmol·L-1基本接近。结果表明PFOR 酶的异位表达及提取成功。

图2 硝唑尼特对PFOR 的抑制作用(±s,n=3)Figure 2 The inhibition of nitazoxanide on PFOR(±s,n=3)
2.2 黄酮类化合物对PFOR 酶抑制作用初筛 分别选取黄酮、黄烷醇、黄烷酮等几种类黄酮化合物,参照阳性抑制剂硝唑尼特,选取浓度40 μmol·L-1与PFOR共同孵育,在反应前测定546 nm处吸光度作为本底值。8 h后,再次测量546 nm 处吸光度,以不加药物组作为空白对照,计算PFOR 酶的抑制率。以阳性抑制剂抑制作用作为参照,在所选化合物中,木犀草素对PFOR 抑制作用最强。在硝唑尼特的抑制率为40%时,木犀草素对PFOR的抑制率为33%(图3),因此选择木犀草素进行接下来的研究。
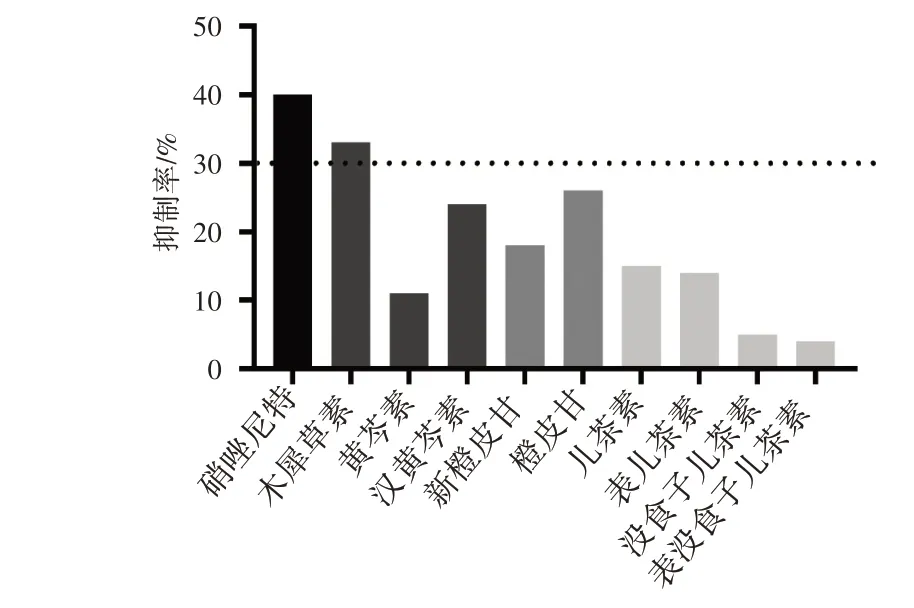
图3 类黄酮化合物对PFOR 的抑制率Figure 3 Inhibition rate of flavonoid compounds on PFOR
2.3 木犀草素对艰难梭菌的生长抑制作用 分别挑取艰难梭菌ATCC BBA 1382、ATCC BBA 1870 单菌落于空白RCM 液体培养基中,设置0、2、4、8、10、12、16、20、24 h 待测管,在相应的时间点取出待测管,测定菌液的在600 nm 处吸光度值,根据吸光度-时间的变化绘制艰难梭菌的生长曲线。结果如图4-A 所示,当OD600=0.2(4 h)时,两株艰难梭菌生长进入对数期。进一步探究木犀草素对艰难梭菌是否存在生长抑制作用。当艰难梭菌生长到对数生长期时(OD600=0.2,4 h),将木犀草素与两株艰难梭菌在液体培养基中共培养,分别在培养0 h 和24 h 时检测600 nm 处吸光度值,以硝唑尼特作为对照,观察艰难梭菌的生长情况。如图4-B、C 所示,空白组(没有药物处理)24 h 的菌液吸光度明显增加(P<0.01)。与空白组比,在使用硝唑尼特24 h 后,艰难梭菌的生长受到明显抑制(P<0.01);与此一致,使用木犀草素后艰难梭菌的生长也明显受限(P<0.05),但两药之间的差异无统计学意义(P>0.05)。

图4 木犀草素对艰难梭菌的生长抑制作用(±s,n=3)Figure 4 The growth inhibition of luteolin on Clostridium difficile(±s,n=3)
2.4 木犀草素对艰难梭菌生长抑制作用的测定 由前述实验可知,木犀草素对艰难梭菌生长存在抑制作用。因此,测定其对两株不同艰难梭菌的最小抑菌浓度。将RCM 固体培养基与梯度稀释的木犀草素混匀后倒入平板,充分晾干后,将艰难梭菌点种在琼脂表面,厌氧条件下培养48 h,读取MIC。其数据结果如表1所示,结果表明木犀草素在32 μg·mL-1的浓度下能有效抑制艰难梭菌ATCC BBA 1382 和ATCC BBA 1870的生长。另外,实验还测定了PFOR 阳性抑制剂硝唑尼特和两种CDI常用药物甲硝唑及万古霉素的MIC以作为对照,结果显示,硝唑尼特、甲硝唑、万古霉素3种药物的MIC分别为0.125、0.125、0.25 μg·mL-1。
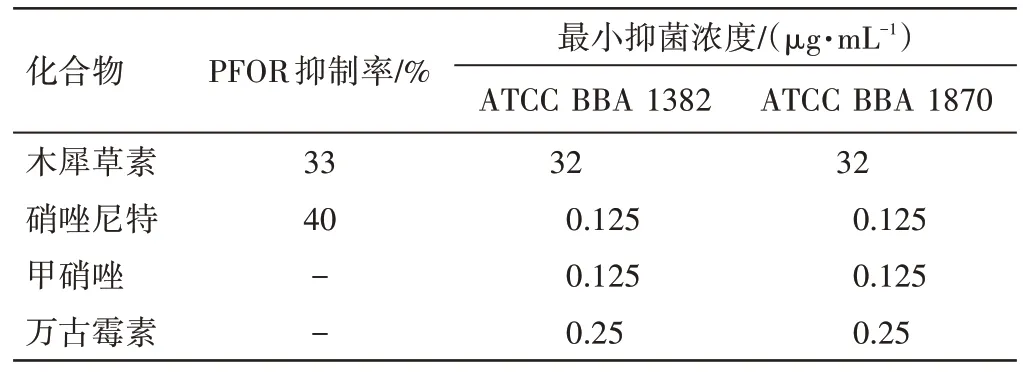
表1 木犀草素、硝唑尼特、甲硝唑和万古霉素的最小抑菌浓度Table 1 Minimum inhibitory concentrations of luteolin, nitazoxanide,metronidazole and vancomycin
根据已得到的结果,将不同浓度的木犀草素与两株艰难梭菌在液体培养基中共培养,使木犀草素的终浓度为0(空白组)、1/2 MIC(16 μg·mL-1)、1 MIC(32 μg·mL-1)、2 MIC(64 μg·mL-1),最后绘制浓度-时间抑菌曲线。如图5所示,与空白组比,木犀草素共培养8 h 起,木犀草素各组中两种艰难梭菌的生长均被明显抑制(P<0.01);随着木犀草素浓度的增加,对两株细菌的抑制作用呈增强趋势,其中木犀草素2 MIC 组与1/2 MIC 组比,各时间点艰难梭菌的生长均被明显抑制(P<0.05,P<0.01)。
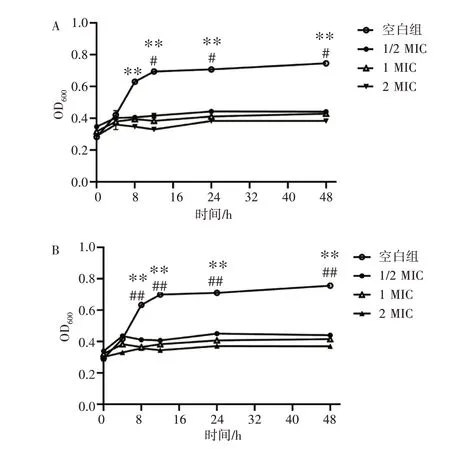
图5 木犀草素对艰难梭菌的浓度-时间依赖性抑制曲线Figure 5 The concentration-time dependence inhibition curves of luteolin on Clostridium difficile
2.5 分子对接模拟与分析 由于木犀草素在前述实验中表现出良好的PFOR 抑制作用及对艰难梭菌的生长抑制,因此将木犀草素与PFOR 酶进行分子模拟对接。对接模拟有助于研究PFOR 与木犀草素之间相互作用的机制。由于确定木犀草素的变构位点(结合位点)是前提,因此使用AlloSitePro预测PFOR晶体结构中的变构位置。由于在厌氧菌中PFOR 的关键氨基酸、核心结构以及催化机制都是高度保守的,因此选择来自非洲脱硫弧菌的PFOR 晶体结构用于进一步研究[12]。本实验以AlloSitePro 用于预测非洲脱硫弧菌(1B0P)PFOR 晶体结构中的变构位置。结果表明,PFOR 的变构位点由Phe114, Ala848, Pro633,Asp456,Ile497,Ile646,Lys458,Arg675,Lys368,Lys459 等氨基酸残基组成,且变构位点位于酶活性之外的部位,木犀草素在上述变构位点的结合中竞争良好(图6)。在进一步分析中发现,木犀草素可与PFOR 多个氨基酸残基形成多条氢键,木犀草素B 环3’和4’上的羟基与Asp428,Val431,Thr430 形成氢键,A 环上5 号和7 号位C 上的羟基与Asp456,Lys458,Lys459 形成氢键,同时C 环含氧吡喃环4 号位上的O 原子也可与Asp456 形成氢键,其最低结合能为-7.01 kcal·mol-1(图7)。
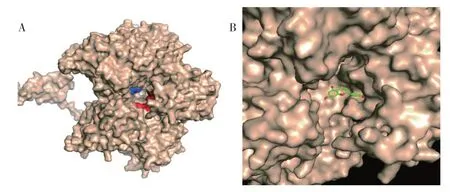
图6 来自非洲脱硫弧菌(1B0P)的PFOR 三维晶体结构的表面图Figure 6 Surface representation of the three-dimensional crystal structure of PFOR derived from Desulfovibrio africanus(1B0P)

图7 木犀草素与PFOR 异构位点相互作用的三维(A)和二维(B)结果Figure 7 3D(A)and 2D(B)result of interactions of luteolin with the allosteric site of PFOR
3 讨论
饮食是影响肠道微生物群的主要决定因素之一,与多种疾病的风险和病程相关,饮食疗法已应用于多种疾病。研究[14]发现,植物性食物通过为供体微生物群的植入创造有利的生态位和其自身的抗炎作用,可提高粪菌移植的成功率。一项开放标签的随机对照临床试验[14]表明,粪菌移植联合抗炎饮食的补充,可有效诱导轻中度UC 患者的临床缓解。另外,一项2 期临床试验发现膳食纤维补充作为粪菌移植的辅助手段可以明显提高微生物的多样性和丰富度,改善肥胖患者的胰岛素抵抗[15]。除含抗炎物质和膳食纤维外,几乎所有的植物性食物,如蔬菜、水果等都含有大量的黄酮类化合物。既往研究表明黄酮类化合物具有抗氧化作用,将其作为膳食抗氧化剂可有效预防心血管疾病、糖尿病、癌症和阿尔茨海默氏症等认知疾病的发生发展,而对其对肠道菌影响的研究较少[16-17]。本研究发现,食物中高含量的类黄酮化合物如木犀草素可抑制PFOR 酶,阻碍艰难梭菌能量代谢从而对厌氧艰难梭菌具有生长抑制作用。
PFOR 是艰难梭菌厌氧代谢过程中催化丙酮酸氧化脱羧生成CO2的关键酶,乙酰辅酶A(acetyl-CoA)在丙酮酸异化过程中起关键作用,维持细菌的能量稳态[12,18],此外,PFOR 将Wood-Ljungdahl 途径与生成生物合成中间体的不完全还原三羧酸循环联系起来[19]。PFOR 被发现只存在于一些严格的厌氧病原体中,而肠道内一些常驻的有益微生物中不含PFOR,因此一些对PFOR 有抑制作用的化合物展示出良好的抑制艰难梭菌的作用的同时,对肠道正常微生物群的组成没有影响,有利于肠道菌群的重建,减少艰难梭菌感染的复发[5,7]。
在各类黄酮化合物中,黄酮由于在C 环中存在不饱和双键,延长了AB 环之间的共轭体系,对PFOR的抑制作用较强;同时,在所有被检测的黄酮化合物中,木犀草素的抑制作用最高,可能是由于木犀草素的B 环上3’,4’上羟基形成邻二羟基,使其抑制活性提高。因此,在黄酮类化合物对PFOR 酶抑制作用中,不饱和C 环和B 环上邻位多酚结构的形成发挥重要的作用。与此一致,分子对接发现,木犀草素A 和B 环上的羟基都与PFOR 的氨基酸残基形成氢键。使用BLASTP 网站[Protein BLAST:search protein databases using a protein query(nih.gov)]将其他PFOR酶变构位点中的氨基酸序列进行对比,发现在PFOR酶中与木犀草素相互作用的氨基酸Asp456、Lys458和Lys459都是高度保守的。
作为可食用植物中最常见的类黄酮之一,木犀草素广泛分布于胡萝卜、辣椒、芹菜、橄榄油、茶以及谷物等中。据报道[20],在深色蔬菜和水果中含有丰富的木犀草素等黄酮化合物,在杜松子、百里香中的木犀草素含量约为0.5 g·kg-1,在菊苣、生芹菜等蔬菜中的含量高达3 g·kg-1,在小米等谷物中的含量约为0.3 g·kg-1,在食用和烹饪过程中都能很好地被吸收和利用。一般来说,健康饮食每天约含有2~125 mg木犀草素,摄入富含木犀草素的提取物或分离的木犀草素单体具有多种促进健康和药理作用,如抗氧化、抗炎、保肝、抗癌和神经保护等特性[21]。在传统医学中,含有木犀草素的植物也被用于治疗高血压、炎症性疾病和癌症等疾病,也是银黄颗粒、清热治痢丸和克痛酊等的有效成分。近年来,木犀草素在各类护肤品中也得到广泛应用,是医药、营养产品和化妆品中不可缺少的成分[22]。迄今为止,木犀草素已作为一种保健食品进行商业开发[19]。木犀草素或富含木犀草素的产品的补充不仅能够帮助清除体内自由基,保护细胞免受损伤,有助于肠道健康;本研究还表明,木犀草素可发挥抑制艰难梭菌、维护肠道稳态的作用。基于这些益处,将其作为粪菌移植的辅助治疗,可以有效改善患者的症状,提高粪菌移植治疗艰难梭菌感染的临床疗效。同时,由于其在蔬果中分布广、含量高,每日只需食用一个苹果、饮用一杯茶或摄入100 g 的西蓝花,即可有效增加木犀草素的摄入量。因此,在粪菌移植治疗艰难梭菌感染等疾病期间,通过饮食补充富含木犀草素的蔬菜、水果等植物是一种方便、安全的辅助治疗方式。
综上所述,本实验显示木犀草素对艰难梭菌的PFOR 酶具有较好的抑制作用,从而干扰其能量代谢、抑制其生长,为艰难梭菌的治疗提供了新思路。本研究证明木犀草素是PFOR 酶的变构抑制剂,通过结合在酶活性中心以外的部位调控底物与酶活性位点的结合,这不仅拓展了PFOR 抑制剂的种类,还丰富了对天然化合物木犀草素的研究,证明PFOR 是抗艰难梭菌治疗中的重要靶点,为粪菌移植联合木犀草素或含木犀草素的药食同源的饮食治疗艰难梭菌感染提供了理论依据。但是本实验尚有不足,木犀草素对艰难梭菌的抑制活性及结构的关系,以及其体内的抑菌活性,尚需更进一步的研究。

