基于网络药理学及体内实验探讨射麻止喘液治疗中性粒细胞型哮喘的分子机制
连乐燊,孟星汝,黄秀芳,周谨希,谢燕小,陶海澜,蒋紫云,5,刘小虹(.广州中医药大学东莞医院,广东东莞 52000;2.广州中医药大学第一临床医学院,广东广州 50405;. 广州中医药大学第一附属医院,广东广州 50405;4. 广州中医药大学岭南医学研究中心,广东广州 50405;5. 广州中医药大学第三临床医学院,广东广州 5070)
支气管哮喘(Asthma)简称哮喘,是一种由多种细胞及细胞组分参与的气道慢性炎症性疾病[1]。根据痰液中不同的炎症细胞分布,可分成嗜酸粒细胞型哮喘(Eosinophilic asthma,EA)、中性粒细胞型哮喘(Neutrophilic asthma,NA)、混合细胞型哮喘(Mixed granulocytic asthma,MA)及寡细胞型哮喘(Paucigranulocytic asthma,PA)4 种表型[2]。其中NA 对激素的治疗反应性差,临床症状比其他类型的哮喘更难控制,但其具体机制尚未完全明确[3-4]。
射麻止喘液是广州中医药大学第一附属医院根据治疗哮喘的临床验方生产的医院制剂(粤药制字Z20071338),具有宣肺平喘、通络解痉、化痰止咳的功效,用于支气管哮喘及喘息性急慢性支气管炎发作期。临床研究显示,射麻止喘液能改善支气管哮喘急性发作患者的临床症状[5]、肺功能[6]及外周血清炎症因子白细胞介素5(IL-5)、IL-8 水平[7]。本课题组前期研究表明,射麻止喘液能调节哮喘模型动物的环磷酸腺苷(cAMP)、环磷酸鸟苷(cGMP)失衡,改善炎症反应[8],减轻气道平滑肌细胞增殖[9],但其对NA 的作用机制尚不清楚。故本研究基于网络药理学方法及体内实验验证探讨射麻止喘液对NA 的作用机制,以期为其临床应用提供更多的实验依据。
1 材料与方法
1.1 动物 雌性6~8 周龄BALB/C 小鼠30 只,SPF级,体质量18~22 g,购自浙江维通利华实验动物技术有限公司,实验动物生产许可证号:SCXY(浙)2019-0001。动物饲养在广州中医药大学动物实验中心,实验动物使用许可证号:SYXK(粤)2018-0001,环境温度:22~24 ℃,湿度:40%~50%,光照条件:12 h 明暗交替,动物自由摄食饮水。本动物实验经广州中医药大学实验动物伦理委员会批准,批文号:20221014004。
1.2 药物及主要试剂 射麻止喘液(组方:麻黄、射干、地龙、杏仁、半夏、细辛、桔梗、椒目、甘草),由广州中医药大学第一附属医院提供,批号:20220901。鸡卵清白蛋白(OVA,纯度≥98%,货号:A5503)、弗氏完全佐剂(CFA,货号:F5881),德国Sigma 公司;醋酸地塞米松片(DEX),新乡市长乐药业有限公司,货号:H41020216;p-mTOR 抗体,武汉爱博泰克生物科技有限公司,货号:Ap0094;HE染色试剂盒,武汉赛维尔生物科技有限公司,货号:G1076;IL-8 ELISA 检测试剂盒,深圳欣博盛生物科技有限公司,货号:EMC104;Primer Script-RT(货号:RR047A)、TB Green Premix Ex TaqTM(货号:RR820A),日本TaKaRa公司。
1.3 主要仪器 HY-JSE01 型小动物雾化给药仪,北京元森凯德生物技术有限公司;Nanodrop 2000 型超微量紫外可见分光光度计、多功能酶标仪,美国Thermo Scientific 公司;Quant StudioTM5 Real-Time 荧光定量PCR 仪,美国ABI 公司;低温高速台式离心机,美国Beckman 公司;Pannoramic MIDI 数字病理切片扫描系统,匈牙利3D HISTEC 公司;显微镜,日本尼康公司。
1.4 射麻止喘液活性成分及其作用靶点筛选 射麻止喘液由麻黄、射干、地龙、杏仁、半夏、细辛、桔梗、椒目、甘草9味中药组成,利用中药系统药理学数据库和分析平台(TCMSP,http://tcmspw.com/tcmsp.php)检索射麻止喘液中除地龙外的其余8味药的化学成分,并以口服生物利用度(Oral bioavailability,OB)≥30%、类药性(Drug likeness,DL)≥0.18 为条件,筛选出射麻止喘液的活性成分;动物药地龙通过文献检索及Swiss ADME 数据库(http://www.swissadme.ch/index.php)筛选获得活性成分。运用TCMSP 数据库及SwissTargetPrediction 平 台 (http://www.swisstargetprediction.ch)预测射麻止喘液活性成分的作用靶点,将候选化合物及其对应靶点导入Excel 软件,并使用Uniprot蛋白质数据库(https://www.uniprot.org)获取规范基因名称,去重后得到射麻止喘液的活性成分-作用靶点数据集。
1.5 NA 疾病相关靶点筛选 利用OMIM(http://www.omim.org)、GeneCards(https://www.genecards.org)、DisGeNET(https://www.disgenet.org)及DrugBank(https://go.drugbank.com)数据库,以“Neutrophilic asthma”为关键词进行检索,获得NA 疾病相关靶点。将GeneCards 数据库中检索出的疾病靶点以“Relevant Score”所在的队列数值为目标,计算该列中位数,筛选出“Relevant Score”值>中位数的靶点,并与其他数据库筛选出的靶点合并、去重后,得到NA 疾病相关靶点。
1.6 “中药-活性成分-潜在作用靶点”网络构建 通过微生信平台(https://bioinfogp.cnb.csic.es/tools/venny/index.html)对上述预测得到的射麻止喘液活性成分作用靶点与NA 疾病相关靶点取交集并生成韦恩图,即得到射麻止喘液治疗NA 的潜在作用靶点(共有靶点)。分别将射麻止喘液所含中药、活性成分及共有靶点导入Cytoscape 3.8软件,构建“中药-活性成分-潜在作用靶点”网络。
1.7 潜在作用靶点的蛋白互作(PPI)网络构建 将射麻止喘液治疗NA 的潜在作用靶点上传至STRING 数据库(https://www.string-db.org),模式选择“Multiple Protein”,物种选择“Homo sapiens”,选取置信度(Minimum required interaction score)>0.4,建立潜在作用靶点PPI 网络。将PPI 网络关系保存为Tsv 文件,导入Cytoscape 3.8 软件中,进一步使用内置Mcode 插件分析获得核心靶点。
1.8 潜在作用靶点的GO 功能及KEGG 通路富集分析 使用Metascape 平台(http://metascape.org/gp/index)对射麻止喘液治疗NA 的潜在作用靶点进行基因本体(GO)、京都基因和基因组百科全书(KEGG)通路富集分析;以P<0.05对结果进行筛选,获得射麻止喘液治疗NA 的生物过程(Biological Process,BP)、细胞组分(Cellular Component,CC)、分子功能(Molecular Function,MF)以及信号通路。分别将筛选得到的GO 功能富集分析结果前10 项及KEGG 通路富集分析结果前20 项导入微生信平台进行可视化。
1.9 体内实验
1.9.1 分组、模型复制及给药 将BALB/C 小鼠适应性喂养1 周后,随机分为空白组、NA 模型组、射麻止喘液低剂量组、射麻止喘液高剂量组、地塞米松对照组,每组6 只。通过腹腔注射致敏剂(OVA+CFA)及雾化吸入激发的方法复制NA 小鼠模型[10-11]。①致敏阶段:除空白组外,其余各组小鼠在第0、7、14 天分别腹腔注射20 μg OVA+75 μg CFA(0.3 mL)致敏,空白组小鼠腹腔注射等量生理盐水。②激发给药阶段:第21~30天,采用雾化箱进行雾化激发,激发药物为5% OVA 混悬液(每次8 mL,每次雾化时间40 min,每天1 次),空白组采用等量生理盐水雾化。同时于雾化激发前1 h 灌胃或腹腔注射给药,每天1次。按照人与动物间体表面积折算等效剂量,射麻止喘液低、高剂量组分别按照2.5、10 g·kg-1剂量灌胃给药;空白组及NA 模型组给予10 mL·kg-1生理盐水灌胃;地塞米松对照组腹腔注射1 mg·kg-1地塞米松,每天1次。
1.9.2 肺组织病理学观察 取小鼠肺组织置于4%多聚甲醛溶液中固定48 h 后,剪去多余结缔组织;采用乙醇梯度脱水,二甲苯透明,石蜡包埋,切成约4 μm薄片;二甲苯脱蜡,乙醇梯度洗脱后,进行HE常规染色,封片后在显微镜下观察,并用数字病理切片扫描系统采集图像。
1.9.3 ELISA 法检测肺泡灌洗液中IL-8 含量 将小鼠麻醉后固定于取材台上,充分暴露气管,留置固定导管,暴露胸腔;用无菌手术线结扎右肺,使用1 mL 注射器抽取0.3 mL 预冷的生理盐水,匀速自导管注入左肺后回抽(回抽率80%以上),反复抽吸3 次;将留取的肺泡灌洗液(BALF)以4 ℃、2 000 r·min-1(离心半径8 cm)离心5 min,吸取上清液,-80 ℃保存。严格按照ELISA试剂盒说明书步骤操作,测定肺泡灌洗液中IL-8含量。
1.9.4 RT-qPCR法检测肺组织NLRP3、CXCR2 mRNA表达水平 采用TRIzol 法提取小鼠肺组织总RNA,检测RNA 含量和纯度。采用Prime Script-RT 试剂盒进行逆转录反应,反应条件:42 ℃、15 min,85 ℃、5 min,将提取的总RNA 转录为cDNA。然后采用TB Green Premix Ex TaqTM试剂盒进行PCR扩增反应,反应条件:95 ℃预变性10 min,95 ℃变性15 s,退火,60 ℃延伸30 s,共40 个循环;熔解曲线分析范围:65~95 ℃,每5 s 升温0.5 ℃,每0.5 ℃记录1 次荧光信号;实验重复3 次。以β-actin 为内参,采用2-△△Ct法计算目的基因相对表达量。引物序列由北京擎科生物科技股份有限公司提供,见表1。

表1 PCR 引物序列表Table 1 Primer sequences of PCR
1.9.5 免疫组化法检测肺组织p-mTOR蛋白表达水平取肺组织石蜡切片,脱蜡并清洗后,用0.01 mol·L-1柠檬酸盐缓冲液煮沸热修复抗原;室温冷却后用PBS清洗3 次,山羊血清室温下孵育;PBS 清洗3 次后,加入一抗p-mTOR(稀释比例1∶50),4 ℃下孵育过夜;室温下复温后PBS 清洗3 次,滴加酶标二抗,室温下孵育1 h;PBS 清洗3 次,滴加DAB 显色液显色5~10 min;PBS 清洗,苏木素复染约3 min 后常规脱水;二甲苯透明,干燥后树脂封固;在光学显微镜下观察,棕黄色为阳性表达。
1.10 统计学处理方法 采用SPSS 25.0 统计软件进行数据分析;计量资料以均数±标准差(±s)表示;多组间比较采用单因素方差分析(One-way ANOVA),两两比较采用LSD 检验,方差不齐则采用非参数检验;以P<0.05为差异有统计学意义。
2 结果
2.1 射麻止喘液治疗NA 的“中药-活性成分-潜在作用靶点”网络 结果共筛选得到射麻止喘液活性成分作用靶点826 个,NA 疾病相关靶点154 个。对射麻止喘液活性成分作用靶点与NA 疾病相关靶点取交集,即得到射麻止喘液治疗NA的51个潜在作用靶点(共有靶点),生成韦恩图见图1。
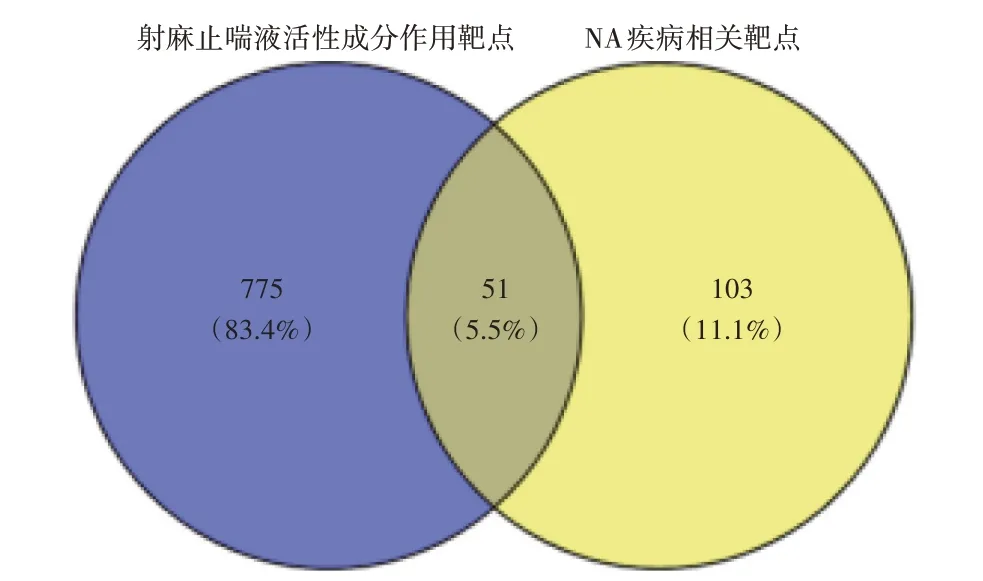
图1 射麻止喘液治疗中性粒细胞型哮喘(NA)的潜在作用靶点Figure 1 Potential targets of Shema Zhichuan Liquid in the treatment of neutrophilic asthma
分别将射麻止喘液所含中药、活性成分及共有靶点导入Cytoscape 3.8软件,构建“中药-活性成分-潜在作用靶点”网络,见图2。该网络由205 个节点(9 个中药、145 个活性成分、51 个潜在作用靶点)、667 条边构成,节点之间的连线表示药物、活性成分、靶点基因之间的作用关系。通过对该网络拓扑参数进一步分析,根据度值(Degree)大小进行排列,排前5 位的活性成分为:槲皮素、木犀草素、山柰酚、豆甾醇、柚皮素,见表2;排前5 位的潜在作用靶点为:ESR1、ADRB2、CASP1、MAPK1、RELA。上述活性成分和靶点可能在射麻止喘液治疗NA 中发挥关键作用。

图2 射麻止喘液治疗中性粒细胞型哮喘的“中药-活性成分-潜在作用靶点”网络Figure 2 “Chinese medicinals-active components-potential targets” network of Shema Zhichuan Liquid in the treatment of neutrophilic asthma
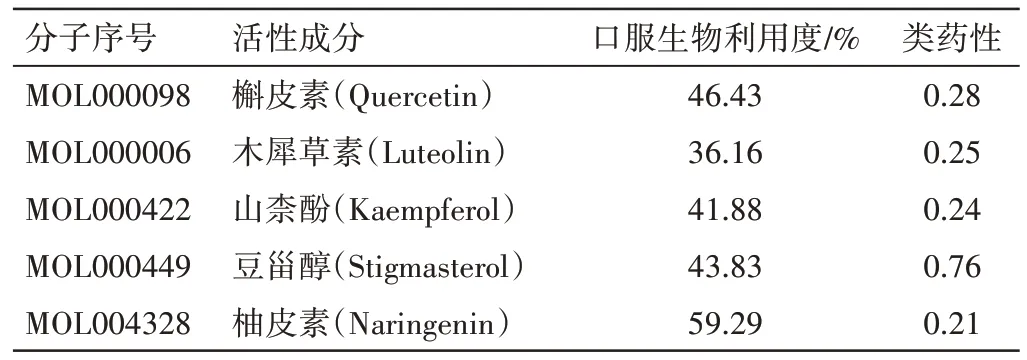
表2 射麻止喘液治疗中性粒细胞型哮喘的关键活性成分Table 2 Key active components of Shema Zhichuan Liquid in the treatment of neutrophilic asthma
2.2 射麻止喘液治疗NA 潜在作用靶点的PPI 网络将射麻止喘液治疗NA 的51 个潜在作用靶点导入STRING 数据库构建PPI网络,去除2个游离节点,该网络由49 个节点、568 条边组成,见图3-A。利用Cytoscape 3.8 软件的内置插件Mcode 对该PPI 网络进行参数特征计算,共得到29 个核心靶点(见图3-B),包括AKT1(苏氨酸蛋白激酶1)、IL6(白细胞介素6)、TNF(肿瘤坏死因子)、EGFR(表皮生长因子)、NLRP3(NOD 样受体热蛋白结构域相关蛋白3)、RELA(核因子κB)、MIF(巨噬细胞移动抑制因子)、CXCR2(CXC 趋化因子受体2)、VEGFA(血管内皮生长因子A)等,各节点Degree 值接近,越靠近中心表示该靶点越重要。

图3 射麻止喘液治疗中性粒细胞型哮喘的潜在作用靶点PPI 网络Figure 3 PPI network of potential targets of Shema Zhichuan Liquid in the treatment of neutrophilic asthma
2.3 潜在作用靶点的GO 功能及KEGG 通路富集分析 通过Metascape 平台对射麻止喘液治疗NA 的潜在作用靶点进行GO 功能及KEGG 通路富集分析,结果见图4。GO 功能富集分析(见图4-A)得到882 个生物学过程条目,主要包括细胞对脂多糖、细菌来源分子、生物刺激、脂质的反应及炎症反应等;33个细胞组分条目,主要集中在细胞膜阀、细胞质核周区、细胞质囊泡腔、细胞膜微区等;61 个分子功能条目,包括各种因子结合、糖胺聚糖结合、受体蛋白结合等。KEGG 通路富集分析(见图4-B)共得到142 条信号通路(P<0.05),大多数靶点富集在癌症通路、TNF 信号通路、甲型流感信号通路、Toll 样受体通路、MAPK信号通路、mTOR信号通路等。

图4 射麻止喘液治疗中性粒细胞型哮喘的潜在作用靶点的GO 功能及KEGG 通路富集分析Figure 4 GO enrichment analysis and KEGG pathway enrichment analysis of potential targets of Shema Zhichuan Liquid in the treatment of neutrophilic asthma
2.4 射麻止喘液对NA 小鼠肺组织病理变化的影响结果见图5。空白组小鼠的气道黏膜上皮结构完整,各层次结构排列整齐,未见明显坏死、脱落以及炎症细胞浸润,且肺泡结构正常、间隔较薄,间质无明显纤维组织增生。与空白组比较,NA 模型组小鼠的气道黏膜上皮结构破损、紊乱,有局灶性脱落,气管及血管周围伴有大量的炎性细胞浸润,可见部分区域黏液腺、平滑肌增生,伴有部分黏膜下层充血、水肿,且肺泡壁明显增厚,肺泡腔缩小。与NA模型组比较,射麻止喘液低、高剂量组小鼠肺组织支气管上皮细胞结构排列可见少许紊乱,气管及血管周围有少量的炎性细胞浸润,支气管黏膜充血水肿明显减轻。而地塞米松对照组的改善不明显,可见气道黏膜上皮结构破坏,气管及血管周围有大量炎性细胞聚集,黏膜充血、水肿等。结果提示,射麻止喘液能改善NA小鼠的肺组织病理损伤。
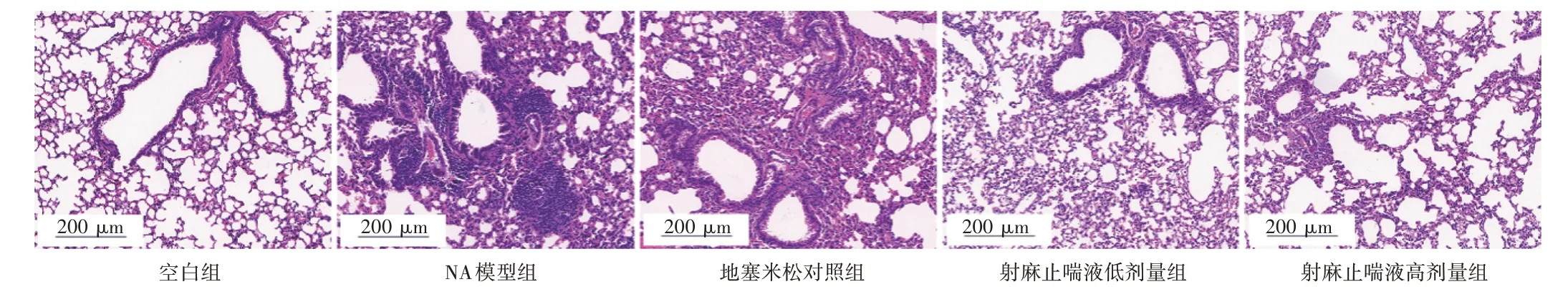
图5 射麻止喘液对中性粒细胞型哮喘(NA)小鼠肺组织病理变化的影响(HE 染色,×200)Figure 5 Effect of Shema Zhichuan Liquid on histomorphological changes in the lung tissue of neutrophilic asthma mice(HE staining,×200)
2.5 射麻止喘液对NA 小鼠肺泡灌洗液中炎症因子IL-8 水平的影响 结果见图6。与空白组比较,NA模型组小鼠肺泡灌洗液中的IL-8 水平明显升高(P<0.05)。与模型组比较,射麻止喘液高剂量组小鼠肺泡灌洗液中的IL-8 水平明显降低(P<0.05)。射麻止喘液低剂量组及地塞米松对照组小鼠肺泡灌洗液中的IL-8 水平无明显变化(P>0.05)。结果提示,射麻止喘液能改善NA小鼠的气道炎症反应。
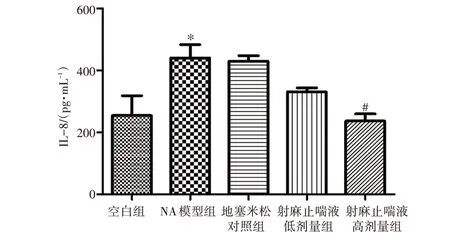
图6 射麻止喘液对中性粒细胞型哮喘(NA)小鼠肺泡灌洗液中IL-8 水平的影响(±s,n=3)Figure 6 Effect of Shema Zhichuan Liquid on the level of IL-8 in bronchoalveolar lavage fluid of neutrophilic asthma mice(±s,n=3)
2.6 射麻止喘液对NA 小鼠肺组织NLRP3、CXCR2 mRNA 表达及p-mTOR 蛋白表达的影响 结果见图7。与空白组比较,NA 模型组小鼠肺组织NLRP3、CXCR2 mRNA 表达显著上调(P<0.01),p-mTOR 蛋白表达水平(棕色为阳性表达)明显升高。与NA 模型组比较,射麻止喘液低剂量组小鼠肺组织NLRP3 mRNA 表达明显下调(P<0.05),射麻止喘液低、高剂量组小鼠肺组织CXCR2 mRNA 表达显著下调(P<0.01),p-mTOR蛋白表达水平明显降低。
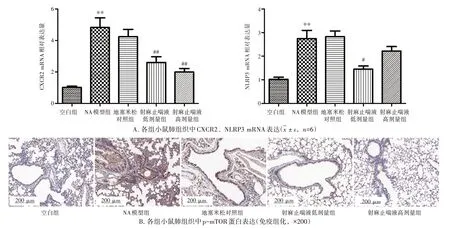
图7 射麻止喘液对中性粒细胞型哮喘(NA)小鼠肺组织中CXCR2、NLRP3 mRNA 表达及p-mTOR 蛋白表达的影响Figure 7 Effects of Shema Zhichuan Liquid on mRNA expressions of CXCR2,NLRP3 and protein expression of p-mTOR in lung tissue of neutrophilic asthma mice
3 讨论
研究[1]表明,哮喘是一种异质性疾病,其在不同患者个体间存在差异。异质性与中医学的“同病异治”有异曲同工之意,不同炎症表型的哮喘患者具有不同的中医发病病机[12]。有研究[7]认为,中性粒细胞型哮喘(NA)多由风邪羁恋不散,引动体内宿痰所致,故治疗NA 宜从风痰论治,以“祛风化痰”为基本治则。射麻止喘液由《金匮要略》中的射干麻黄汤化裁而来,具有疏风化痰、解痉平喘的功效,符合NA 的中医病机。前期临床及实验研究[5-9]已证实射麻止喘液对哮喘疗效确切,然而其对NA 的分子作用机制尚不清晰。因此,本研究通过网络药理学方法[13]探究了射麻止喘液对NA 的作用机制,并进行了动物实验验证。
本研究筛选出射麻止喘液中治疗NA 的主要活性成分包括槲皮素、木犀草素、山柰酚、豆甾醇、柚皮素等。槲皮素具有抗氧化损伤、抗炎、抗癌等药理作用,相关研究[14-15]显示,其能够降低哮喘气道敏感性,抑制气道炎症。木犀草素能通过调控MAPK/AP-1、JAK-STAT 等多种炎症信号通路,改善NA 发生发展中的气道炎症[16]。山柰酚可以抑制经典炎症通路激活,减少肥大细胞释放组胺及炎症因子IL-6、TNF-α,从而有效减轻肺部炎症[17-18]。柚皮素可抑制Th2 炎性细胞产生炎症因子,调节细胞免疫平衡,从而减缓哮喘的发生发展[19]。以上结果提示,射麻止喘液活性成分可能通过参与炎症反应、氧化应激、免疫平衡途径在治疗NA中发挥作用。
通过构建潜在作用靶点PPI 网络,进一步分析预测了射麻止喘液治疗NA 的核心靶点,包括NLRP3(NOD 样受体热蛋白结构域相关蛋白3)、CXCR2(CXC 趋化因子受体2)、MIF(巨噬细胞移动抑制因子)、EGFR(表皮生长因子)、RELA(核因子κB)等。NLRP3 炎症小体是固有免疫系统识别受体家族主要成员之一,在NA 的发病机制中具有重要作用[20],NLRP3 炎性小体活化能够促进Caspase-1 的产生及炎症因子释放,诱导炎症反应,进而促进中性粒细胞募集[21]。有研究[22]发现,OVA 诱导小鼠致敏后NLRP3表达与小鼠气道高反应呈正相关。使用NLRP3 抑制剂可有效减轻哮喘患者的气道高反应性[23]。中性粒细胞是哮喘免疫发病机制中的关键炎症细胞,可通过CXC 趋化因子激活CXCR2 而启动,进而被募集至哮喘患者气道中,加剧哮喘进展[24]。有研究[25]表明,通过抑制CXCR2 过表达可抑制中性粒细胞向肺部迁移,从而减少重症哮喘患者诱导痰中的中性粒细胞水平。本研究结果显示,射麻止喘液能够下调NA 小鼠肺组织NLRP3、CXCR2 mRNA 表达,降低炎症因子IL-8水平,说明射麻止喘液有抑制NA 的中性粒细胞性炎症反应的作用。
KEGG 通路富集分析显示,射麻止喘液治疗NA的主要通路包括TNF 信号通路、MAPK 信号通路、Toll 样受体信号通路、mTOR 信号通路等。TNF 介导了炎症反应、细胞免疫、肿瘤免疫等多种生理病理过程。TNF 通路激活促进炎症介质释放,如TNF-α、IL-8 等进行转录,趋化相关炎症细胞聚集,形成进一步放大炎症反应的信号[26-28];IL-8 是中性粒细胞活化的标志[29],可激活中性粒细胞向气道聚集浸润,从而导致气道高反应及加剧炎症反应[30]。当TNF通路传导异常时,可激活肺泡上皮细胞中的趋化因子受体CXCR2,进而募集中性粒细胞,放大肺部炎症的连锁反应,加速炎症发展[31]。MAPK 是调控细胞炎性反应的重要信号传导系统,是哮喘发生发展的另一条重要途径[32]。当气道上皮细胞受到刺激后,能激发p38MAPK 磷酸化后大量释放炎性介质,引发气道炎性反应[33]。被激活的MAPK 进一步激活下游相关通路,调控多种炎性细胞因子转录,如促进炎症小体NLRP3表达,加速NA发生发展[34]。Toll 样受体(Tolllike receptors,TLRs)是固有免疫系统的主要组成部分,已被证实能够调控哮喘气道炎症、气道高反应性及气道重塑的发生[35],其激活后能调控免疫系统促进炎性细胞因子和趋化因子的释放,诱导炎症反应的发生[36]。mTOR 信号通路在自噬、细胞生长增殖、分化存活等方面具有重要作用[37],其介导的自噬途径参与了NA 表型的气道炎症、气道重塑和气道高反应性等过程[38]。mTOR 过度表达会抑制自噬,导致气道出现中性粒细胞性炎症,引起巨噬细胞内NLRP3 炎性小体形成增多,并刺激炎症因子产生,加剧气道炎症及导致气道反应性增高[39-40]。因此,抑制mTOR、NLRP3 炎性小体及CXCR2 表达能减轻NA 的气道炎症反应。本研究结果显示,射麻止喘液能改善NA 小鼠肺组织炎性细胞浸润,降低IL-8 水平,可能与其抑制mTOR通路激活自噬途径有关。
综上所述,射麻止喘液可能是通过槲皮素、木犀草素、山柰酚等主要活性成分,作用于NLRP3、CXCR2等核心靶点,调控TNF信号通路、MAPK信号通路、Toll 样信号通路、mTOR 等关键信号通路,发挥抑制气道炎症反应、促进中性粒细胞凋亡、缓解气道重塑的作用,从而达到治疗NA 的目的。本研究可为射麻止喘液治疗NA 的进一步实验及临床研究提供参考,但相关研究结果仍有待进一步的生物学验证。

