丹参活性成分抗膝骨关节炎的药理研究进展
傅永升,王卫国,2,张城铭(. 山东中医药大学,山东济南 25003;2. 山东中医药大学附属医院,山东济南 25004)
骨关节炎(osteoarthritis,OA)是一种常见的慢性退行性关节疾病,其临床表现为关节软骨退化、骨赘形成和关节功能障碍[1]。流行病学研究[2]显示,我国膝骨关节炎(knee osteoarthritis,KOA)的发病率约为8.1%,且随着人口老龄化,该病的发病率逐年升高。国际骨关节炎协会(OARSI)强调保守治疗在KOA 的诊疗中具有重要的作用[3]。KOA 作为中医骨伤科学的优势病种之一,中医药治疗具有疗效明显、方法多样、不良反应少以及价格低廉等独特优势[4-5]。丹参为唇形科植物丹参(SalviamiltiorrhizaBge)的干燥根和根茎,具有抗炎、抗氧化、抗肿瘤、抗糖尿病和防止动脉粥样硬化等多种药理作用[6]。同时研究[7-8]发现,丹参活性成分在治疗KOA 方面具有潜在的优势,其可通过降低炎症反应、抗氧化应激、减轻软骨基质降解、抑制细胞凋亡及促进细胞自噬等途径,延缓骨关节退变,减轻患者关节疼痛。因此,本文对丹参活性成分防治KOA 的药理作用及其机制进行总结,以期为提高KOA的临床疗效提供思路。
1 调控炎性因子以防治KOA
促炎细胞因子为一种内源性多肽,主要来源于免疫系统细胞,其可通过抑制抗炎因子胰岛素样生长因子(insulin-like growth factor,IGF)、转化生长因子(transforming growth factor,TGF)及激活其下游炎性信号通路以介导免疫反应,加速关节软骨损伤[9]。M1巨噬细胞是OA 病理中的重要因子,可分泌大量促炎细胞和炎性介质,其中白细胞介素(interleukin,IL)-1β、肿瘤坏死因子(tumor necrosis factor,TNF)-α、IL-6、IL-15 等炎性因子可导致关节软骨进行性破坏,使KOA 的发生率增加[10-11]。运用丹参及其活性成分干预KOA,可减少软骨细胞内的炎症表达。IL-1β可诱导软骨细胞中的IL-6、环氧合酶(cyclooxygenase,COX)-2、TNF-α 与诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)含量升高。丹参素可抑制KOA 小鼠上述炎性因子产生,抑制核因子κB(nuclaer factor-κB,NF-κB)信号通路活性[12]。Wu等[13]在应用丹酚酸A 干预KOA 小鼠中,发现丹酚酸A 可降低软骨细胞前列腺素E2(Prostaglandin E2,PGE2)、TNF-α、IL-6水平,减轻滑膜炎症。丹酚酸A还可通过抑制NF-κB、p38丝裂原活化蛋白激酶(p38 mitogenactivated protein kinases,p38 MAPK)通路磷酸化以发挥抗炎作用,延缓KOA 患者的关节结构损伤[14]。孙晓娟等[15]也证明丹参酮能够抑制KOA 大鼠血清中的炎性因子,促进内皮细胞修复。另外,丹参酮I[16]、丹参酮ⅡA[17]和隐丹参酮[18]均可降低KOA 软骨中的TNF-α 含量。其中,丹参酮ⅡA 可从3 个方面干预KOA 局部炎症。其一,丹参酮ⅡA 可降低Toll样受体4(toll-like receptor 4,TLR4)、髓细胞分化初级反应蛋白88(myeloid differentiation factor 88,MyD88)等蛋白表达,抑制下游NF-κB p65 磷酸化,降低KOA 大鼠血清中IL-6、IL-1β 与TNF-α 等炎性因子释放[19]。其二,Zhou 等[20]发现丹参酮ⅡA 可下调软骨细胞中微小RNA-155(miRNA-155)及下游蛋白叉头框家族蛋白O3(forkhead box protein O3,FOXO3)的表达,减轻脂多糖(lipopolysaccharide,LPS)诱导的软骨炎症反应。其三,丹参酮ⅡA 可降低患者KOA 软骨中富半胱氨酸蛋白61(cysteine-rich angiogenic inducer 61,Cyr61/CCN1)的诱导表达,抑制IL-1β、IL-6 生成,延缓软骨细胞退变[21]。丹参提取物干预KOA 的机制包括通过抑制IL-1、IL-6、TNF-α 等炎症相关因子的生成,降低p38 MAPK/NF-κB、miR-155/FOXO3信号活性抑制炎性反应,从而减少病理性软骨破坏。丹参活性成分调控炎性因子分子机制见图1。
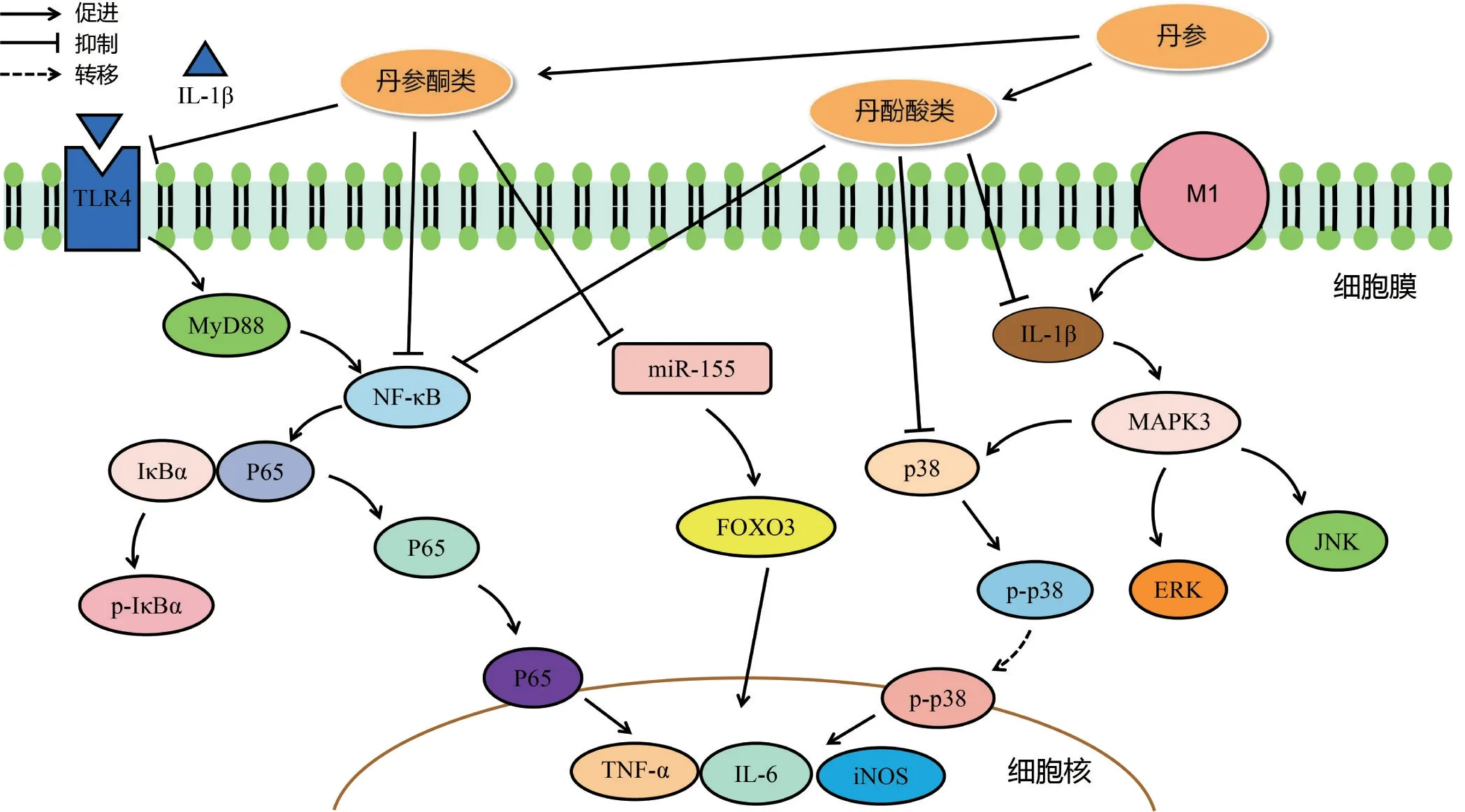
图1 丹参活性成分调控炎性因子干预膝骨关节炎(KOA)的分子机制Figure 1 Molecular mechanism of active components of Salvia Miltiorrhiza Radix et Rhizoma in regulating inflammatory factors to interfere with KOA
2 抗氧化应激以防治KOA
氧化应激是OA 进展的重要因素,可使氧化还原状态失衡,影响软骨细胞的功能与细胞外基质(extracellular matrix,ECM)的合成,引发软骨细胞变性,增加KOA 风险[22]。线粒体功能障碍可引起活性氧(reactive oxygen species,ROS)增加,导致软骨细胞抗氧化失衡。线粒体电子传递链(electron transport chain,ETC)可在TNF-α 等炎性因子作用下引发生物学功能障碍,线粒体超氧化物歧化酶2(superoxide dismutase 2,SOD2)、过氧化物还原酶3(peroxiredoxin 3,Prx3)活性降低,一氧化氮合酶(nitric oxide synthase,NOS)和脂氧合酶促进H2O2生成增多,Prx3无法与谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)将过氧化氢(H2O2)还原为水,使Prx3 转化为PrxSO2或PrxSO3,不断生成ROS,促进氧化应激和线粒体损伤,引发软骨细胞衰老、细胞凋亡与软骨基质降解[23-24]。促炎因子可诱导NOS合成iNOS,产生大量NO并与O2发生反应,形成过氧亚硝酸根(ONOO-),进而生成硝基酪氨酸引发氧化应激,影响下游炎性介质、ECM 稳态和细胞活性,损伤关节软骨[25]。Xu等[12]研究发现,丹参素可显著抑制KOA小鼠IL-1β诱导的软骨细胞中NO、IL-6和TNF-α 表达升高,减轻软骨细胞炎症反应。丹酚酸A、丹参酮ⅡA 和隐丹参酮均可降低炎性软骨中NO、iNOS 水平,减少炎症因子释放,抑制ECM 降解与细胞凋亡,避免软骨氧化损伤[13,17-18]。丹参可有效增强KOA 兔软骨细胞抗氧化能力,上调SOD、谷胱甘肽(glutathione,GSH)和过氧化氢酶(catalase,CAT)表达,抑制滑膜和关节软骨组织中脂质的氧化应激[26]。因此,当关节软骨中氧化剂和抗氧化能力之间的动态平衡受到干扰时,丹参活性成分可从分子层面增强抗线粒体氧化能力,通过抑制炎性因子与氧化酶活性,维持软骨细胞氧化还原稳态。丹参活性成分抗氧化应激分子机制见图2。
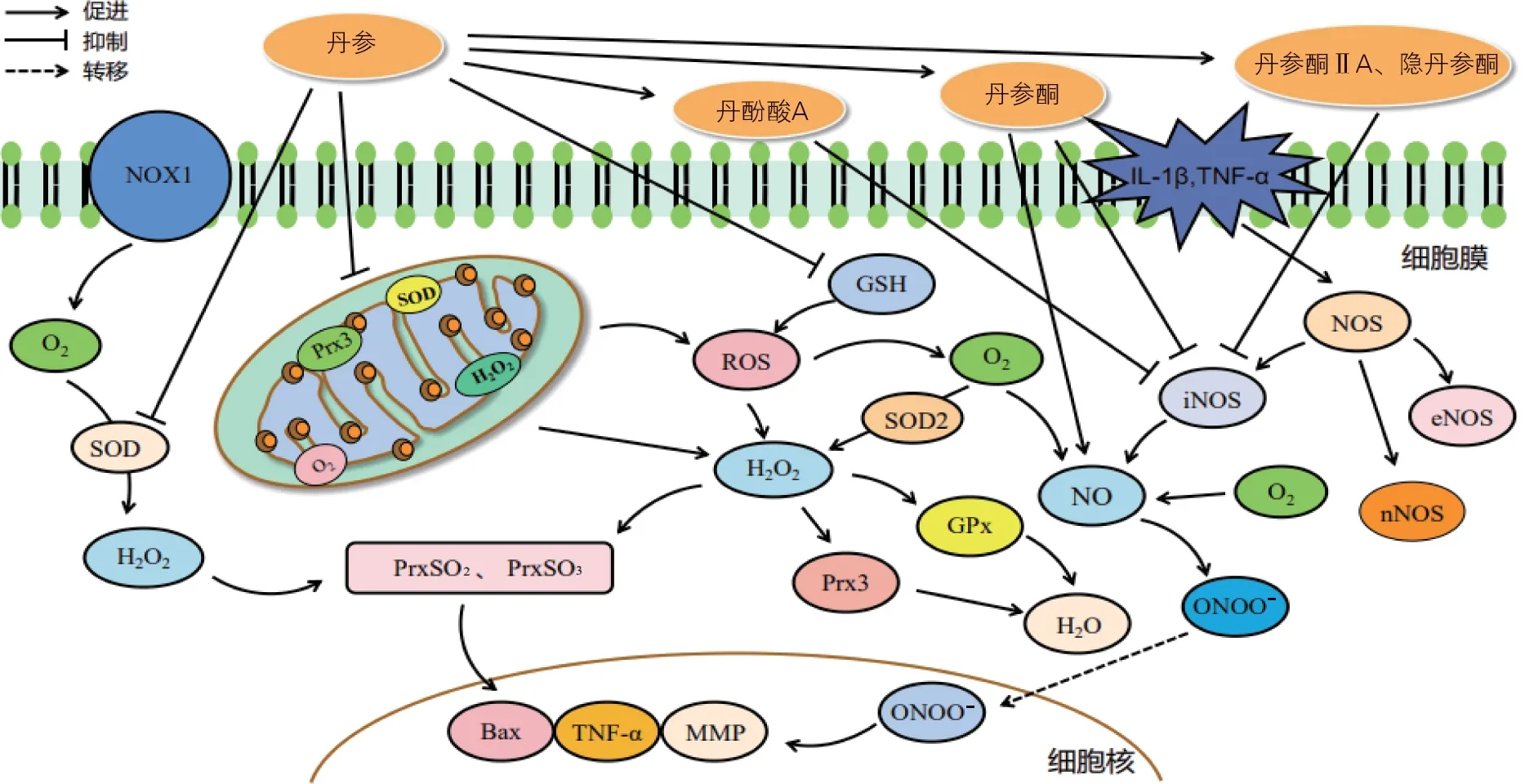
图2 丹参活性成分抗氧化应激干预膝骨关节炎(KOA)的分子机制Figure 2 Molecular mechanism of anti-oxidative stress intervention of active components in Salvia Miltiorrhiza Radix et Rhizoma on KOA
3 抑制细胞凋亡以防治KOA
炎性因子的释放可损害线粒体功能,使线粒体ATP 生成减少,并产生大量NO、ROS 以促进氧化应激,造成B细胞淋巴瘤2(B-cell lymphoma-2,Bcl-2)家族中促凋亡蛋白和抗凋亡蛋白之间的平衡紊乱,引发软骨细胞凋亡[27-28]。抗凋亡蛋白Bcl-2、Bcl-XL可抑制细胞色素c(cytochrome c,cyt-c)从线粒体释放,而促凋亡因子Bcl-2关联X蛋白(Bcl-2-associated X protein,Bax)、Bak 与BH3 相互作用结构域死亡激动剂蛋白结合可促进cyt-c 释放,cyt-c、三磷酸脱氧腺苷(deoxyadenosine triphosphate,dATP)与凋亡蛋白酶活化因子(apoptotic protease activating factor-1,Apaf-1)可结合成复合物,激活半胱天冬酶9(caspase-9),继而增强caspase-3、caspase-6 活性,诱导细胞凋亡[29]。研究[30]发现,KOA 软骨中Bax、caspase蛋白表达明显上调,而抗凋亡因子Bcl-2 受到抑制。丹酚酸A可抑制KOA小鼠中的Bax、caspase-3表达,促进Bcl-2生成,降低c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)、细胞外信号调节激酶1/2(extracellular signal-regulated kinase,ERK1/2)、p38MAPK 和NF-κB 磷酸化的水平,抑制软骨细胞凋亡[13]。Wang等[16]研究发现,丹参酮I可减轻KOA 小鼠IL-1β 诱导的软骨细胞炎性反应,减少TNF-α 表达,抑制炎症反应及细胞凋亡。miR-155 过表达可抑制LPS 诱导软骨细胞的凋亡。丹参酮ⅡA 通过靶向调节FOXO3 表达,下调IL-6、TNF-α、凋亡蛋白裂解的半胱氨酸天冬氨酸蛋白酶-3(cleaved-caspase-3)与cleaved-caspase-9 水平,发挥抗凋亡作用[20]。丹参颗粒可通过增强Janus 激酶-2(janus kinase 2,JAK2)、转录激活因子3(signal transducer and activator of transcription 3,STAT3)磷酸化活性,上调KOA 兔软骨细胞抗凋亡因子Bcl-2 水平,降低Bax、caspase-3含量以抑制细胞凋亡,提高磷酸化蛋白激酶B(p-AKT)入核表达,促进软骨细胞增殖[31]。丹酚酸B通过抑制KOA 小鼠中miR-128-3p的活性,上调其下游沉默信息调节因子1(silent information regulator 1,SIRT1)表达,减少软骨细胞凋亡[32]。上述研究表明丹参及活性成分干预KOA 时,均针对TNF-α、Bax、Bcl-2、caspase 等调节分子进行调控,增强软骨细胞活力,抑制内质网应激型凋亡通路。丹参活性成分抑制细胞凋亡分子机制见图3。
4 抑制软骨基质降解以防治KOA
Ⅱ型胶原蛋白(CollagenⅡ)和蛋白多糖是构成软骨基质的主要成分,可促进软骨细胞的增殖分化与维持ECM 的平衡,其减少可造成ECM 病理性重塑,导致KOA 的发生[33]。软骨分解因子基质金属蛋白酶(matrix metallopmteinases,MMPs)与组织基质金属蛋白酶的抑制剂(tissue inhibitor of metalloproteinase,TIMP)调节骨合成代谢和分解代谢间的平衡,软骨分解代谢因子活性水平迅速增强时,巨噬细胞无法吞噬多余的分解产物,造成分解因子过度累积转化为炎症因子[34]。其中,MMP-13 是软骨细胞退变的标志物,在KOA 病理进展中起关键作用[35]。具有血栓反应素基序的崩解蛋白和金属蛋白酶(A sisintegrin and metalloproteinase with thrombospondin,ADAMTS)参与软骨基质的降解,ADAMTS-4 和ADAMTS-5 的活性可被促炎因子激发,致使KOA 中蛋白多糖丢失[36]。骨桥蛋白(osteopontin,OPN)可抑制ADAMTS-4 的合成,减少ECM 分解[37-38]。炎性因子反复作用于软骨基质,可加速ECM 分解,造成软骨退变,形成恶性循环[39]。丹参素可抑制软骨中MMP-3、MMP-13、ADAMTS-4 和ADAMTS-5 上调,减少CollagenⅡ和蛋白多糖的分解,延缓小鼠KOA进展[12]。丹酚酸A可降低IL-1β 诱导KOA 软骨中ADAMTS-5 的表达水平,抑制MMP-1、MMP-3 与MMP-13 的升高,减少基质降解[14]。丹参酮Ⅰ可抑制KOA 小鼠CHON-13 细胞中MMP-13 表达,促进CollagenⅡ和蛋白多糖合成,防止软骨ECM 降解[16]。丹参酮ⅡA可下调软骨基质中MMP-13表达,增加TIMP-1、TGF-β和骨形成蛋白2(bone morphogenetic protein,BMP-2)含量,促进软骨细胞增殖,减少基质的降解[17]。Feng 等[18]研究发现,隐丹参酮可抑制KOA 患者NO、PGE2 及COX-2表达,抑制软骨细胞炎症介质,并降低MMP-3、MMP-13 和ADAMTS-5 的表达以促进CollagenⅡ与蛋白多糖合成。Zhang 等[40]发现,100~200 μg·mL-1浓度的丹参酮ⅡA 可显著促进KOA 大鼠软骨细胞中蛋白多糖的分泌,上调软骨生长发育因子(SOX)-6 和CollagenⅡ表达,有助于软骨细胞的增殖。SOX-9 可促进软骨ECM 生成与分化,其目标转录因子SOX-6与软骨细胞增殖密切相关[41]。综合以上研究表明,丹参活性成分通过降低MMP、ADAMTS 因子表达以抑制软骨细胞降解,其中丹酚酸A 可抑制NF-κB、p38/JNK/ERK 信号通路磷酸化活性发挥软骨基质抗分解作用。丹参活性成分抑制软骨基质降解分子机制见图4。
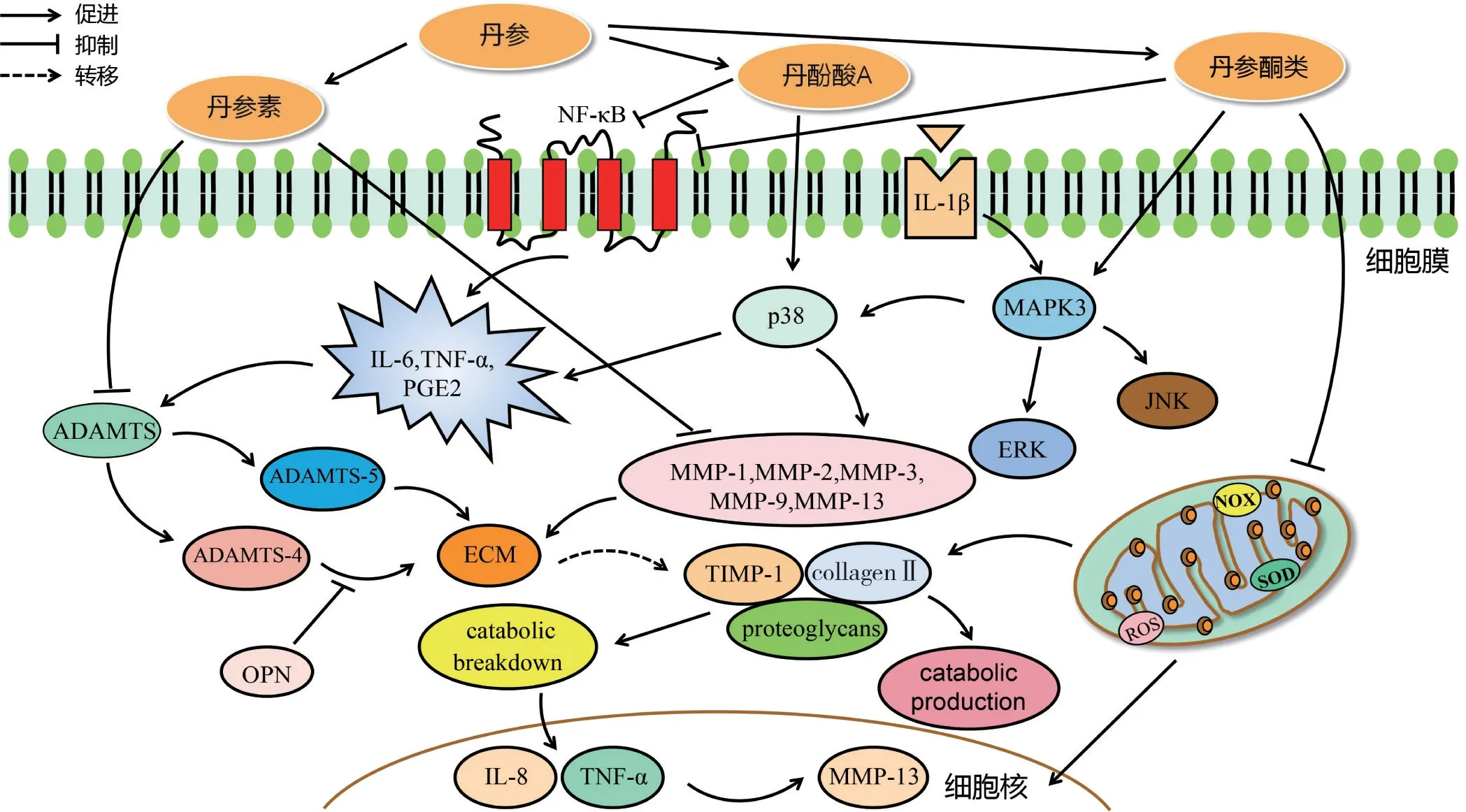
图4 丹参活性成分抑制软骨基质降解干预膝骨关节炎(KOA)的分子机制Figure 4 Molecular mechanism of inhibition of cartilage matrix degradation for intervention on KOA by active components of Salvia Miltiorrhiza Radix et Rhizoma
5 促进软骨细胞自噬以防治KOA
自噬作为细胞内的降解系统,能够在异常生理状态下保护软骨细胞,将功能受损细胞分子进行降解,并通过自噬途径对溶解物循环利用,从而维系软骨组织间的动态平衡[42]。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一种丝氨酸/苏氨酸蛋白激酶,在调节细胞代谢、凋亡、存活和增殖方面发挥着重要作用,其中mTORC1 是细胞自噬的负调节因子,抑制其活性可促进软骨细胞自噬[30]。自噬体在细胞质的双膜囊泡内产生,自噬相关基因(autophagy related gene,Atg)在生物运转过程中发挥重要作用[43]。自噬诱导物Unc-51 样激酶1(unc-51 like autophagy activating kinase 1,ULK1)与ATG13、ATG101、200 kDa 的家族相互作用蛋白(family interacting protein of 200 kDa,FIP200)共同形成复合物,在磷脂酰肌醇3 激酶催化亚基3 型(PIK3C3)、磷脂酰肌醇3-激酶调节亚基4(PI3KR4)和自噬调节因子Beclin1 的共同催化下,促进复合物吞噬体的初步形成[44]。复合物转移至内质网,ATG12、ATG5、ATG16L1 相结合激化吞噬体进一步成熟。ATG4 可在细胞质中促进微管相关蛋白轻链3(light chain 3,LC3)-Ⅰ生成,LC3-Ⅰ可与磷脂酰乙醇胺结合,转化为LC3-Ⅱ与成熟吞噬体融合成为自噬体,自噬体、溶酶体相结合转变为自噬溶酶体,最终通过水解酶降解其中物质[45-46]。而自噬体中的Beclin1、LC3、ULK1 等活性降低,会导致软骨细胞自噬缺陷,引发ECM 降解及细胞凋亡,加快KOA 进展[47]。Sun 等[32]研究发现,丹酚酸B 可上调KOA 小鼠软骨ATDC1 细胞中Beclin1 和LC3 表达,抑制miR-128-3p 水平升高,增强SIRT1 活性以促进软骨细胞自噬。相关研究表明,SIRT1 蛋白在OA 软骨细胞中的表达显著下调,可降低调节因子ATG5、Beclin1 和LC3 活性,减弱软骨细胞的自噬能力[48]。因此,丹酚酸B 通过干预miR-128-3p 活性可增强SIRT1 表达,提高自噬活性,保护关节软骨免于损伤。丹参活性成分促进软骨细胞自噬的分子机制见图5。
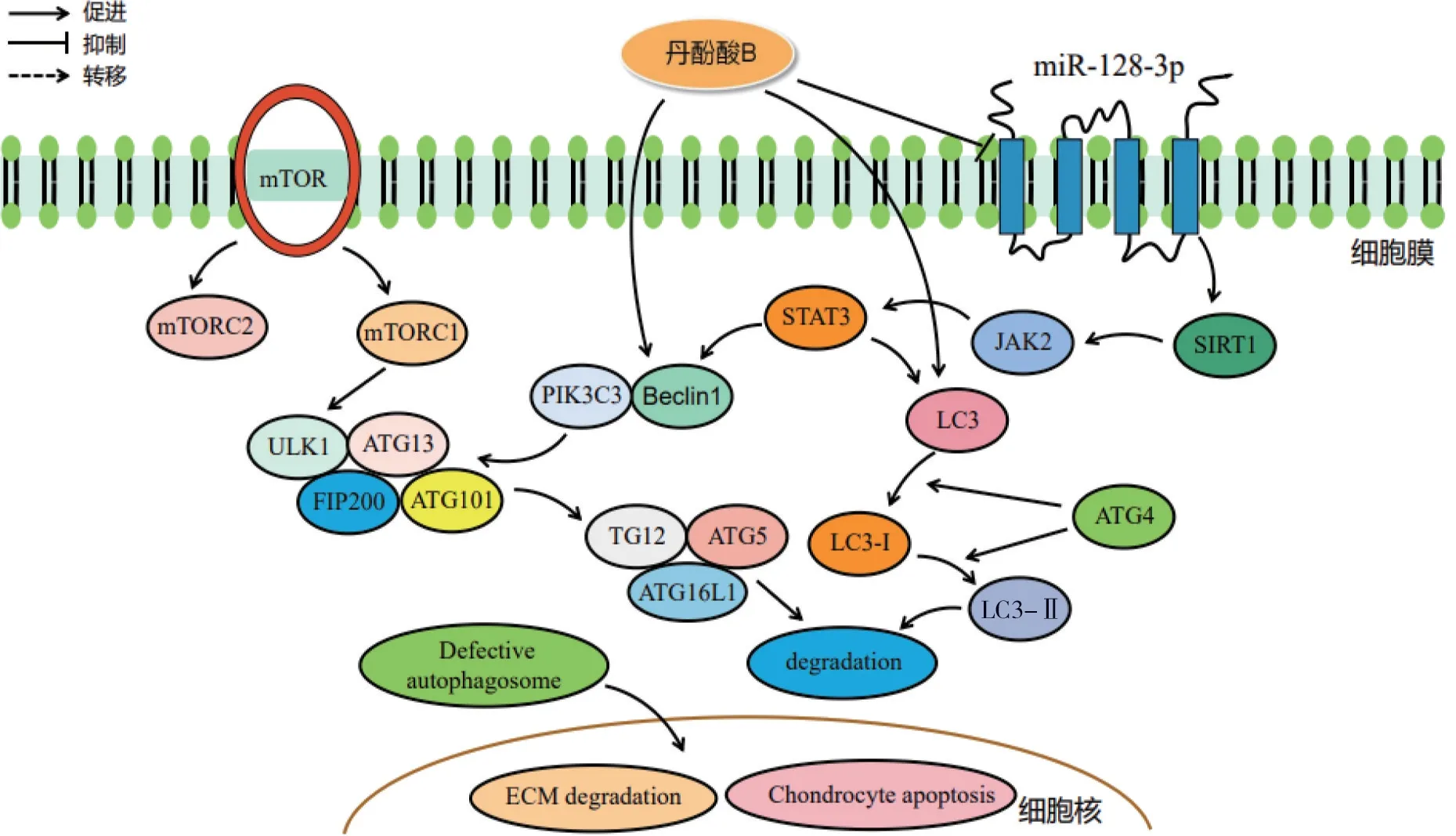
图5 丹参活性成分促进细胞自噬干预膝骨关节炎(KOA)的分子机制Figure 5 Molecular mechanism of active components of Salvia Miltiorrhiza Radix et Rhizoma in promoting autophagy to interfere with KOA
6 讨论
中医将膝骨关节炎(KOA)归属“骨痹”范畴。清·张璐于《张氏医通》载:“膝为筋之府,膝痛无有不因肝肾虚者,虚则风寒湿气袭之”。该病与肝、脾、肾三脏密切相关,以肝肾亏虚为本,风寒湿邪侵犯关节为标,瘀血阻滞为外在病理因素,筋脉不通为关键病机,属本虚标实之证[49]。丹参具有祛瘀止痛、活血通经之功效,其抗KOA 理论机制与中医病因病机相呼应。KOA 的重要病理特征为软骨基质降解、软骨细胞增殖和凋亡失衡。综上所述,丹参活性成分可抑制促炎因子诱导的软骨ECM 降解、细胞凋亡、氧化应激与激发软骨细胞自噬等变化,促进Ⅱ型胶原合成,增强骨细胞增殖,维持骨基质稳态;还可通过NF-κB、p38MAPK 等信号通路,减轻关节疼痛、滑膜水肿,延缓关节软骨退变与重构。
以丹参酮为代表的丹参脂溶性成分是松香烷二萜类化合物[50]。丹参酮Ⅰ、丹参酮ⅡA 和隐丹参酮不仅能直接抑制软骨基质降解,还可通过下调炎性因子水平间接促进软骨细胞增殖分化,抑制细胞凋亡以防治KOA。丹酚酸类化合物为水溶性成分,受脂溶性磷脂双分子层结构的生物膜限制主要分布在细胞外液中。丹酚酸种类繁多,其中研究较多的有丹酚酸A、丹酚酸B 与丹参素。与丹参酮类化合物相类似,丹酚酸类化合物均具有调控炎性因子和抗氧化作用,而丹酚酸B中所具有的增强自噬活性在丹酚酸A中尚未研究发现。
尽管丹参活性成分治疗KOA 的研究已取得了重大的成果,但仍有进一步研究的价值。首先,丹参活性成分种类多且复杂,可通过网络生物信息学对丹参活性成分进行深入挖掘,以确定其有效成分及作用靶点,更全面地预测丹参治疗KOA 的作用机制。第二,目前,丹参抗KOA 已有的靶点和成分的研究较少,且基础研究较为局限。因此,运用丹参活性成分干预KOA,还需要从多组学、多层次进一步研究其对细胞凋亡及自噬的具体作用机制,以获得更多证据证明丹参活性成分抗骨关节退行性病变的作用。第三,可结合丹参活性成分已有的药理研究成果开展相关的临床试验,以促进丹参有效成分的临床应用。第四,进一步探寻高活性的丹参成分,明确其结构、药理作用和机制,为中药防治KOA 提供新的方法。

