肝动脉化疗栓塞术联合卡瑞利珠及阿帕替尼治疗中晚期肝癌的安全性及临床疗效观察
梅 琪,袁 牧,钱景瑜,刘若宇,谭玉林
(蚌埠医科大学第一附属医院 介入科,安徽 蚌埠 233004)
肝癌目前仍是全球最常见的恶性肿瘤之一。在中国,肝癌患病率和死亡率分别居恶性肿瘤第五位和第三位[1]。中国原发性肝癌发病率居世界之首,且发病率仍逐年增长。原发性肝癌发病与乙型肝炎病毒或丙型肝炎病毒感染密切相关,我国主要为乙型肝炎病毒的慢性感染。由于肝脏缺乏痛觉神经,肝癌早期临床症状隐匿,所以多数病人确诊时已处于中晚期,失去外科手术机会。多数病人只能选择传统介入治疗、放射治疗、分子靶向治疗及免疫治疗等手段。传统介入治疗如肝动脉化疗栓塞术(TACE)是中晚期原发性肝癌的推荐治疗方法,但TACE属于姑息性治疗,对改善病人近期疗效及延长生存期没有显著优势[2]。
近几年肝癌的靶向治疗及免疫治疗相关研究进展迅速,靶向治疗或免疫治疗对延长病人生存时间、改善预后有显著优势,但单药治疗肿瘤控制率较低且不良反应较大。因此探索联合用药方式以提高中晚期肝癌临床疗效是目前乃至未来的研究趋势。阿帕替尼是我国自主生产的一种新型的酪氨酸激酶抑制剂,它可通过影响新生毛细血管的形成,进而抑制肿瘤的生长[3]。卡瑞利珠是我国自主研发的一种程序性死亡蛋白1(programmed cell death protein 1,卡瑞利珠),是Ⅰ型跨膜糖蛋白,与免疫功能相关,也是CD28/CTLA-4家族T细胞调控器的一个成员[4]。研究[5]显示,阿帕替尼联合卡瑞利珠在晚期肝癌、胃癌或贲门癌治疗中体现良好的临床疗效。本研究探讨TACE联合卡瑞利珠及阿帕替尼治疗中晚期肝癌的近远期疗效及安全性,以期为临床治疗提供指导与依据。
1 资料与方法
1.1 一般资料
收集2019年1月至2020年6月我院接受TACE联合阿帕替尼治疗的肝癌病人20例作为对照组,接受TACE联合卡瑞利珠及阿帕替尼治疗的肝癌病人20例作为观察组,所有病人均经病理或临床诊断为原发性肝细胞癌(HCC)。纳入标准:(1)符合卡瑞利珠用药指征及 TACE 手术指征;(2)有符合 mRECIST 标准的可测量病灶;(3)Child-Pugh A或B级,ECOG 评分 0~2分;(4)既往未接受全身系统性抗肿瘤治疗。排除标准:(1)有肺纤维化史、间质性肺炎、尘肺、放射性肺炎、药物相关肺炎等肺功能严重受损病人;(2)有未能良好控制的心脏临床症状或疾病,如NYHA2 级以上心力衰竭、不稳定型心绞痛、1年内发生过心肌梗死等;(3)有自身免疫缺陷性疾病或病史;(4)预计生存期<3个月。2组病人一般资料差异无统计学意义(P>0.05)(见表1),具有可比性。
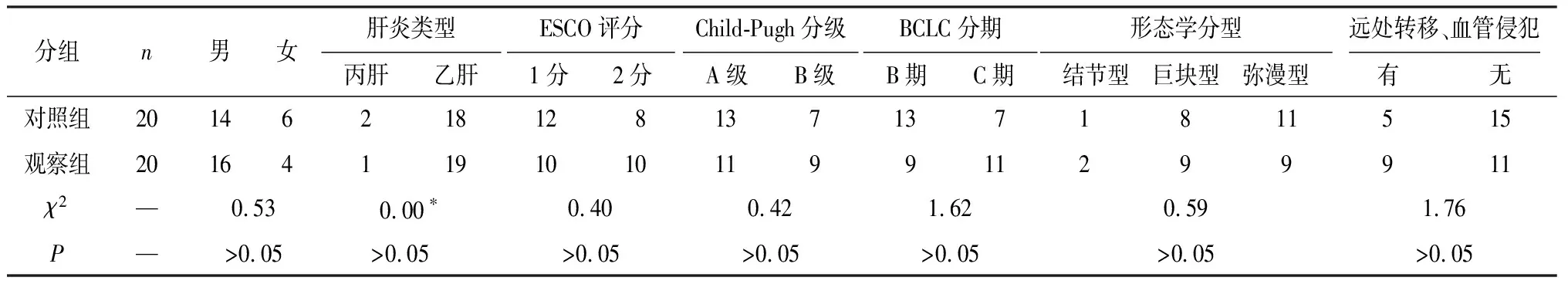
表1 2组病人一般资料比较(n)
1.2 方法
1.2.1 TACE治疗 改良Seldinger法穿刺右股动脉,置入5F导管鞘,引入5F-RH导管,超滑导丝引导下选择至肝总动脉行DSA造影,观察病灶位置、大小、血供情况。选择性超选至供血动脉灌注雷替曲塞4 mg、阿霉素30 mg、超液化碘油10 mL。复查造影确定供血动脉基本栓塞。术毕拔管包扎,给予保肝对症治疗。
1.2.2 用药计划 所有病人均签署外院自购药物使用同意书。对照组于TACE术后待栓塞综合征好转后开始口服甲磺酸阿帕替尼(江苏恒瑞),起始剂量250 mg/d,若病人难以耐受,则剂量减为125 mg/d,如出现严重不良反应,则停止用药。待症状缓解后剂量恢复至口服250 mg/d。随访期间根据检查结果决定是否再行TACE治疗。观察组于TACE术后待栓塞综合征好转后静脉滴注卡瑞利珠单抗(江苏恒瑞)每次200 mg,每3周给药一次。同时开始口服阿帕替尼,用药计划同对照组。
1.3 观察指标
所有病人采用医院病历系统随访或电话随访,采用腹部增强CT或MRI检查,每3个月进行一轮疗效及安全性评估。随访终点:(1)依据mRECIST标准判定疾病进展;(2)发生不可耐受的不良反应;(3)病人死亡。
依据mRECIST评价标准[6]判定疗效,分为完全缓解(complete responce,CR)、部分缓解(partial responce,PR)、疾病稳定(stable disease,SD)、疾病进展(progressive disease,PD)。计算客观缓解率(ORR)=(CR+PR)例数/总例数×100%;疾病控制率(DCR)=(CR+PR+SD)例数/总例数×100%。定义无进展生存期(PFS)为开始免疫或靶向治疗起至肿瘤进展的时间,总生存期(OS)为联合治疗起至病人死亡。随访截止时,未达到终点事件者作删失处理。
随访记录病人心肌酶谱、甲状腺功能、血常规及肝肾功能等指标,依据美国国立癌症研究院通用毒性反应5.0标椎(NCI-CTC 5.0)评价2组治疗安全性。
1.4 统计学方法
采用χ2检验、Kaplan-Meier生存分析和log-rank检验。
2 结果
2.1 2组病人近期临床疗效比较
所有病人治疗3个月后复查肝脏增强CT或MRI,观察组ORR为50.0%(10/20),高于对照组的20.0%(4/20)(P<0.05);观察组DCR为85.0%(17/20),与对照组的60.0%(12/20)差异无统计学意义(P>0.05)(见表2)。

表2 2组病人近期临床疗效比较[n;百分率(%)]
2.2 2组病人生存期比较
随访截至2021年9月1日,2组病人随访6~16个月,对照组中2例未达到PFS,观察组7例未达到PFS,2组差异有统计学意义(P<0.05)(见图1)。观察组PFS均值为9.49个月(95%CI:7.75~11.23),明显高于对照组的7.33个月(95%CI:5.84~8.81);观察组中位PFS 为8.0个月(95%CI:4.59~7.41),明显高于对照组的 6.0个月(95%CI:6.37~9.63)。所有病人共3例死亡,其中观察组2例,对照组1例,中位生存期未达到。

2.3 2组病人一般不良反应比较
TACE术后不良反应以栓塞综合征为主,观察组发热2例(10.0%),疼痛7例(35.0%),胃肠道反应3例(15.0%);对照组发热5例(25.0%),疼痛12例(60.0%),胃肠道反应4例(20.0%),2组差异无统计学意义(P>0.05)(见表3),经给予对症治疗后均好转。
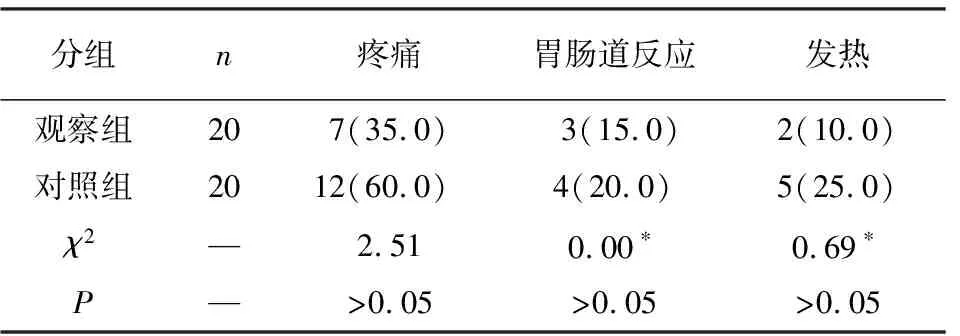
表3 2组TACE治疗后不良反应比较[n;百分率(%)]
2.4 2组药物治疗相关不良反应比较
观察组病人不良反应均为1~2级,经对症支持治疗后缓解。对照组出现3例3级不良反应,其中2例高血压、1例手足综合征,经停药或减量及对症治疗后缓解,其余均为1~2级。2组均未出现治疗相关死亡。除观察组心肌酶升高明显高于对照组(P<0.01)外,2组其他不良反应差异均无统计学意义(P>0.05)(见表4)。

表4 2组药物治疗相关不良反应比较[n;百分率(%)]
3 讨论
目前临床上针对错失手术时机的HCC病人的主要治疗手段是TACE,载药微球因使肿瘤局部的血药浓度较高的同时降低全身血药浓度,以达到减少并发症的目的[7],DEB-TACE得以广泛应用于临床。但无论是cTACE还是DEB-TACE,单纯治疗往往难以达到肿瘤完全坏死,且容易复发,尤其是肿瘤较大时,病人常需多次治疗,对肝功能造成严重损害。
TACE术后细胞处于缺氧状态,刺激肿瘤血管内皮生长因子(VEGF)增加,改变肿瘤微环境,促进病灶新生血管形成,从而导致肿瘤复发[8]。甲磺酸阿帕替尼是一种选择性较高的小分子新型VEGFR-2多激酶抑制剂,通过抑制VEGF/VEGFR-2通路的活化,达到限制血管内皮增殖、迁移及管腔形成的目的,抑制肿瘤新生血管的形成,进而抑制肿瘤的复发及转移[9-10]。HOU等[11]研究表明,阿帕替尼在晚期肝细胞癌中的总ORR和DCR分别为30.4%和65.2%,mOS和mPFS分别为13.8和8.7个月,远期疗效优于单纯TACE治疗。
此外,肝癌发生是一个多因素、多环节共同作用的复杂过程,肝脏的长期慢性炎性反应使卡瑞利珠受体上调,促进免疫细胞自发凋亡而诱导HCC的发生与发展,因此认为免疫治疗是治疗HCC的新方向[5,12]。卡瑞利珠单抗是我国自主研发的卡瑞利珠抑制剂,其在中晚期肝癌治疗中体现出了良好的疗效和相对较低的不良反应。但也有研究[13]表明,大比例HCC病人不能通过卡瑞利珠单一疗法获得持久反应。目前临床上为取得更好的疗效,多采用多种免疫制剂联合或靶向与免疫联合治疗。本研究采用靶向联合免疫结合传统介入手术的治疗方法,结果显示,联合治疗后3个月ORR为50.0%,DCR为85.0%,mPFS为8个月,这与黄剑等[13]研究显示的DCR 87.5%、mPFS长达9个月大致相仿。
联合治疗表现出较高的疗效的同时,不良反应也因而得到关注及深入研究。一项阿帕替尼联合卡瑞利珠治疗HCC和胃癌的Ⅰ期临床研究[5]中,33例接受联合治疗的HCC病人,20例(60.2%)出现3级及以上TRAE,最常见的是高血压及AST升高,发生率均为15.2%,所有病人均未出现治疗相关死亡。本研究中2组病人治疗后TRAE最常见的是继发性高血压及手足综合征,与文献[14]报道的阿帕替尼常见不良反应相符。其次为肝功能损害发生率较高,主要表现为AST升高,可能与卡瑞利珠与受体结合后,激活T细胞攻击自身组织有关[15]。也有国内报道[16]称肝癌为免疫治疗发生相关肝脏不良事件的危险因素,因此肝癌行免疫治疗病人需加强保肝治疗。皮肤毛细血管增生(RCCEP)是卡瑞利珠最常见的TRAE,本研究中观察组发生率为25%,均为轻症,无因RCCEP停止治疗病例。王锋等[17]研究表明,卡瑞利珠联合靶向治疗时,RCCEP发生率较单独用药发生率低。多位学者[18-19]研究表明,RCCEP发生率与卡瑞利珠疗效呈正相关关系。专家共识[20]提出,RCEEP可作为预测卡瑞利珠疗效的临床生物标记。其余TRAE均在对症支持治疗后得到有效控制。
综上,TACE联合卡瑞利珠与阿帕替尼治疗中晚期肝癌安全可控,疾病控制率较高,可有效延长病人生存期,值得临床推广。但本研究具有一定局限性,由于样本量较小,数据结果可能存在偏倚;另外随访时间较短,大部分病人未到达OS终点时间,HCC联合治疗的远期疗效还需进一步大样本长时间的研究。

