益景汤对早期糖尿病视网膜病变大鼠视网膜miRNA表达的影响
王丽,邱心悦,孟春,刘光辉
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病(diabetes mellitus,DM)常见的微血管并发症,我国作为全球DM 患者人数最多的国家,DR 患病率逐年增加,致盲率也在逐年升高,给社会造成了巨大的经济负担[1]。DR 根据病程分为非增殖期和增殖期,增殖性DR 是患者出现视力损害和失明的主要原因。DR 一旦进入增殖期则不可逆转,因此,对DR 进行积极有效的早期干预是防治DR 的重要策略。中医药在DR 的早期防治中扮演了重要的角色[2]。本团队的前期临床研究[3-5]发现,益景汤治疗早期DR 具有较好的疗效,能够在一定程度上改善患者视网膜微循环、减轻黄斑水肿、调控血管内皮生长因子(vascular endothelial growth factor,VEGF)的水平,基础研究[6-8]发现,益景汤能够抑制DM 大鼠视网膜周细胞的凋亡,缓解视网膜毛细血管床的减少,改善视网膜血供,减轻视网膜渗漏。近年来,多项研究[9-12]表明,微小RNA(micro RNA,miRNA)在DR 发生发展及治疗方面发挥重要作用。为进一步探讨益景汤干预早期DR 的分子机制,本研究拟通过小RNA 测序筛选出可能参与益景汤干预早期DR 发生发展的miRNA,为中医药防治早期DR提供新的方法和实验依据。
1 材料与方法
1.1 实验动物
30 只SPF 级健康雄性SD 大鼠,2 月龄,体质量(200±20)g,购买自福州诺顿斯生物科技有限公司,许可证号为SYXK(闽)2020-0002,饲养于福建中医药大学实验动物中心。实验前适应性喂养7 d,自由进食,室温20~22 ℃,昼夜循环照明。本研究实验动物及实验所用条件符合国家科学技术委员会的《实验动物管理条例》相关规定。
1.2 药品、试剂与仪器
链脲佐菌素(美国Sigma 公司,V900890-100MG),TruSeq 小RNA 样本制备试剂盒(美国Illumina公司,RS-200-0012),mirVana™miRNA 分离试剂盒(美国Ambion 公司,AM1561),SuperScript Ⅱ逆转录酶、Qubit RNA 定量检测试剂盒(美国Invitrogen 公司,18064-014、Q10211),RNA 分析试剂盒、高灵敏度DNA 芯片(美国Agilent 公司,5067-1511、5067-4626),Qubit DNA 高灵敏度荧光定量试剂盒(美国Invitrogen 公司,Q32854),通用型SYBR快速定量试剂盒、DNA 文库定量试剂盒(美国KAPA Biosystem 公司,KK4602、KK4808)。2100 生物分析仪(美国Agilent 公司,J06-02),Qubit 2.0 荧光计(美国Invitrogen公司,Q32871),紫外透色仪(美国Clare Chemical Research 公司,D195M),聚合酶链式反应(polymerase chain reaction,PCR)热循环仪(美国MJ公司,B01-01)。
益景汤由生黄芪、山药、茯苓、生地黄、玄参各15 g,赤芍10 g,苍术、当归各9 g,川芎6 g,桃仁、红花各5 g 组成,中药材由福建中医药大学附属人民医院提供。每次取益景汤1 剂,用10 倍体积纯净水浸泡30 min 后煮1.5 h,静置冷却过滤,加入圆底烧瓶,使用旋转蒸发仪浓缩,制成1 g/mL 益景汤药液,灭菌玻璃瓶灌装,密封避光4 ℃冰箱保存备用。
1.3 DM模型的建立
20 只动物禁食12 h 后,将链脲佐菌素使用0.1 mmol/L、pH 为4.5 的无菌柠檬酸缓冲液溶解,配置成1%溶液后,以70 mg/kg 剂量进行一次性腹腔注射。72 h 后大鼠尾静脉取血检测血糖水平,血糖浓度≥16.7 mol/L即视为DM模型制备成功。
1.4 分组与给药
将造模成功的20 只大鼠采用随机数字表法分为模型组(model group,MG)和益景汤组(YijingDecoction group,YJG),另将常规喂养的大鼠设为对照组(control group,CG),每组10 只。根据人与大鼠的临床等效剂量,YJG 组大鼠每日灌胃益景汤12.50 g/kg,并于取材前1 h给药1次;CG组、MG组大鼠灌胃等体积0.9%氯化钠注射液,处死前1 h 灌胃1次,3组均干预16周。
1.5 取材
3 组大鼠干预16 周后,记录体重,麻醉处死,立即摘除双侧眼球,在冰水中剥离视网膜后,置于-80 ℃冰箱中保存,以备小RNA及PCR检测使用。
1.6 总RNA提取与小RNA通用制备
视网膜组织研磨并分离核酸蛋白后提取RNA,采用紫外分光光度计测定RNA 纯度,通过琼脂糖凝胶电泳检测RNA 的质量,生物分析仪检测RNA 完整值(RNA integrity number,RIN)。确定总RNA 合格后,对其进行定量,利用6%聚丙烯酰胺凝胶电泳分离并回收纯化22~30 nt范围内的小RNA。
1.7 小RNA文库构建和测序
构建小RNA 文库,具体过程是分别在小RNA加上3'接头和5'接头,利用与3'接头反向互补的引物反转录扩增出cDNA,最后进行15 个循环的PCR扩增获得小RNA 文库,采用6%聚丙烯酰胺凝胶电泳分离并回收纯化。然后采用高灵敏度DNA 片段生物分析仪对文库进行质控,以保证PCR 切胶产物片段大小符合后续测序要求。最后采用高通量测序技术对该文库进行测序。
1.8 miRNA分析及靶基因预测
将测序获得的序列与miRBase v22 数据库中大鼠已知的miRNA 进行对比,采用分析软件Bowtie 1.1.1、miRDeep2、R 语言对已知miRNA 及预测miRNA 进行表达量标准化及相关性分析,采用R 包(EdgeR、Limma)对各组样本进行miRNA 差异表达分析。然后利用Ensemble 数据库、miRanda 靶基因预测软件对差异miRNA 进行靶基因预测,并对靶基因进行基因本体论(gene ontology,GO)、Pathway 分析,以判定差异miRNA 主要影响的生物学功能和通路。
1.9 PCR法检测差异miRNA的表达
根据小RNA 测序初筛结果,进一步选择差异倍数较大的miRNA 进行PCR验证,所有引物序列如表所示(表1)。取适量RNA 在逆转录体系中合成cDNA,以此为模板加入靶基因上下游引物,进行PCR 扩增。使用Sequence Detector System 软件进行分析扩增反应所得的数据,以U6 为内参基因,釆用Ct法确定各miRNA的相对表达量。

表1 PCR实验相关引物信息
1.10 统计学方法
应用HiSeq 2000 测序统计软件对数据进行统计学分析,筛选样本间差异表达的miRNA,采用显著性P值和差异倍数(fold-change,FC)作为差异表达的判断标准,当P<0.05,且FC≥Log2FC≥1,判断为上调miRNA;当P<0.05,且FC≤Log0.5FC≤-1,判断为下调miRNA。FC 值差异倍数越大,说明miRNA 在2 个分组样本中的表达差异越大。PCR 验证实验中符合正态分布且方差齐的计量资料以均数±标准差(±s)表示,采用方差分析(ANOVA)进行多组变量间的相互比较,两两比较采用LSD-t检验。当P<0.05时,认为差异有统计学意义。
2 结果
2.1 样本质控
视网膜总RNA 在260 nm/280 nm 处吸光度在1.9~2.1 A 之间;琼脂糖凝胶电泳检测28 S 和18 S 处条带明亮、清晰、锐利,28 S 和18 S 处的RNA 比值≥1.5∶1;Qubit核酸分析试剂盒定量总RNA>2 μg。
2.2 3组miRNA片段长度分析
样本测序得到的原始图像经过转化得到数据,去除测序质量较低、有5'接头污染、没有3'接头序列、包括poly A 和小于18 nt 的小片段等,得到干净序列统计小RNA 片段的长度分布图(图1)。3 组大部分的小RNA长度集中在21~24 nt,峰值出现在22 nt,符合miRNA的长度特征。
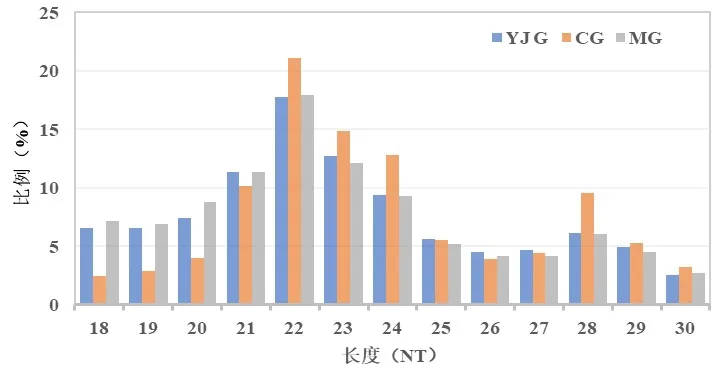
图1 3组小RNA片段长度分布
2.3 3组已知miRNA差异表达分析
筛选出644 个已知miRNA,其中差异miRNA 共59 个。干预16 周后,与CG 组比较,MG 组35 个miRNA 上调、6 个miRNA 下调,YJG 组20 个miRNA上调、4 个miRNA 下调;与MG 组比较,YJG 组6 个miRNA 上调、13 个miRNA 下调;其中,1 个上调miRNA(miR-673-3p),11 个下调miRNA(miR-1-3p、miR-130a-5p、miR-133a-3p、miR-133b-3p、miR-1b、miR-206-3p、miR-214-3p、miR-23b-5p、miR-31a-3p、miR-451-5p、miR-466b-3p)为益景汤干预DM 大鼠后,发生相反变化趋势的差异性miRNA,即3 组共同差异性表达miRNA(图2、表2-表4),差异均有统计学意义(均P<0.05)。

表2 YJG组和CG组差异表达miRNA
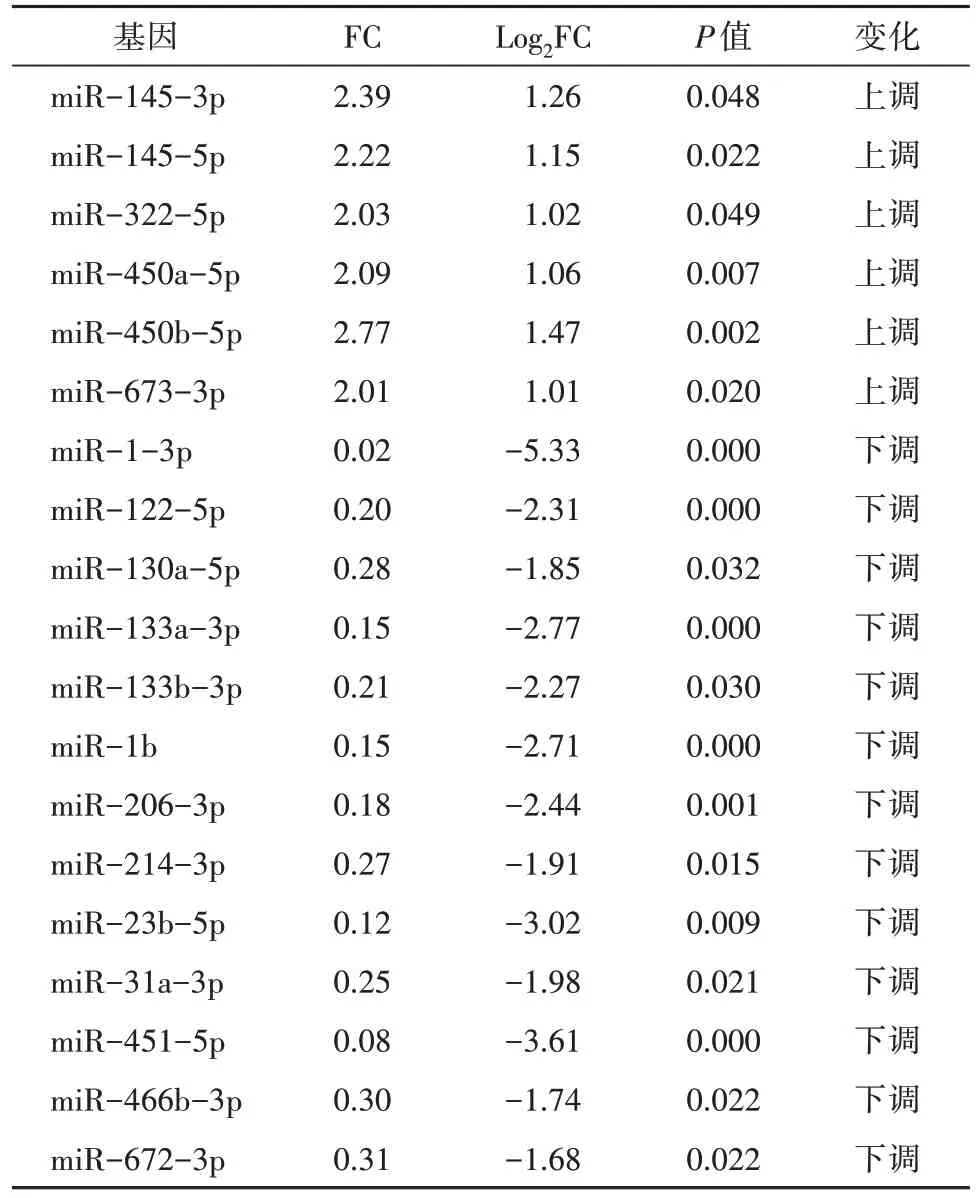
表3 YJG组和MG组差异表达miRNA
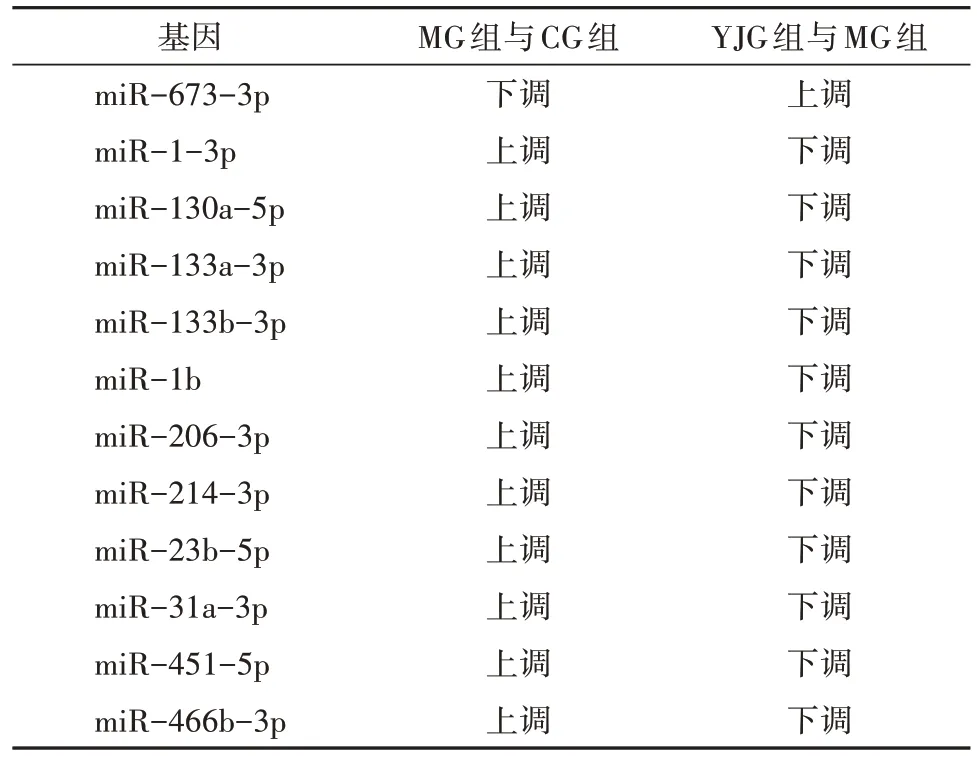
表4 3组共同差异性表达miRNA
2.4 3组新发现miRNA差异表达分析
3 组筛选出242 个新发现的miRNA,其中差异miRNA 共105 个(图3)。与CG 组比较,MG 组50 个miRNA 上调,15 个miRNA 下调;与CG 组比较,YJG组55 个miRNA 上调,20 个miRNA 下调;与MG 组比较,YJG 组16个miRNA 上调,6个miRNA 下调,差异均有统计学意义(均P<0.05)。
图3 3组新发现miRNA差异表达散点图
2.5 差异表达miRNA的靶基因
采用miRanda 预测软件比对Ensemble 数据库,结合位点自由能阈值≥140,结合位点分值阈值≤-20 kcal/mol,取预测结果前10 名作为靶基因预测结果(表5)。

表5 益景汤干预DM大鼠前后差异表达miRNA相关靶基因
2.6 靶基因的GO分析结果
差异基因主要涉及生物学过程方面的多种蛋白的转录调节,其次是分子功能方面核苷酸三磷酸酶、GTP 酶等活性调节,还与多种细胞成分有关(图4)。
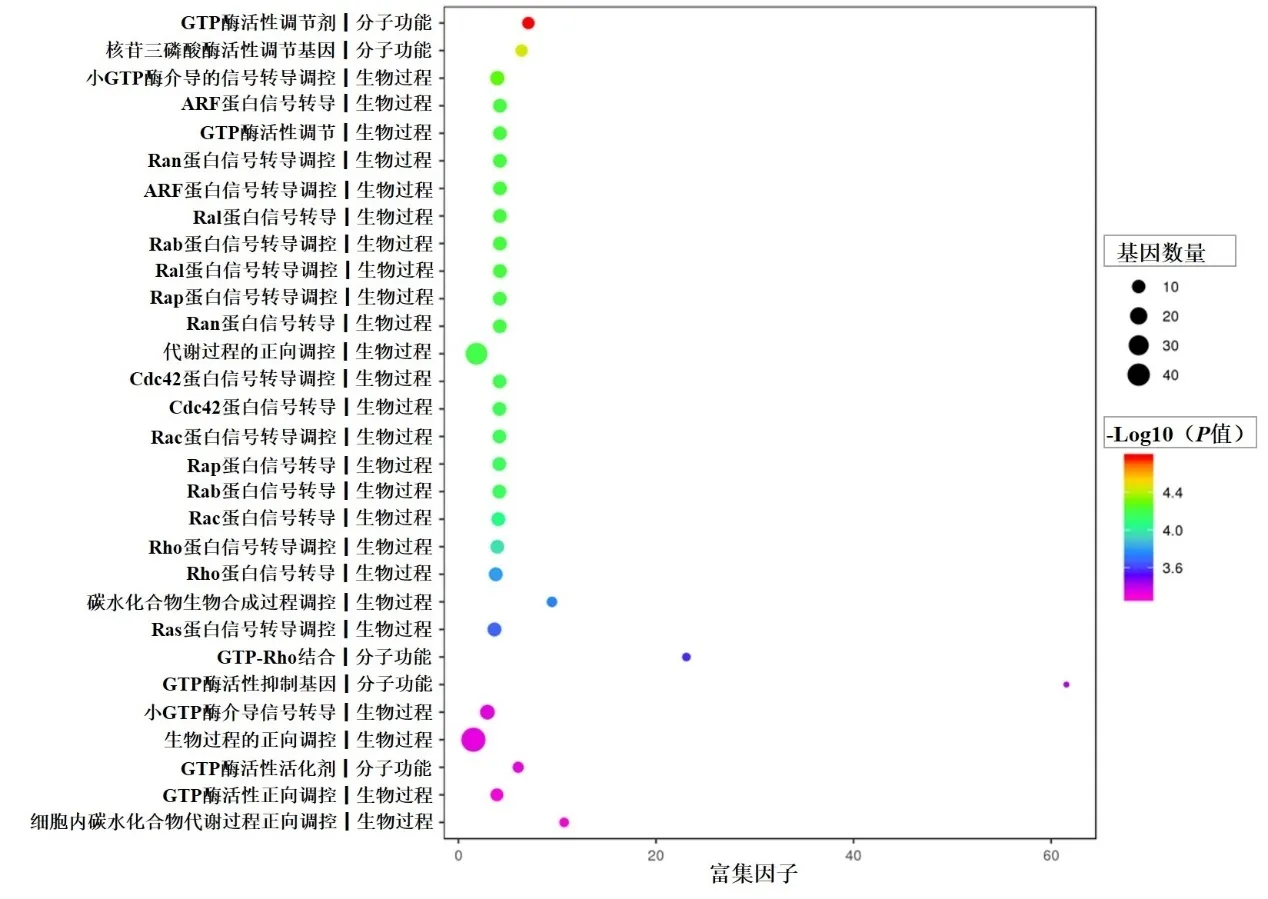
图4 靶基因的GO分析
2.7 靶基因的Pathway分析结果
利用KEEG 数据库对靶基因进行Pathway分析,发现靶基因关联的通路主要是肿瘤相关的信号通路和糖脂代谢相关通路(图5)。

图5 靶基因的Pathway分析
2.8 PCR验证
3 组间大鼠视网膜12 个差异性miRNA 的表达比较(表6、表7),差异均有统计学意义(FmiR-673-3p=22.938,P=0.002;FmiR-1-3p=42.288,P=0.000;FmiR-130a-5p=9.088,P=0.015;FmiR-133a-3p=15.912,P=0.004;FmiR-133b-3p=14.296,P=0.005;FmiR-1b=62.253,P=0.000;FmiR-206-3p=8.999,P=0.016;FmiR-214-3p=10.757,P=0.010;FmiR-23b-5p=112.387,P=0.000;FmiR-31a-3p=16.475,P=0.004;FmiR-451-5p=5.817,P=0.039;FmiR-466b-3p=122.070,P=0.000)。
表6 益景汤对DM大鼠视网膜部分miRNA表达的影响(±s,n=3)
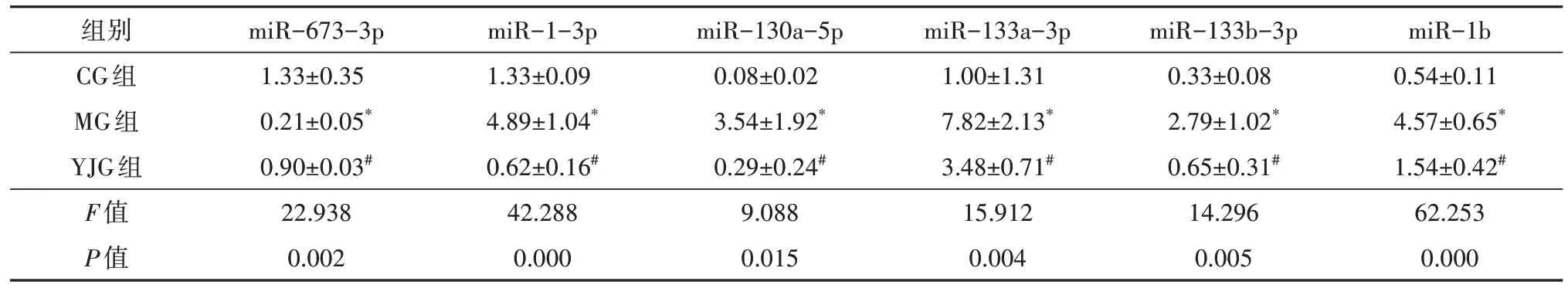
表6 益景汤对DM大鼠视网膜部分miRNA表达的影响(±s,n=3)
注:* 与CG组比较,P<0.05;# 与MG组比较,P<0.05;DM 糖尿病;CG 对照组;MG 模型组;YJG 益景汤组。
组别CG组MG组YJG组F值P值miR-673-3p 1.33±0.35 0.21±0.05*0.90±0.03#22.938 0.002 miR-1-3p 1.33±0.09 4.89±1.04*0.62±0.16#42.288 0.000 miR-130a-5p 0.08±0.02 3.54±1.92*0.29±0.24#9.088 0.015 miR-133a-3p 1.00±1.31 7.82±2.13*3.48±0.71#15.912 0.004 miR-133b-3p 0.33±0.08 2.79±1.02*0.65±0.31#14.296 0.005 miR-1b 0.54±0.11 4.57±0.65*1.54±0.42#62.253 0.000
表7 益景汤对DM大鼠视网膜部分miRNA表达的影响(±s,n=3)
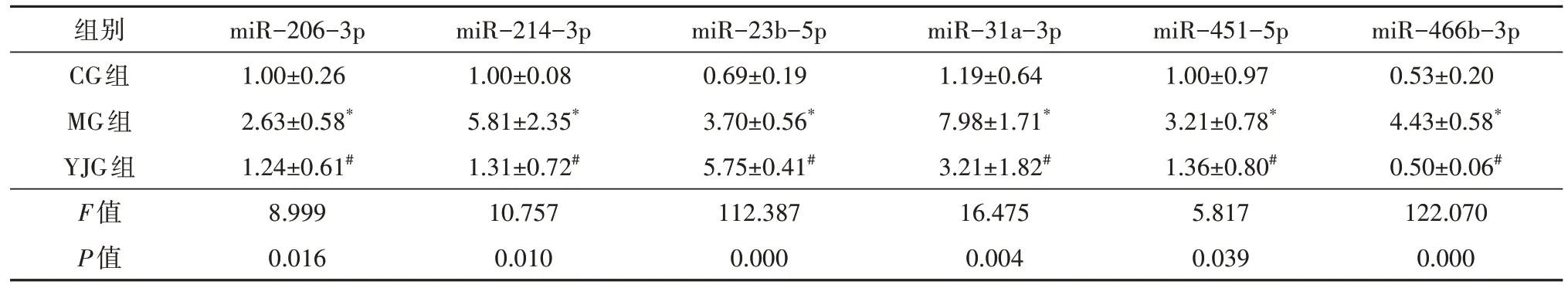
表7 益景汤对DM大鼠视网膜部分miRNA表达的影响(±s,n=3)
注:* 与CG组比较,P<0.05;# 与MG组比较,P<0.05;DM 糖尿病;CG 对照组;MG 模型组;YJG 益景汤组。
组别CG组MG组YJG组F值P值miR-206-3p 1.00±0.26 2.63±0.58*1.24±0.61#8.999 0.016 miR-214-3p 1.00±0.08 5.81±2.35*1.31±0.72#10.757 0.010 miR-23b-5p 0.69±0.19 3.70±0.56*5.75±0.41#112.387 0.000 miR-31a-3p 1.19±0.64 7.98±1.71*3.21±1.82#16.475 0.004 miR-451-5p 1.00±0.97 3.21±0.78*1.36±0.80#5.817 0.039 miR-466b-3p 0.53±0.20 4.43±0.58*0.50±0.06#122.070 0.000
两两比较,MG 组大鼠视网膜miR-673-3p 表达低于CG 组(t=6.708,P=0.001),余11 个miRNA 表达均高于CG 组(tmiR-1-3p=7.162,P=0.000;tmiR-130a-5p=3.804,P=0.009;tmiR-133a-3p=5.573,P=0.001;tmiR-133b-3p=4.910,P=0.003;tmiR-1b=10.818,P=0.000;tmiR-206-3p=3.929,P=0.008;tmiR-214-3p=4.143,P=0.006;tmiR-23b-5p=8.867,P=0.000;tmiR-31a-3p=5.590,P=0.001;tmiR-451-5p=3.175,P=0.019;tmiR-466b-3p=13.476,P=0.000),差异均有统计学意义。YJG 组大鼠视网膜miR-673-3p、miR-23b-5p 表达高于MG 组(tmiR-673-3p=4.164,P=0.006;tmiR-23b-5p=6.036,P=0.001),余10 个miRNA 表达均低于MG 组(tmiR-1-3p=8.607,P=0.000;tmiR-130a-5p=3.569,P=0.012;tmiR-133a-3p=3.545,P=0.012;tmiR-133b-3p=4.288,P=0.005;tmiR-1b=7.285,P=0.001;tmiR-206-3p=3.350,P=0.015;tmiR-214-3p=3.878,P=0.008;tmiR-31a-3p=3.924,P=0.008;tmiR-451-5p=2.667,P=0.037;tmiR-466b-3p=13.586,P=0.000),差异均有统计学意义。除miR-23b-5p 外,其余11 个miRNA 与上述RNA 检测结果一致。
3 讨论
miRNA 在蛋白质调节上具有重要作用,通过与靶基因的mRNA 3'非编码区的相互作用,抑制mRNA 翻译或诱导其降解,从转录水平调节靶基因的表达,从而参与细胞的发育、增殖、分化、死亡以及糖脂代谢等重要进程[13]。研究[14-17]表明,miRNA通过各种不同的机制,参与DR 的发生、发展,在DR的早期诊断和后续治疗中具有潜在价值。
DR早期病理改变早在大鼠DM造模后3个月即可出现[18-20],此阶段视网膜组织中被发现80 种miRNA 表达显著升高,6种表达显著下降;视网膜内皮细胞中有11 种miRNA 表达升高,104 种表达降低[21]。其中miR-21、miR-146、miR-155 和miR-132被揭示与DM 大鼠视网膜内皮细胞中核因子κB(nuclear factor κB,NF-κB)炎症通路相关;miR-17-5p、miR-18a、miR-20a,miR-21、miR-31 和miR-155则被发现和VEGF相关。本研究发现,DM 大鼠成模16 周后,视网膜组织中35 种miRNA 上调,6 种miRNA 下调,其中miR-31、miR-199a、miR-200a、miR-200b、miR-205、miR-223 上调以及miR-20b 下调趋势与上述研究一致。
在增殖性DR 中,miR-200a、miR-200b 表达降低,与细胞的增殖、凋亡和调控VEGF 表达水平相关[17,20-21]。本研究发现,在早期DR 大鼠视网膜组织中miR-200a、miR-200b 表达水平升高,提示DR 早期和中晚期的miRNA 表达情况有所不同,可能与视网膜缺血、缺氧程度及病理改变程度相关。
miR-1 和miR-133 在DM 患者血清水平明显升高,胰岛素样生长因子1(insulin-like growth factor 1,IGF-1)是miR-1 和miR-133 的有效靶点之一,2 种miRNA 负调控其表达,而IGF-1 水平与胰岛素抵抗及糖尿病进展呈负相关[22]。miR-133b 可下调Rho相关蛋白激酶信号通路来抑制视网膜色素上皮细胞增殖,并促进其凋亡[23];miR-23b 在高糖培养的人视网膜血管内皮细胞模型中显著升高,抑制沉默信息调节因子1 转录,使NF-κB 活化增加,促进细胞凋亡,干扰miR-23b 表达后,NF-κB 乙酰化显著降低,细胞凋亡明显减少[24]。本研究亦发现,miR-133b、miR-23b 在DM 大鼠视网膜中明显升高,益景汤干预后其表达降低,提示miR-133b、miR-23b 可能是益景汤保护视网膜血管内皮细胞,干预早期DR 的治疗靶点。前期细胞实验[6]发现,益景汤能减少高糖环境中大鼠视网膜微血管周细胞凋亡、人脑微血管内皮细胞的凋亡[25]对此亦有所提示。
miR-214、miR-451 在缺血状态下的视网膜细胞中显著升高,miR-31 水平下降,眼内注射miR-31能够减少视网膜新生血管形成[26-27]。但KAUR P等[28]的研究表明,miR-31 在DM 患者视网膜细胞中表达水平上调,通过介导VEGF在DR中发挥不良作用;同时miR-31 水平与白细胞滚动速度呈正相关,与促炎因子和黏附分子诱导的白细胞向血管壁聚集有关[29]。CAO Q 等[30]发现,miR-673 靶向抑制非受体型酪氨酸蛋白激酶2(Janus kinase 2,JAK2)表达调节辅助性T 细胞(T helper cell 17,Th17)分化,诱导胎盘生长因子分泌,促进新生血管形成,上调miR-673可抑制新生血管形成。本研究发现,DM大鼠视网膜组织中miR-31a 表达升高,miR-673 表达降低,益景汤干预后miR-31a表达降低,miR-673表达升高,和上述研究结果一致。团队前期临床研究和动物研究[3-4]都发现益景汤能改善DR 患者视网膜微循环,调控VEGF 的水平;缓解DR 大鼠视网膜毛细血管床的减少,改善视网膜血供,减轻视网膜渗漏[7,31-32]。因此,通过调节miR-31a、miR-673 表达,改善视网膜微循环,抑制新生血管形成,可能是益景汤干预早期DR微血管损害的分子机制之一。
综上所述,益景汤干预大鼠早期DR 微血管损害,miR-673、miR-1、miR-133、miR-214、miR-23b、miR-31a、miR-451 等可能是其作用靶点,其机制与缓解视网膜组织缺血,调节视网膜微血管内皮细胞异常增殖和凋亡,抑制视网膜新生血管形成以及抗炎等过程有关,但更深入机制还有待进一步研究。

