基于高通量测序技术探讨益糖康对糖尿病小鼠外周血miRNA表达谱的影响*
刘妍铄,郭隽馥,杨宇峰,石岩
辽宁中医药大学,辽宁 沈阳 110847
糖尿病是一种以慢性高血糖为主要特征的内分泌代谢性疾病[1]。国际糖尿病联盟统计数据显示,2021年全球20~79岁糖尿病患者占总人口数的10.5%,预计2045年这一比例将增至12.2%[2]。糖尿病及其并发症的防治已成为全球医学界面临的重大挑战。石岩教授倡导“脾虚致消”理论,以“健脾益气、养阴清热活血”为治则,在降糖丹的基础上形成中药复方益糖康。大量实验研究表明,益糖康治疗糖尿病的作用机制主要与改善糖脂代谢紊乱[3-4]、改善胰岛素抵抗[5-6]、抑制糖异生[7]、抑制氧化应激[8]、抑制炎症反应[9-10],以及调节胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)分泌[11]等有关。
近年来,miRNA在多种重大疾病发生发展中的重要作用及其作为潜在药物靶点的研究已成为热点。研究显示,miRNA可通过干预胰岛β细胞功能[12-13]、调节胰岛素的合成与分泌[14-15]、调控胰岛素信号传导[16]等途径影响糖代谢,进而直接或间接参与糖尿病的发生与发展。目前,尚无益糖康调控miRNA的研究报道。因此,本研究采用高通量测序技术分析益糖康对糖尿病小鼠外周血miRNA表达谱的影响,预测其潜在靶基因,以期从miRNA的角度探索益糖康防治糖尿病的作用机制,为其临床推广应用提供依据。
1 材料
1.1 实验动物SPF级C57BL/6雄性小鼠15只,6~8周龄,体质量(20±2)g,购自辽宁长生生物技术股份有限公司,质量合格证编号:2107262111-01612071。小鼠饲养于辽宁中医药大学实验中心,温度18~25 ℃,湿度60%~70%,12 h/12 h明暗交替,自由进食和饮水。实验方案经辽宁中医药大学动物实验伦理审查委员会审核批准,伦理审查编号:210000420200073。
1.2 药物与试剂益糖康(中药饮片由辽宁中医药大学附属医院药局提供);RNA提取试剂盒(成都福际生物技术有限公司,货号:RE-0101T);反转录试剂盒、qRT-PCR试剂盒均购自美国Bimake生物科技有限公司。
1.3 仪器全自动生化分析仪(深圳雷杜生命科学有限公司);罗氏活力血糖仪(德国Roche Diagnostics公司);-80 ℃低温冰箱(日本Sanyo公司)。
2 方法
2.1 药物制备益糖康中药饮片浸泡30~60 min,煎煮3次,过滤,去除药渣;将3次水煎液混合,浓缩至生药质量浓度3.22 g·mL-1,冷藏备用。采用pH 4.2的柠檬酸盐缓冲液(0.1 mol·L-1)配制链脲佐菌素(streptozotocin,STZ),质量浓度为3.0 g·L-1,现用现配。
2.2 动物分组、造模及给药适应性饲养4 d后,将15只C57BL/6小鼠随机分为空白组5只、造模组10只,前者给予普通饲料,后者给予高脂饲料;喂养4周后,禁食12 h,造模组小鼠腹腔注射STZ(100 mg·kg-1),空白组小鼠腹腔注射等体积柠檬酸-柠檬酸钠缓冲液;造模组小鼠继续给予高脂饲料喂养7 d,禁食12 h后测定空腹血糖(fasting blood glucose,FBG),高于11.1 mmol·L-1视为糖尿病模型建立成功。将造模成功的小鼠随机分为模型组和益糖康组,每组5只,继续给予高脂饲料。益糖康组小鼠的灌胃剂量为32.2 g·kg-1,空白组和模型组小鼠的灌胃剂量为10 mL·kg-1,连续9周,每日1次。
2.3 外周血样本制备小鼠禁食12 h,1%戊巴比妥钠溶液腹腔注射麻醉,摘除眼球取全血,置于-80 ℃ 冰箱保存。
2.4 FBG测定给药前及第1—9周,末次给药后,取小鼠尾尖血,将其滴于罗氏血糖仪配套血糖试纸上,测定并记录FBG。
2.5 高通量测序技术检测外周血miRNA表达情况模型组和益糖康组分别随机选取3份外周血样本进行miRNA测序和分析。每个样本取1 μg总RNA在3′端和5′端进行接头连接,然后进行逆转录和PCR扩增;构建miRNA文库并进行质量控制检测,确保插入物的平均大小为140~150 bp;以Illumina HiSeq为基础,采用高通量测序技术进行全基因组测序。利用DESeq v1.18.0(Anders和Huber,2010)对不同样本中的miRNA表达量进行比较,以|log2Fold Change|>1,P<0.05为标准筛选差异表达miRNA。
2.6 基因本体(Gene Ontology,GO)、京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析以模型组和益糖康组小鼠mRNA的3′ UTR序列为目标序列,通过miRanda数据库预测差异表达miRNA的靶基因。通过GO数据库(http://geneontology.org/)预测靶基因涉及的细胞组成(cellular component,CC)、分子功能(molecular function,MF)、生物进程(biological proccess,BP),具体方法为:根据每个条目中的靶基因数目,采用超几何分布(P<0.05)的方法,计算靶基因在全基因组中的相对丰度,进而识别靶基因所发挥的重要功能。将靶基因上传至KEGG数据库(http://www.kegg.jp/)进行通路富集分析,结果根据FDR值升序排序。
3 结果
3.1 益糖康对糖尿病小鼠FBG的影响给药前,模型组小鼠FBG>11.1 mmol·L-1,提示糖尿病模型建立成功。给药第1—9周,与空白组比较,模型组小鼠FBG升高(P<0.01);给药第4—9周,与模型组比较,益糖康组小鼠FBG降低(P<0.05,P<0.01),见图1。

注:与空白组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
3.2 益糖康对糖尿病小鼠外周血miRNA表达的影响采用高通量测序技术检测模型组和益糖康组小鼠外周血miRNA表达量,结果显示,与模型组比较,益糖康组小鼠外周血中8个miRNA表达上调,包括miR-434-3p、miR-187-3p、miR-1895等;5个miRNA表达下调,包括miR-150-5p、miR-6912-5p、miR-342-5p等。这些差异表达miRNA的主要功能包括细胞分化、肌肉发育、细胞增殖、凋亡、氧化应激、糖脂代谢、炎症等,见表1、图2。

表1 模型组与益糖康组小鼠差异表达miRNA信息

图2 模型组与益糖康组小鼠外周血差异表达miRNA热图
3.3 GO功能富集分析和KEGG通路富集分析通过miRanda数据库预测13个差异表达miRNA的靶基因,并对靶基因进行GO功能富集分析和KEGG通路富集分析。GO分析结果显示,CC主要涉及细胞、细胞解剖实体、细胞连接与融合、突触、细胞质(膜)的组成成分和内在成分等;MF主要涉及DNA结合转录因子活性、蛋白质结合、酶结合、激酶结合、离子结合、转录调节活性等;BP主要涉及生物调控、细胞过程调控、细胞交流、细胞对刺激的反应等,排名前10位的条目见图3。KEGG分析结果显示,主要通路包括丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路、转化生长因子-β(transforming growth factor-β,TGF-β)信号通路、Ras信号通路、叉头框蛋白O(forkhead box protein O,FoxO)信号通路、受体酪氨酸激酶(receptor tyrosine-protein kinase,ErbB)信号通路、细胞内吞、细胞衰老、细胞分化、胰岛素抵抗、糖尿病并发症中的晚期糖基化终产物及其受体(advanced glycation end product-receptor,AGE-RAGE)信号通路等,排名前20位的通路见图4。

图3 GO功能分析柱状图
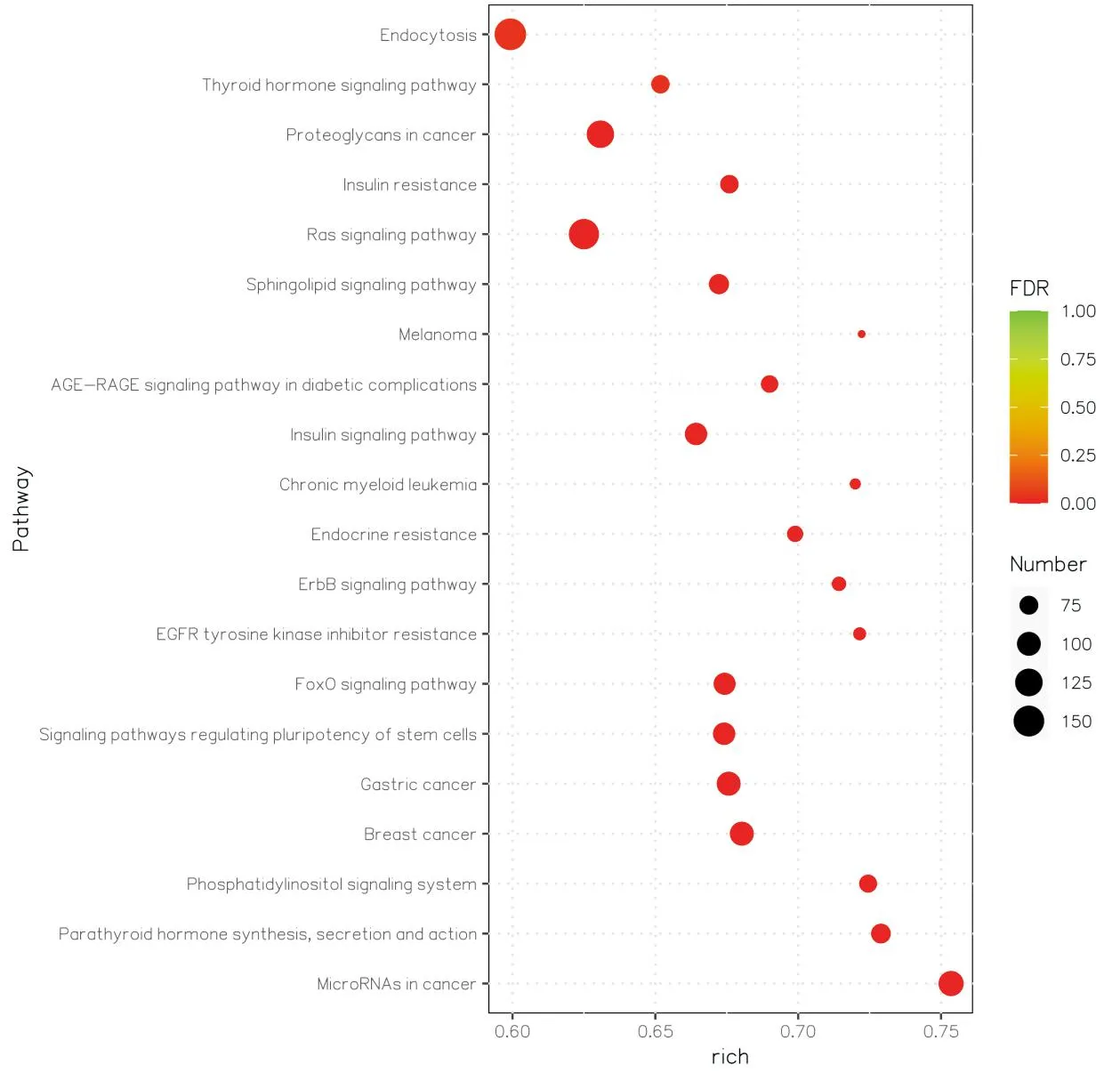
图4 KEGG通路分析气泡图
4 讨论
糖尿病是一种由胰岛素分泌绝对或相对不足,从而导致糖、脂肪、蛋白质等代谢失调为特点的内分泌代谢疾病。中医学将糖尿病归属于“消渴”范畴,其病机以阴虚为本、燥热为标。阴津亏损会导致燥热偏盛,两者互为因果,阴愈虚则燥热愈盛,燥热愈盛则阴更虚。石岩教授经过长期临床实践创制中药复方益糖康,该方由黄芪、白术、黄连、黄精、丹参等14味中药组成[32],具有降糖降脂作用,临床用于防治糖尿病及其并发症疗效显著。
miRNA是一组长21~23个核苷酸,在真核生物中普遍分布的非编码微小RNA[33]。miRNA在生物体内广泛分布,并且在进化上具有很强的保守性。他们参与细胞增殖、细胞凋亡、炎症反应、免疫调节、肿瘤生长及转移等生理病理过程[31]。由于外周血中的 miRNA在较高温度下具有较强的耐受性,因而被认为是潜在的疾病早期诊断标志物[34]。miRNA在血液中分布广泛,由于其稳定性及可选择性释放,已被证实与多种疾病的发生发展密切相关。因此,分析外周血miRNA,研究其靶向分子和相关信号传导途径有利于糖尿病等代谢性疾病的精准靶向防治。
本研究通过miRNA-Seq技术发现13个可能介导益糖康发挥作用的miRNA,主要是益糖康干预后表达上调的miR-434-3p、miR-382-3p等8个miRNA以及表达下调的miR-342-5p、miR-150-5p等5个miRNA。文献报道显示,过表达miR-434-3p通过靶向GATA结合蛋白4(GATA binding protein-4,GATA-4)促进成骨细胞分化[17]。王立侠等[27]研究发现,过表达miR-150-5p可促进细胞存活,抑制乳酸脱氢酶(lactate dehydrogenase,LDH)释放和细胞凋亡,从而减轻氧-糖剥夺(oxygen glucose deprivation,OGD)诱导的大脑皮质神经细胞损伤。此外,α-硫辛酸辅助奥美沙坦酯治疗糖尿病肾病(diabetic nephropathy,DN)的机制可能与降低血清miR-150-5p、miR-155-5p表达水平,进而改善患者血糖水平、减轻氧化应激反应有关[28]。2型糖尿病患者血清miR-342-5p水平可反映其脂质代谢异常程度[29]。百日咳杆菌引起的炎症反应可使血清miR-342-5p表达显著上升,这表明miR-342-5p可能参与炎症的发生发展过程[31]。由此说明,益糖康调控miRNA可能与糖脂代谢、炎症反应、细胞分化及细胞损伤等作用密切相关,但其潜在机制尚需进一步研究。
既往研究表明,众多信号传导途径与糖尿病的发生发展相关。磷酸酯酶D (phospholipase D,PLD)是一种重要的细胞内受体,参与调控Ⅰ型肌纤维中由胰岛素刺激或肌肉收缩触发的肌细胞葡萄糖跨膜转运的信号传导系统[35]。糖肾平胶囊能够调节DN肾组织中TGF-β1/p38 MAPK信号,降低包括足细胞在内的肾内在细胞凋亡,减轻肾脏病变,从而发挥肾脏保护作用并延缓病程进展[36]。MAPK信号通路参与高糖诱导的糖尿病多脏器病变的发生与发展,但其具体作用机制尚不明确。KEGG通路富集结果显示,差异表达miRNA的靶基因可能在PLD、MAPK、TGF-β、Ras、FoxO、ErbB、胰岛素抵抗、AGE-RAGE等信号通路中呈现高表达,推测益糖康可能通过调控上述通路治疗糖尿病。
综上所述,益糖康治疗小鼠糖尿病的机制可能与调节外周血miRNA表达,影响细胞凋亡、炎症反应、氧化应激、糖脂代谢等功能,调控FoxO信号通路、胰岛素抵抗等通路有关。本研究为中医药防治糖尿病及其并发症的病理、药理机制研究提供新的思路和方向。

