基于网络药理学和细胞实验探讨陈皮-紫苏子药对治疗慢性阻塞性肺疾病的作用机制*
王艳梅,董浩然
1.河南中医药大学第二附属医院/河南省中医院,河南 郑州 450002; 2.河南中医药大学,河南 郑州 450046
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)具有高发病率和高病死率,已经成为全球公共卫生的重大挑战[1-2]。COPD的主要症状包括咳嗽、咳痰、喘息和胸闷等,归属于“肺胀”“喘证”“咳嗽”等范畴。中医学认为,COPD的病因为痰热壅肺,浊痰内蕴于肺,肺气阻滞导致血瘀;病机为外邪袭肺,导致肺气不宣、升降失司,因而喘咳不止。COPD稳定期以本虚为主,治疗应固本培元、调理肺气、宣肺化痰[3]。中医药在治疗COPD方面具有显著优势,副作用少,远期疗效较好。
陈皮(CitrusReticulata)-紫苏子(PerillaeFructus)是临床治疗COPD的常用药对,陈皮味辛、苦,性温,归脾、肺经,具有燥湿化痰、理气宣肺的功效;紫苏子味辛,性温,归肺、大肠经,能够降气疏壅、祛痰止咳[4]。陈皮与紫苏子联用,一升一降,调节肺之宣发与肃降,治节得伸而诸气皆顺,邪有路出,疾病得以缓解。目前,陈皮、紫苏子配伍治疗COPD的作用机制尚未明确,因此本研究采用网络药理学和分子对接探讨陈皮-紫苏子药对治疗COPD的作用机制,并通过细胞实验进行验证,以评估相关活性成分的药理作用。
1 材料
1.1 细胞THP-1细胞购自中国科学院上海生命科学院研究院细胞资源中心,编号:SCSP-567。
1.2 药物与试剂柚皮素、川陈皮素(批号:MUST-18050808、MUST-16070901)购自成都曼思特生物科技有限公司;木犀草素、花生四烯酸、β-谷甾醇(批号:C29N10Q104574、Q16M11Q111761、R21O8F6338)购自上海源叶生物科技有限公司;白细胞介素-6(interleukin-6,IL-6)ELISA试剂盒(BD公司,货号:9249866);肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)ELISA试剂盒(R&D Systems,货号:P302933);脂多糖(lipopolysaccharide,LPS)(Sigma,货号:039M4004V);乙酸佛波酯(phorbol myristate acetate,PMA)(MCE,货号:HY-1873)。
1.3 仪器Synergy HTX型全波长酶标仪(美国BIO-TEK公司);SQP型电子天平(德国Sartorius公司);3131型CO2培养箱(美国Thermo公司);iCytal型细胞计数仪(中国卓微公司);1300 A2型生物安全柜(美国Thermo公司);Primo Vert型倒置生物显微镜(德国ZEISS公司)。
2 方法
2.1 网络药理学研究
2.1.1 陈皮-紫苏子活性成分与作用靶点筛选通过中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)(http://tcmspw.com/tcmsp.php)检索陈皮、紫苏子的化学成分与作用靶点,以口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug likeness,DL)≥0.18为标准进行筛选,并结合文献报道加以补充。借助Uniprot(https://www.uniprot.org)、GeneCards(https://www.genecards.org/)、OMIM(https://omim.org)数据库获取作用靶点的规范基因名称。
2.1.2 陈皮-紫苏子核心成分筛选利用Cytoscape 3.7.2软件构建“药物-活性成分-作用靶点”网络,筛选度值(Degree)排名前5位的化合物,将其作为陈皮-紫苏子药对的核心成分。
2.1.3 COPD相关靶点预测及交集靶点获取以“Chronic Obstructive Pulmonary Disease”为关键词,通过GeneCards数据库检索COPD相关靶点,并筛选Relevance score≥40的靶点。通过微生信平台(https://www.bioinformatics.com.cn/)绘制陈皮-紫苏子作用靶点与COPD相关靶点的韦恩图,得到交集靶点。
2.1.4 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络构建及核心靶点筛选将药物与COPD的交集靶点上传至STRING数据库(https://www.string-db.org/),物种设置为“Homo sapiens”,置信度为0.7,构建PPI网络,筛选大于平均度值的靶点作为陈皮-紫苏子药对治疗COPD的核心靶点。
2.1.5 基因本体(Gene Ontology,GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析基于药物与COPD的交集靶点,通过Metascape数据库进行GO分析(P<0.05)和KEGG分析(P<0.05)。富集结果根据P值进行升序排序,并利用微生信在线平台绘制高级气泡图。
2.1.6 核心成分-核心靶点分子对接从RCSB PDB数据库(https://www.rcsb.org/)下载核心靶点的PDB结构,将其作为受体;通过TCMSP数据库和PumChem数据库获取核心成分的3D结构,将其作为配体;利用Autodock软件进行分子对接,使用Discovery Studio软件构建分子对接模拟图。
2.2 细胞实验
2.2.1 药物制备使用万分之一天平分别称取木犀草素2 mg、β-谷甾醇5 mg、柚皮素5 mg、川陈皮素4 mg、花生四烯酸4 mg,使用二甲基亚砜(DMSO)配制成质量浓度为40 g·L-1木犀草素、50 g·L-1β-谷甾醇、50 g·L-1柚皮素、40 g·L-1川陈皮素、40 g·L-1花生四烯酸储备液备用,正式实验时稀释成相应浓度。
2.2.2 分组、造模及给药THP-1细胞采用含10%胎牛血清的RPMI 1640完全培养基,在37 ℃、5%CO2培养箱中培养。将THP-1细胞接种于24孔板,调整细胞浓度至2×105mL-1,PMA(20 μg·L-1)诱导12 h,分为空白组、模型组、木犀草素组、β-谷甾醇组、柚皮素组、川陈皮素组。除空白组外,其余各组加入LPS(2 mg·L-1)建立细胞炎症模型;在此基础上,木犀草素组加入不同浓度木犀草素(0.25 mg·L-1、0.5 mg·L-1、1 mg·L-1、2 mg·L-1),β-谷甾醇组加入不同浓度β-谷甾醇(1.56 mg·L-1、3.13 mg·L-1、6.25 mg·L-1、12.5 mg·L-1),柚皮素组加入不同浓度柚皮素(3.13 mg·L-1、6.25 mg·L-1、12.5 mg·L-1、25 mg·L-1),川陈皮素组加入不同浓度川陈皮素(2 mg·L-1、4 mg·L-1、8 mg·L-1、16 mg·L-1),花生四烯酸组加入不同浓度花生四烯酸(1 mg·L-1、2 mg·L-1、4 mg·L-1、8 mg·L-1),各组细胞培养24 h。
2.2.3 ELISA检测细胞IL-6和TNF-α含量收集细胞上清液,1 000 r·min-1离心5 min,取上清。按照ELISA试剂盒说明书进行操作,检测各组细胞炎症因子IL-6、TNF-α含量。
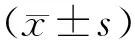
3 结果
3.1 网络药理学研究结果
3.1.1 陈皮-紫苏子活性成分与作用靶点通过 TCMSP 数据库筛选陈皮、紫苏子的活性成分和作用靶点,结果显示,陈皮活性成分5个(谷甾醇、柚皮素、川陈皮素等),作用靶点91个;紫苏子活性成分14个(豆甾醇、花生四烯酸、木犀草素等),作用靶点223个,见表1。
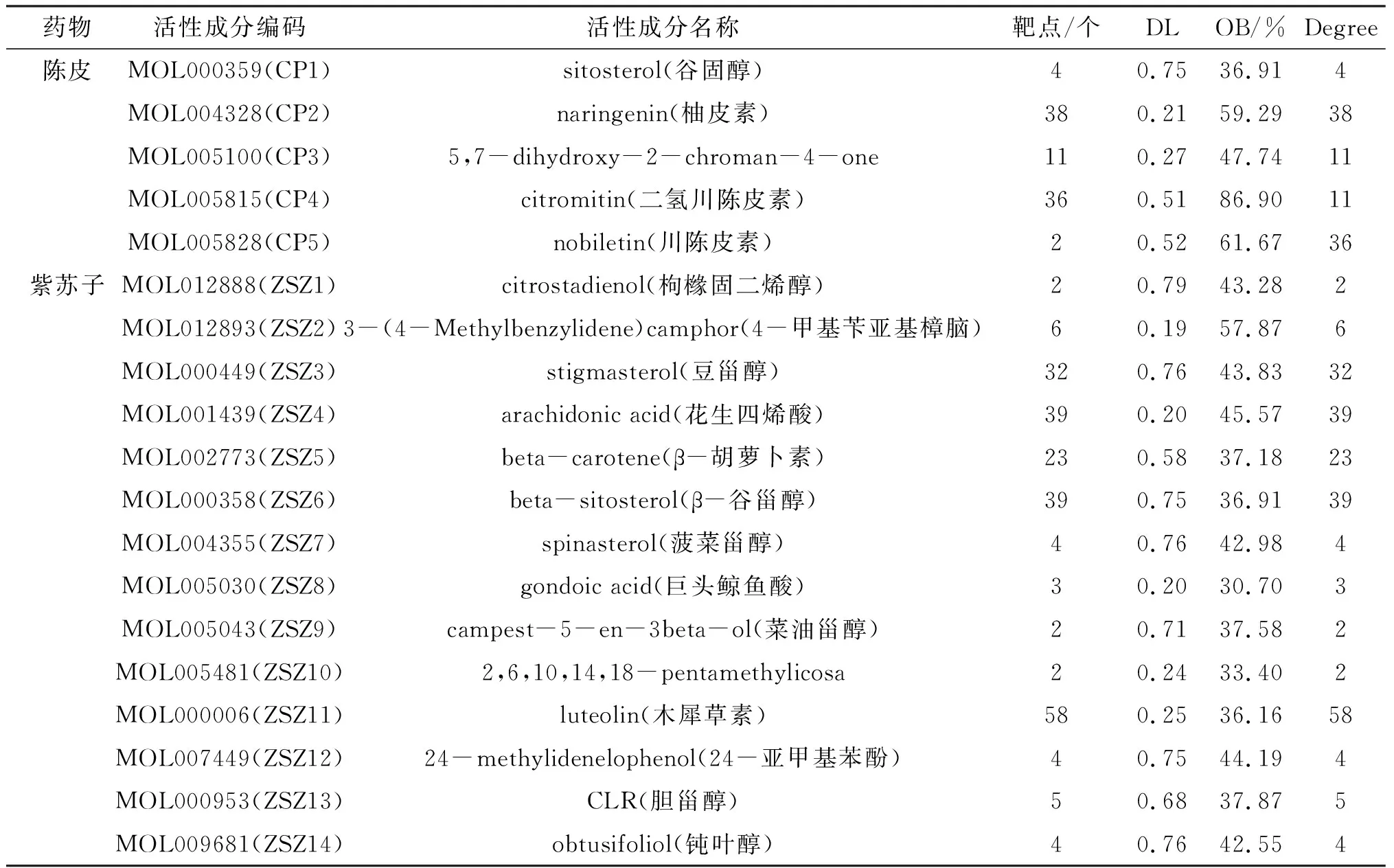
表1 “陈皮-紫苏子”活性成分与作用靶点信息
3.1.2 “药物-活性成分-作用靶点”网络及核心成分基于陈皮-紫苏子药对的19个活性成分及其作用靶点,利用Cytoscape 3.7.2软件构建“药物-活性成分-作用靶点”网络,见图1。拓扑分析显示,Degree值排名前5位的化合物分别是紫苏子中的木犀草素、β-谷甾醇、花生四烯酸,陈皮中的柚皮素、川陈皮素,他们可能是陈皮-紫苏子药对的核心成分。

注:CP:陈皮;ZSZ:紫苏子。
3.1.3 COPD相关靶点及陈皮-紫苏子抗COPD潜在靶点通过GeneCards数据库检索到288个COPD相关靶点;利用微生信平台绘制韦恩图,得到34个交集靶点,将其作为陈皮-紫苏子药对干预COPD的潜在靶点,见图2A。

注:A:交集靶点韦恩图;B:交集靶点PPI网络图。
3.1.4 PPI网络及陈皮-紫苏子抗COPD核心靶点针对34个潜在靶点构建PPI网络,该网络包括34个节点、208条边。根据平均度值筛选得到16个核心靶点,包括IL-6、TNF、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)、表皮生长因子受体(epidermal growth factor receptor,EGFR)等,见图2B。
3.1.5 KEGG通路分析和GO功能分析KEGG富集分析得到13条通路(P<0.05),主要包括白细胞介素-17(interleukin-17,IL-17)信号通路、细胞因子受体互作通路、低氧诱导因子-1(hypoxia inducible factor-1,HIF-1)信号通路、AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)信号通路、内吞与铁死亡等,见图3A。GO富集分析得到3550个生物过程(biological process,BP)、385个分子功能(molecular function,MF)、264个细胞组成(cellular component,CC)。其中,BP主要涉及蛋白质磷酸化调控、平滑肌细胞增殖的调节、凋亡信号通路、激酶活性的调节、组织重塑、白细胞分化等;MF主要涉及细胞因子活性、磷酸酶结合、蛋白酶结合、激酶调节活性、ATP酶结合等;CC主要涉及膜筏、细胞外基质、内吞囊泡、细胞膜、细胞连接、IL-6受体复合物、TNF受体超家族复合体、PML小体等,其中一些功能已被证明与COPD的发生发展相关[5-8],见图3B—3D。

注:A:KEGG通路图;B:BP分析图;C:CC分析图;D:MF分析图。
3.1.6 分子对接一般认为,分子对接结合能小于-4.25 kcal·mol-1表示有亲和力,小于 -5.0 kcal·mol-1表示结合活性较好,小于 -7.0 kcal·mol-1表示结合活性较强,且结合能越低代表配体与受体的结合能力越强[9]。将核心成分(木犀草素、β-谷甾醇、花生四烯酸、柚皮素、川陈皮素)与核心靶点(IL-6、TNF)进行分子对接,结果显示,结合能均小于-4.25 kcal·mol-1,见图4、表2。
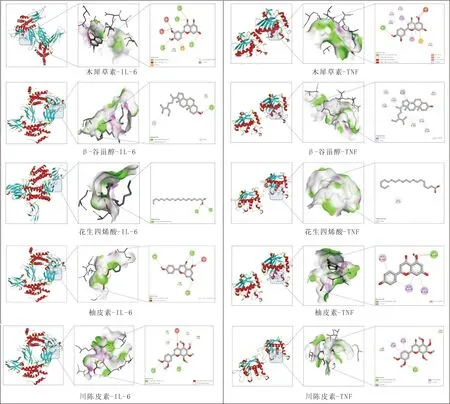
图4 核心成分-核心靶点分子对接模拟图

表2 分子对接结果
3.2 细胞实验结果与正常组比较,模型组IL-6、TNF-α含量升高(P<0.01);与模型组比较,各浓度柚皮素组IL-6、TNF-α含量均降低(P<0.01,P<0.05),见图5A、5F;与模型组比较,各浓度川陈皮素组IL-6、TNF-α含量均降低(P<0.01,P<0.05),见图5B、5G;与模型组比较,各浓度β-谷甾醇组IL-6、TNF-α含量均降低(P<0.01,P<0.05),见图5C、5H;与模型组比较,各浓度木犀草素组IL-6、TNF-α含量均降低(P<0.01,P<0.05),见图5D、5I;与模型组比较,各浓度花生四烯酸组IL-6、TNF-α含量均降低(P<0.01,P<0.05),见图5E、5J。

注:A-E:各组细胞IL-6含量;F-J:各组细胞TNF-α含量。与模型组比较,*P<0.05,**P<0.01。
4 讨论
COPD通常由长期暴露于有害颗粒或气体,引起气道和(或)肺泡异常[10],导致肺部慢性炎症,进而出现持续气流受限、咳喘、咳痰等呼吸系统症状,炎症消退是病情治愈的关键。COPD患者气道上皮受损,产生多种炎症介质和细胞因子,引发气道炎症反应,临床上以咳嗽、咳痰最为常见[11]。中医学认为,“肺为贮痰之器”,痰浊最易内停于肺,影响肺的宣发、肃降功能。COPD的病变主要在肺,以气虚衰弱为本、寒饮内停为标。患者多因年老体衰,长期气血亏虚、肺气郁滞,加上外邪入侵,入里化热,痰热壅肺导致肺气宣降不利[12]。因此,治疗应以宣肺通气为主,通过祛邪宣肺、降气化痰、活血化瘀等方法,消除痰壅气逆,缓解咳嗽、气喘等症状。
陈皮-紫苏子是治疗COPD的常用药对,经典方剂苏子降气汤[13-14]、华盖散[15-16]中均有两药配伍应用。陈皮、紫苏子均具有理气化痰、止咳平喘的功效;紫苏子性润,擅长理气化痰、温中降逆;陈皮性燥,擅长理气化痰、理气和胃;二者合用,燥润相得,既不伤阴,又能润燥化痰。本研究通过网络药理学分析陈皮-紫苏子药对治疗COPD的作用机制,筛选出5个核心成分,即木犀草素、β-谷甾醇、花生四烯酸、柚皮素和川陈皮素。木犀草素具有祛痰、止咳、消炎等作用,能改善COPD患者肺功能,降低血清IL-6含量[17];同时,其可抑制急性肺损伤小鼠细胞焦亡,减轻肺损伤[18],并缓解新生败血症小鼠肺损伤[19]。β-谷甾醇通过抑制Ⅱ型免疫反应和胶原蛋白沉积从而改善气道炎症和气道重塑[20],通过抑制白细胞介素-8(interleukin-8,IL-8)表达改善小鼠肺部炎症反应[21],同时能够减轻哮喘小鼠的肺部炎症[22]。柚皮素可通过抑制炎症反应和氧化应激反应从而保护心肌细胞免受损伤[23],并能通过调控巨噬细胞NLRP3炎症小体活化改善急性肺损伤[24]。川陈皮素可抑制核因子-κB(nuclear factor-κB,NF-κB)信号通路从而改善小鼠急性肺损伤炎症反应[25]。
通过PPI网络挖掘出16个陈皮-紫苏子药对治疗COPD的核心靶点,其中多个靶点与炎症反应相关,如IL-6、TNF、白细胞介素-10(interleukin-10,IL-10)等。研究表明,气道炎症因子与细胞相互作用可促进COPD的发生与发展,并可诱发COPD急性加重[26-28]。Vitenberga等[29]发现,COPD患者支气管组织中IL-6、TNF-α表达水平升高。Kleniewska等[30]研究表明,在COPD患者的急性加重期,痰和血清中IL-6、TNF-α浓度升高。IL-6能够诱导急性反应,快速产生IL-6有助于增强机体在感染或组织损伤期间的防御能力[31]。IL-6是预测COPD急性加重的有效指标,对于COPD的诊断和治疗具有重要意义[32]。TNF-α与肺部炎症密切相关,血清TNF-α水平与COPD患者的病情缓解程度呈负相关[33]。
陈皮-紫苏子药对治疗COPD主要作用于 HIF-1信号通路、IL-17信号通路、AMPK信号通路、内吞作用及铁死亡等通路。已有研究证实,这些通路与COPD的发生、发展密切相关。HIF-1高表达可能与肺功能下降和生活质量下降有关[34]。HIF-1信号通路激活可能参与COPD的病理生理过程,稳定HIF-1表达有助于减轻组织炎症,降低血清HIF-1浓度可延缓COPD病情进展[35]。IL-17 细胞因子家族包括多个成员,如IL-17A、IL-17C,能够介导COPD的炎症反应,造成肺部炎症和组织损伤[36]。AMPK是COPD的潜在治疗靶点,能够减少异常炎症反应和细胞衰老[37]。在COPD的病情发展中,巨噬细胞的吞噬功能缺陷可导致未能清除的细胞发生继发性坏死,从而激发气道炎症[38]。铁死亡是一种铁依赖性的脂质过氧化反应所诱导的细胞死亡方式,铁稳态破坏与COPD的发病机制密切相关[39]。
综上所述,本研究采用网络药理学方法探讨陈皮-紫苏子药对干预COPD的潜在机制。通过分子对接技术评估药物活性成分与核心靶点的亲和力,并结合体外细胞实验验证这些活性成分的抗炎作用。陈皮-紫苏子药对可通过多成分、多靶点、多途径发挥治疗COPD的作用,其机制可能与抑制炎症反应有关。

