牛IFN-γ真核表达系统的构建及单克隆抗体的制备与鉴定
许 芳,蔡 杰,薛华平,罗 均,蒋永青*,郭霄峰*
(1.华南农业大学兽医学院,广东广州 510642;2.深圳市绿诗源生物技术有限公司,广东深圳 518120)
牛结核病(Bovine tuberculosis,bTB)是由结核分支杆菌复合群(Mycobacterialtuberculosiscomplex,MTBC)引起的一种慢性消耗性人兽共患传染病,其主要病原是牛分支杆菌(Mycobacteriumbovis)和结核分支杆菌(Mycobacteriumtuberculosis)[1]。该病是当今世界养牛业面临的最复杂的动物健康问题之一,也威胁着食品安全。
牛结核病是世界动物卫生组织(WOAH)规定必须通报的疾病之一,我国列为二类动物疫病。发达国家每年M.bovis导致人结核病比例为1%左右,发展中国家或贫困地区由M.bovis导致人结核病比例为5%~28%[2-3]。快速有效地诊断是控制bTB的关键。现有的诊断方法有结核菌素皮内变态反应(tuberculin skin test,TST)、牛γ干扰素(gamma interferon,IFN-γ)体外释放试验和血清抗体检测方法等。bTB感染导致机体产生免疫,主要包括细胞免疫和体液免疫。感染早期以细胞免疫为主,感染中、后期机体转为以体液免疫为主[4-6]。因此,血清学抗体检测在感染中、后期的bTB诊断中发挥着重要作用。而TST和IFN-γ体外释放试验在该病感染早期的诊断中发挥着重要作用,更有利于控制和切断bTB的传播。TST为皮内注射牛提纯结核菌素(purified protein derivative ofM.bovis,bPPD),bPPD源自M.bovis培养物的提取物,与环境分支杆菌有交叉抗原,极易出现非特异性结果,导致检测假阳性。牛IFN-γ体外释放试验,是国际公认的bTB确诊标准[7],为TST的理想补充试验[8-9]。随着bTB发展,需要不断对这些方法进行改善[10]。文献中大多使用原核表达系统获得牛IFN-γ[11-13],该方法获得的牛IFN-γ与天然牛IFN-γ构象上仍存在一定差别,而利用真核表达系统则可以获得与天然构象更为相似的IFN-γ。真核表达系统使用较多的有酵母表达系统、哺乳动物表达系统和昆虫细胞表达系统,具有对转录后的加工系统、翻译后的修饰系统以及可实现真正的分泌表达等优势,克服了原核表达系统中没有转录后剪切、加工系统以及不能进行有效的糖基化、磷酸化、甲基化等缺陷[14]。本研究通过构建真核表达系统表达出与天然IFN-γ更为相似的牛IFN-γ重组蛋白,制备出牛IFN-γ单克隆抗体,为后续开发bTB IFN-γ体外释放酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测试剂盒奠定基础。
1 材料与方法
1.1 材料
1.1.1 载体、细胞系、实验动物和样本 pFastBacl载体和骨髓瘤细胞(S/P20)由华南农业大学兽医微生物实验室保存;Balb/c雌性小鼠购自珠海百试通生物科技有限公司。样本为无菌采集的牛全血,经商品化牛结核病γ干扰素ELISA检测试剂盒中牛结核菌素(bPPD)、禽结核菌素(aPPD)和PBS分别刺激培养,刺激后的培养物取上清,并使用该试剂盒检测确定为阳性样本。本试验使用bPPD和PBS的刺激上清分别作为双抗夹心ELISA效果验证的阳性样本和阴性样本。
1.1.2 主要试剂 限制性内切酶、T4连接酶,美国NEB公司产品;质粒小量提取试剂盒,美国Omega Bio-Tek公司产品;DNA Marker、胶回收试剂盒,日本宝生物工程(大连)有限公司;DH5α感受态细胞,中国北京全式金生物技术股份有限公司产品;DH10Bac感受态细胞,中国上海唯地生物技术有限公司产品;LipoInsectTM转染试剂、杆状病毒穿梭载体Bacmid小量抽提试剂盒、Protein G亲和层析柱、BCA蛋白浓度测定试剂盒(增强型),中国上海碧云天生物技术有限公司产品;SFM培养液,中国上海倍进生物技术有限公司产品;BCA蛋白定量试剂盒,中国江苏康为世纪生物科技股份有限公司产品;蛋白Marker、Ni-NTA His·Bind®树脂、50×HAT(A:氨基蝶呤)、50×HT(H:次黄嘌呤和T:胸腺嘧啶核苷)、弗氏完全和弗氏不完全佐剂、融合剂PEG (P7181)、辣根过氧化物酶(HRP)、鼠类单克隆抗体亚类鉴定试剂盒,德国Merck公司产品;RPMI 1640培养基、胎牛血清FBS,美国Thermo Fisher Scientific公司产品;青、链霉素,中国华北制药股份有限公司产品;TMB底物液,美国Seracare公司产品;rProtein G Beads 4FF亲和层析柱,中国天地人和生物科技有限公司产品;商品化牛结核病γ干扰素ELISA检测试剂盒,中国武汉科前生物股份有限公司产品。
1.1.3 主要仪器 振荡培养箱,中国上海一恒科学仪器有限公司产品;酶标仪,美国Thermo Fisher Scientific公司产品;二氧化碳培养箱,中国益世科(上海)企业发展有限公司产品;高速冷冻离心机,美国Beckman Coulter公司产品;显微镜,日本Olympus公司产品。
1.2 方法
1.2.1 IFN-γ基因序列合成 分别将限制性内切酶(BamH Ⅰ)、信号肽、牛IFN-γ序列(FJ263670.1)、TEV识别位点、His标签和限制性内切酶(EcoR Ⅰ)基因序列合成到PUC57克隆载体上。基因序列由中国生工生物工程(上海)股份有限公司合成。
1.2.2 引物设计 根据GenBank中牛IFN-γ序列(FJ263670.1),在上、下游引入BamHⅠ和EcoRⅠ限制性酶切位点,设计检测引物IFN-γ-F和IFN-γ-R;同时依据pFastBacl载体序列,设计检测重组杆状病毒的通用引物M13-F和M13-R(表1)。引物由生工生物工程(上海)股份有限公司合成。

表1 IFN-γ基因引物和M13通用引物序列
1.2.3 重组表达质粒的构建与鉴定 复苏PUC57克隆载体,过夜扩大培养后提取质粒,用BamHⅠ、EcoRⅠ在37℃的水浴锅中进行双酶切鉴定。对IFN-γ片段进行胶回收,经BamHⅠ、EcoRⅠ双酶切后,克隆至表达载体pFastBac1上,转化至DH5α感受态细胞后,涂布菌液到含有氨苄抗生素的平板上,过夜培养,平板上挑取单菌落进行PCR鉴定,过夜培养,提取质粒,进行双酶切鉴定,将鉴定正确的质粒命名为pFastBac1-IFN-γ。
1.2.4 重组杆粒的构建与鉴定 将双酶切鉴定成功的阳性质粒转化至DH10Bac感受态细胞后,涂布到含有3种抗生素即卡那霉素、庆大霉素、四环素,以及两种显色物质即X-Gal和IPTG的平板中,倒置培养,经过3轮蓝白斑筛选,选择单个白色的菌落扩大培养后,使用杆状病毒穿梭载体Bacmid小量抽提试剂盒提取杆粒DNA,以IFN-γ和M13的上、下游引物进行PCR鉴定,将鉴定正确的重组杆粒命名为Bacmid-IFN-γ。
1.2.5 重组杆粒的转染 将Sf9昆虫细胞调整至对数生长期进行细胞计数,每孔8×105个细胞铺于6孔细胞板中,室温下静置10 min;向100 μL不含血清的昆虫培养基中加入8 μL转染试剂,短暂涡旋混匀后,室温静置30 min;向100 μL不含血清的昆虫培养基中加入3 μg重组杆粒,轻轻吹打混匀;将上述两种溶液混匀,室温静置30 min,加入到6孔板中,即为转染孔,同时做空白细胞对照;27℃培养5 h后弃去6孔板中液体,加入含10% FBS的昆虫培养基;27℃培养96~120 h。
1.2.6 杆状病毒的接毒与传代 培养96~120 h后,在显微镜下观察细胞病变,从每孔中收集1 mL含有病毒的上清液,转入无菌EP管中,10 000 r/min离心2 min,除去细胞和大碎片,将上清转移至EP管中,记作P1代重组杆状病毒,继续将P1代毒接种到100 mL细胞密度约2×106个/mL的Sf9细胞中培养,27℃、100~120 r/min振荡培养,观察细胞病变,96~120 h收取P2代杆状病毒。对收集的P2代病毒液提取DNA并进行PCR鉴定及测序。
1.2.7 IFN-γ蛋白的大量表达、纯化与鉴定 取P2代杆状病毒50 mL,接于1 L细胞密度为2×106个/mL的Sf9细胞中培养,培养96~120 h收取病毒液用于目的蛋白的检测和纯化。细胞培养液8 000 r/min离心30 min后,收集上清,使用Beckman高速冷冻离心机,SW37Ti转头进行超速离心,30 000 r/min离心2 h后弃去上清,每管用200 μL的TEN溶解沉淀,过夜溶解后收集上清,用Ni-NTA His·Bind®树脂进行蛋白纯化。经SDS-PAGE电泳,分析目的条带的表达量。使用商品化的牛结核病γ-干扰素ELISA检测试剂盒中兔抗牛γ干扰素多抗进行Western blot鉴定,判断该蛋白的反应原性。将纯化的IFN-γ蛋白稀释至10、5、2.5、1、0.5、0.25、0.1 μg/mL,使用商品化牛结核病γ干扰素ELISA检测试剂盒检测,操作步骤按该试剂盒说明书进行,进一步判断该蛋白的反应原性。
1.2.8 单克隆抗体的制备
1.2.8.1 小鼠免疫与细胞融合 按照常规方法进行Balb/c小鼠免疫[15]。用纯化IFN-γ蛋白免疫小鼠,50 μg/只,三免后14 d,尾静脉采血测定血清效价。融合前3 d加强免疫,取免疫小鼠脾细胞和SP2/0细胞按照常规方法进行细胞融合。
1.2.8.2 筛选方法的建立 间接ELISA法测定效价。用包被液将纯化的IFN-γ蛋白稀释至50 ng/mL,加入96板孔中,100 μL/孔,置2~8℃放置15 h;弃去包被液,拍干,用洗涤液洗板1次,300 μL/孔;弃去洗涤液,拍干,加入5%脱脂奶粉封闭板孔,200 μL/孔,置37℃温育60 min;弃去封闭液后拍干,加入使用磷酸盐缓冲液(PBS,0.01mol/L,pH 7.4)倍比稀释的杂交瘤细胞培养上清、小鼠腹水,100 μL/孔,置37℃温育60 min,洗涤3次;加入1∶5 000稀释的羊抗鼠IgG-HRP酶标二抗,100 μL/孔,置37℃温育30 min;洗涤3次,加入底物显色液,100 μL/孔,20~25℃避光显色10 min;加入终止液,50 μL/孔;测定OD450nm值,分别设SP2/0细胞培养上清、腹水作为阴性对照,当OD450nm值大于阴性对照OD450nm值2倍时对应的最大稀释度作为单克隆抗体的效价。
1.2.8.3 阳性杂交瘤细胞株的筛选与克隆 采用建立的间接ELISA法对杂交瘤细胞上清进行筛选。阳性孔再经过3次有限稀释法进行亚克隆,待阳性率达到100%时扩大培养,收集上清并冻存细胞,用于制备腹水。
1.2.8.4 小鼠腹水的制备 采用体内诱生法制备单克隆抗体腹水。
1.2.9 单克隆抗体的鉴定
1.2.9.1 亚类鉴定 按照商品化的单抗亚型鉴定试剂盒说明书进行亚类鉴定。
1.2.9.2 单克隆抗体腹水的效价测定 将杂交瘤细胞株腹水以1∶100、1∶200等倍比稀释(100×2n-1),以SP2/0腹水作为阴性对照,用纯化的IFN-γ蛋白包被的间接ELISA检测其效价,当(阳性样本OD450nm值/阴性对照OD450nm值)≥2时,对应的最大稀释度作为单克隆抗体效价。
1.2.10 单克隆抗体的纯化和标记 按照rProtein G Beads 4FF亲和层析柱说明书进行单克隆抗体纯化、使用商品化的BCA蛋白浓度测定试剂盒检测单克隆抗体的浓度。使用HRP标记单克隆抗体,具体操作如下:称取5 mg HRP溶于1 mL双蒸水中,加入500 μL新鲜配制的碘酸钠溶液,2~8℃反应30 min,溶液呈草绿色,再加入0.5 mL乙二醇(0.16 mol/L),混匀后室温避光反应30 min。然后加入5 mg纯化后的单克隆抗体,在pH 9.5的碳酸盐缓冲液中2~8℃透析15 h。次日,在溶液中加入新鲜配制的NaBH40.2 mL,混匀后2~8℃反应2 h,再加入等体积的饱和硫酸铵溶液,2~8℃静置30 min,7 000 r/min离心10 min,弃上清,用PB缓冲液重悬,在PB缓冲液2~8℃透析15 h,收集透析袋内容物。
1.2.11 单克隆抗体的表位分析 通过相加ELISA试验鉴定筛选到的不同单抗是否针对同一抗原表位。以0.25 μg/mL重组IFN-γ包被酶标板,先以其中一种饱和浓度的单抗37℃作用1 h,洗涤后再与另一种饱和浓度的单抗于37℃作用1 h,洗涤后加入HRP-羊抗鼠IgG 37℃温育1 h,洗涤后加入TMB底物显色,测定OD450nm值并记录为A1+2。按照以下公式分别计算两种单克隆抗体叠加后的AI值,AI=(A1+2-A1)/A2×100%;其中A1+2表示2株单抗叠加后的OD450nm值;A1表示第1株单抗的OD450nm值;A2表示第2株单抗的OD450nm值。当两两叠加后的AI值大于10%时,表明这两株抗体所识别的抗原位点不同;当两两叠加后的AI值小于或等于10%时,表明这两株抗体所识别的抗原位点相近或相同[16-17]。
1.2.12 单克隆抗体与重组IFN-γ蛋白的反应原性鉴定 重组IFN-γ蛋白纯化后进行SDS-PAGE电泳,转至PVDF膜上,TBST洗涤3次后用5%脱脂奶粉封闭4℃过夜,再次洗涤,选择不同株单克隆抗体作一抗室温孵育1 h,TBST洗涤3次,二抗HRP-羊抗鼠稀释至1∶5 000后室温孵育1 h,最后洗涤5次,ECL显色。
1.2.13 双抗夹心ELISA效果验证 用方阵滴定法验证双抗夹心效果。用包被液将单克隆抗体(起始浓度均调整为1 mg/mL)按1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400、1∶12 800和1∶25 600稀释后,分别横向加入酶标板中,每个稀释度重复12孔,每孔100 μL,包被酶标板,置2~8℃过夜。次日弃去板孔中包被液,洗板1次,加入200 μL封闭液,置37℃作用2 h,弃去板孔中封闭液,拍干;将已获得的阴性样本(N)和阳性样本(P)分别加入酶标板中,N加入1~6列,P加入7~12列,均是50 μL/孔,再将IgG-HRP酶标抗体(起始浓度为1 mg/mL)按1∶500、1∶1 000、1∶2 000、1∶4 000、1∶8 000和1∶16 000稀释,纵向加入酶标板中,每个稀释度加1列(8孔)。37℃孵育30 min,洗板3次;拍干后加入TMB底物,室温避光反应10 min,以2 mol/L硫酸溶液终止。酶标仪测定OD450nm值,计算P/N值。
2 结果
2.1 重组表达质粒的构建与鉴定
挑取单菌落,对重组PUC57克隆载体进行BamHⅠ和EcoRⅠ双酶切,酶切产物进行1%琼脂糖凝胶电泳,电泳结果可见1条约2 668 bp的载体条带和一条约561 bp的目的片段条带,与预期大小相符(图1)。将获得的IFN-γ基因扩增产物经BamHⅠ、EcoRⅠ双酶切后连接到pFastBac1载体上,转化到DH5α后,将菌液涂布在平板上,挑取单菌落后提取质粒经BamHⅠ、EcoRⅠ双酶切鉴定,经1%琼脂凝胶电泳后出现了一条约5 500 bp左右的载体片段和一条约561 bp左右的目的片段,大小与预期一致(图1),表明重组表达质粒pFastBac1-IFN-γ已构建成功。

M.DNA标准DL5 000; 1.IFN-γ基因克隆载体双酶切产物; 2.重组质粒pFastBac1-IFN-γ双酶切产物
2.2 重组杆粒Bacmid-IFN-γ的构建与鉴定
将质粒pFastBac1-IFN-γ转化至DH10Bac,涂布到平板上,倒置培养,48 h后挑选白色单菌落涂布到平板,连续两次后,挑选白色单菌落扩大培养,使用杆状病毒穿梭载体Bacmid小量抽提试剂盒提取杆粒,并用M13引物对杆粒进行鉴定,经1%琼脂凝胶电泳分析,结果显示一条约2 800 bp左右的载体片段,大小与预期一致(图2)。IFN-γ引物扩增后将片段送去测序,序列比对结果表明,插入到载体中的序列与 GenBank 中公布的牛IFN-γ序列完全一致,阅读框也未发生移码,说明重组质粒插入序列正确。

M.DNA标准DL5 000; 1.M13的PCR产物
2.3 重组蛋白的表达、纯化与鉴定
收获P2代杆状病毒,感染处于对数生长期的Sf9细胞,72 h后收集细胞培养液上清,纯化后经SDS-PAGE鉴定,在19 ku左右出现一条带(图3),与预期大小相符合。Western blot结果显示,在19 ku、22 ku和38 ku处各有一条带(图3),说明该重组蛋白具有良好的反应原性。商品化的试剂盒检测纯化的IFN-γ蛋白,当蛋白浓度为0.125 μg/mL时,OD450nm值仍高于1.0(表2),说明该蛋白具有较好的反应原性。

M.蛋白分子质量标准; 1.纯化的rIFN-γ-Bac重组蛋白; 2.rIFN-γ-Bac重组蛋白
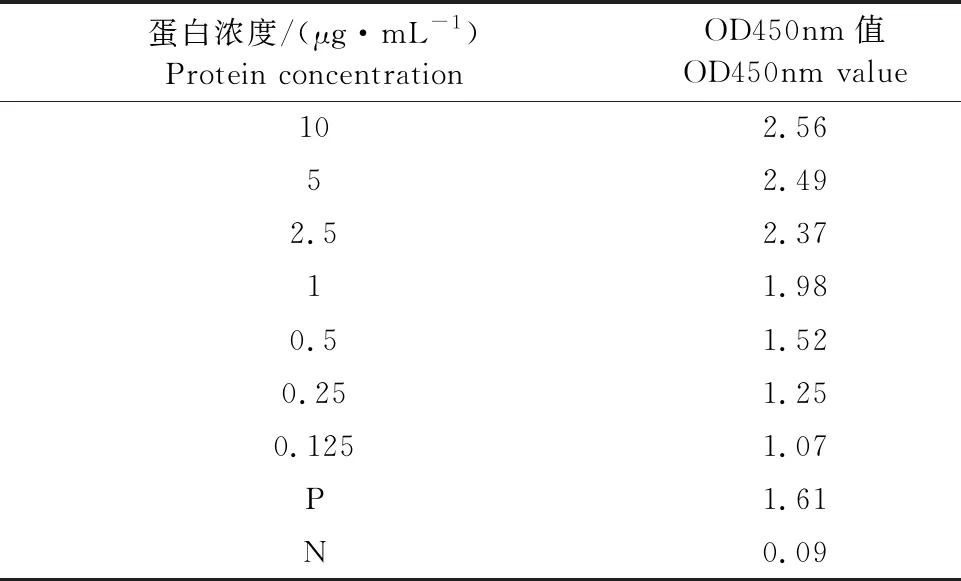
表2 商品化试剂盒检测IFN-γ蛋白结果
2.4 单克隆抗体的制备与鉴定
共获得4株能稳定分泌抗牛IFN-γ蛋白的单克隆抗体杂交瘤细胞株,用单抗亚类鉴定试剂盒鉴定,4C3单抗亚类为IgG2a型,2A9、4H11和5B12单抗亚类均为IgG2b型(图4),轻链均为κ链。间接ELISA法检测腹水效价均高于1∶5.12×106,4C3腹水效价最高(图5)。诱生的小鼠腹水纯化后,经SDS-PAGE电泳鉴定,在50 ku和25 ku附近有两条清晰的带(重链、轻链各一条),而无其他条带(图6)。BCA测定单克隆抗体浓度,并将浓度调整为1 mg/mL。HRP标记每株单克隆抗体1 mg,其他未标记的单克隆抗体置于-20℃保存备用。
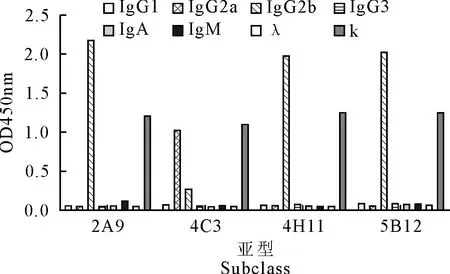
图4 单克隆抗体亚型鉴定

图5 腹水中单克隆抗体效价检测
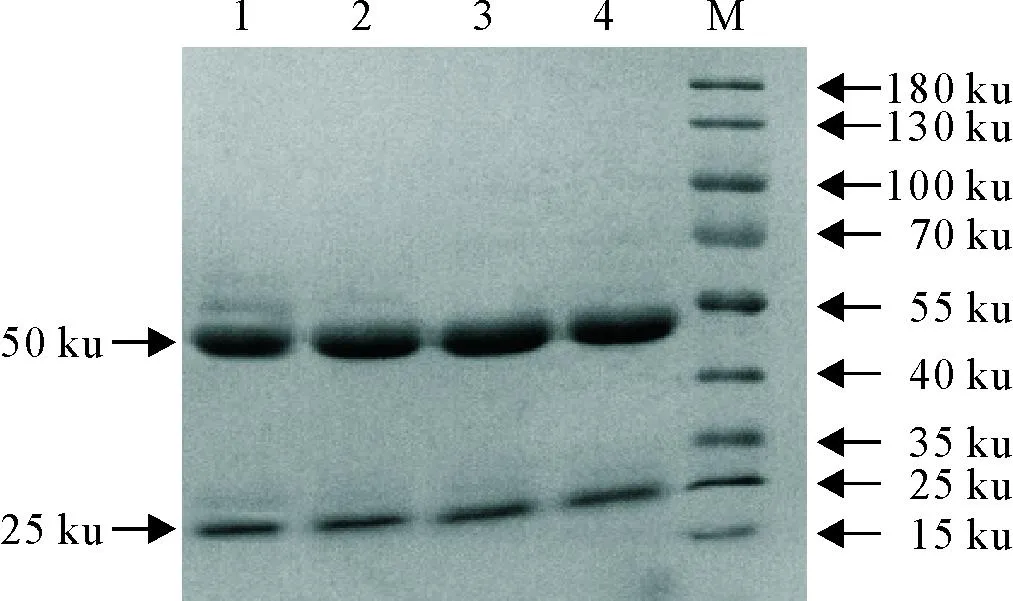
M.蛋白分子质量标准; 1~4.纯化后的单克隆抗体
2.5 单克隆抗体的表位分析
用相加ELISA试验检测各株单抗针对牛IFN-γ抗原表位情况,按照公式计算AI指数,可知筛选到的单抗4H11与2A9、4C3与2A9、5B12与2A9、4H11与2A9、4H11与5B12所针对的抗原表位相同或相近;单抗4C3与4H11、4C3与5B12所识别的抗原表位可能不同(表3和表4)。

表3 相加ELISA试验OD450nm值

表4 相加ELISA试验AI计算结果
2.6 单克隆抗体与重组IFN-γ蛋白的反应原性
进一步验证4C3、4H11与重组IFN-γ蛋白的反应原性,Western blot结果显示,4C3和4H11在19 ku和38 ku处各有一条较明显的带(图7),表明该重组蛋白具有良好的反应原性。

M.蛋白分子质量标准; 1.4C3; 2.4H11
2.7 双抗夹心ELISA效果验证
根据相加ELISA试验结果,4C3与4H11、4C3与5B12所识别的抗原表位可能不同。以4C3作为包被抗体,4H11-HRP和5B12-HRP分别作为检测抗体,进行双抗夹心ELISA效果验证。结果显示,当4H11-HRP作为检测抗体时,P/N值最高可达22.875,具有较明显的夹心效果(表5~表8)。

表5 4C3/4H11-HRP双抗夹心ELISA OD450nm值
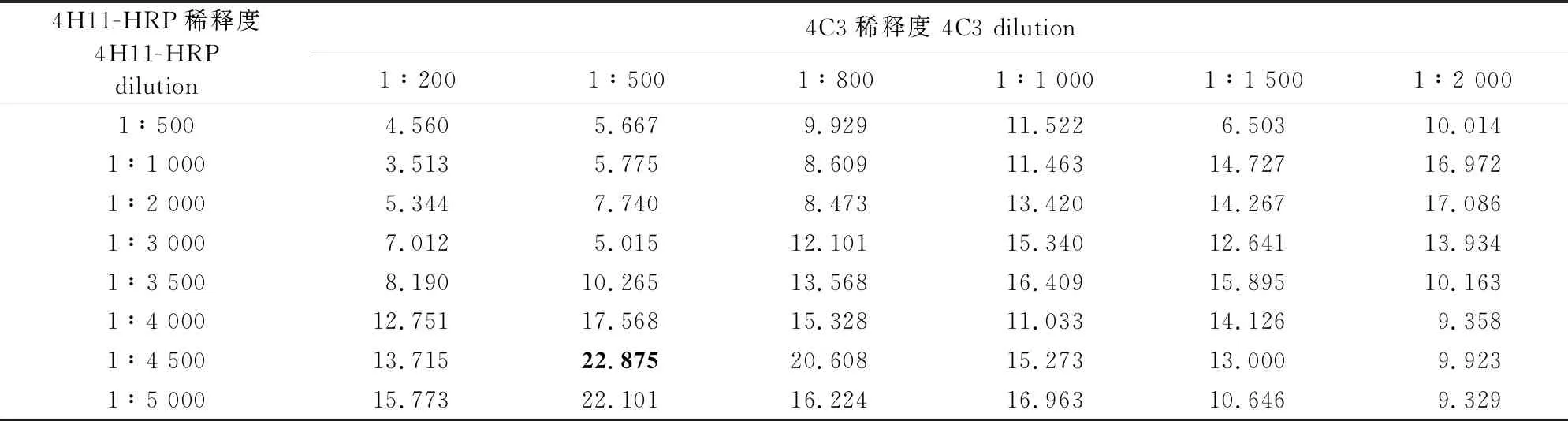
表6 4C3/4H11-HRP双抗夹心ELISA P/N计算结果

表7 4C3/5B12-HRP双抗夹心ELISA OD450nm值

表8 4C3/5B12-HRP双抗夹心ELISA P/N计算结果
3 讨论
牛结核病的主要防控策略是“检疫-扑杀”,因此早期快速有效的诊断有利于控制和切断病原传播。IFN-γ体外释放检测法是目前比较认可的早期诊断方法[18-19]。牛IFN-γ是一种分泌性糖蛋白,活性形式是牢固的二聚体或四聚体,具有复杂的空间结构和抗原表位[20]。用真核表达系统表达的重组蛋白制备单克隆抗体优于原核表达的蛋白[14]。本研究用杆状病毒系统表达重组IFN-γ蛋白,与细菌、酵母和哺乳动物细胞表达系统相比,杆状病毒表达系统具有表达产量高,产物可以进行翻译后加工的优点。另外,重组IFN-γ蛋白为分泌性表达,保证了其正确的折叠和翻译后修饰,进而保证免疫原性,更适用于单克隆抗体的制备。本研究用杆状病毒系统成功表达了重组牛IFN-γ,经纯化后获得了较高纯度的重组蛋白;Western blot结果显示表达的重组蛋白在19 ku、22 ku和38 ku处各有条带,可能与糖基化修饰和形成二聚体有关,而天然IFN-γ一般以二聚体的形式存在,同时存在2个潜在的糖基化位点,因此其空间结构更接近天然IFN-γ的构象。通过商品化试剂盒检测纯化的重组IFN-γ蛋白的结果,也进一步证实了该蛋白具有较强的反应原性。本研究用常规方法进行单克隆抗体的制备,共获得4株针对重组IFN-γ的单克隆抗体,用临床筛选的阴性和阳性样本进行验证,筛选出了2株具有较好夹心效果的单克隆抗体,为后续牛结核病IFN-γ体外释放ELISA检测试剂盒的研发奠定了基础。

